金蒿抗流感滴丸一枝蒿酮酸和金丝桃苷的肠吸收特性研究
2013-11-01顾政一贺金华沙先谊方晓玲
杨 希,顾政一,贺金华,沙先谊,方晓玲
(1.新疆维吾尔自治区药物研究所,新疆乌鲁木齐 830004;2.新疆医科大学药剂教研室,新疆乌鲁木齐 830054;3.复旦大学药学院药剂教研室,上海 201203)
金蒿抗流感滴丸由新疆一枝蒿和贯叶金丝桃两味药材组成。一枝蒿具有抗炎、抗肿瘤、抗过敏、活血、保肝、解蛇毒等作用[1],贯叶金丝桃具有清热解毒、收敛止血、利尿等作用[2],两味药材均属维吾尔医常用的药材。近年来人们发现一枝蒿中倍半萜类化合物一枝蒿酮酸、贯叶金丝桃中黄酮类成分金丝桃苷具有保肝,抗病毒,抗菌等作用[3-4],为金蒿滴丸的有效成分,故选用一枝蒿酮酸、金丝桃苷作为金蒿滴丸的指标成分,评价金蒿滴丸的小肠吸收。
肠道是药物经口服给药后的主要吸收部位,其中小肠是最重要的吸收场所,它由十二指肠、空肠、回肠组成。由于小肠中存在球状皱褶、绒毛和微绒毛,使小肠拥有强大的吸收表面积。药物可以经过小肠微绒毛的上皮细胞进入血管、淋巴管以及神经纤维的固有层,大部分的药物在这里被吸收和转运,另有部分在经过胃和小肠时未被吸收的药物,可以在结肠部位被吸收。因此,研究药物的肠吸收主要考察这四段肠道的吸收特征来指导和评价药物的剂型和工艺的研究[5-6]。
1 材料
1.1 药物与试剂 一枝蒿酮酸对照品(Ra,HPLC法纯度>98%,由中国科学院新疆理化技术研究所提供,批号20081022);金丝桃苷对照品(Hp,HPLC法纯度>98%,由上海君创生物科技有限公司提供);金蒿抗流感滴丸(批号090714,由新疆药物研究所药剂科室提供);甲醇(色谱纯)、磷酸、二甲亚砜、氯化钠、氯化钾、磷酸二氢钠、碳酸氢钠、葡萄糖、氯化镁、氯化钙(分析纯,国药集团化学试剂有限公司)。
1.2 仪器 高效液相色谱仪(包括LC—15C泵,SPD—10A检测器)(Shimadzu,日本);岛津高效液相色谱LC工作站;色谱柱Hypersil CN(5μm,4.6 mm×150 mm)(依利特,大连);XW—80A型漩涡混合器(上海医科大学仪器厂);DSHZ-300多用途水浴恒温振荡器(江苏太仓市实验设备厂);HL—2恒流泵(上海沪西仪器厂有限公司)。
1.3 实验动物 SD大鼠,体质量250~300 g,雄性,清洁级,复旦大学动物实验中心提供。
2 方法[7]
2.1 试液的配制 一枝蒿酮酸标准贮备液:一枝蒿酮酸标准品10 mg,置10 mL量瓶中,加DMSO至刻度,得一枝蒿酮酸标准贮备液1 mg/mL。
金丝桃苷标准贮备液:金丝桃苷标准品10 mg,置10 mL量瓶中,加DMSO至刻度,得金丝桃苷标准贮备液1 mg/mL。
金蒿滴丸溶液:233 mg金蒿滴丸,置100 mL量瓶中,加K-R液至刻度,得金蒿滴丸溶液2.33 mg/mL(其中一枝蒿酮酸质量浓度为10μg/mL,金丝桃苷质量浓度为33μg/mL)。
pH 7.4的Kreb's-Ringer试液(K-R液)的配制:分别称取氯化钠7.8 g,氯化钾0.35 g,碳酸氢钠1.37 g,磷酸二氢钠0.32 g,氯化镁0.02 g,葡萄糖1.4 g,加适量的蒸馏水溶解;另取二水氯化钙0.37 g加100 mL蒸馏水溶解,然后两液混和均匀,用 pH 1盐酸液调 pH至 7.4,定容至1000 mL,即得,置4℃保存,备用。
10%水合氯醛试液的配制:称取水合氯醛10 g置100 mL量瓶中,加生理盐水溶解,定容,摇匀,备用。
2.2 金蒿滴丸小肠吸收样品色谱分析方法的建立
2.2.1 色谱分析条件 Hypersil CN色谱柱(150 mm×4.6 mm,5μm);流动相为甲醇-水(含0.4%磷酸) (30∶70,V/V);体积流量1.0 mL/min;检测波长(一枝蒿酮酸为241 nm,金丝桃苷为360 nm);柱温30℃;进样量20μL。
2.2.2 方法专属性 配制质量浓度为2.33 mg/mL金蒿滴丸(一枝蒿酮酸10μg/mL,金丝桃苷33μg/mL)K-R溶液,在上述色谱条件下考察样品分离情况及空白溶剂是否有干扰,考察分析方法的专属性。
2.2.3 标准曲线 一枝蒿酮酸、金丝桃苷标准贮备液用K-R液配制成质量浓度分别为0.05、0.10、0.20、1.00、5.00、10.00、20.00、50.00μg/mL的标准稀释液,置4℃下保存,于上述色谱条件下测定,重复3次。将一枝蒿酮酸、金丝桃苷色谱峰面积对浓度按最小二乘法进行线性回归,所得线性方程即为标准方程。
2.2.4 精密度 标准贮备液用K-R液配制成质量浓度为0.05、1.00、50.00μg/mL的标准稀释液(各5份),在日内和连续5 d内按上述色谱条件测定一枝蒿酮酸、金丝桃苷的量,得方法的日内和日间精密度。
2.2.5 回收率 一枝蒿酮酸、金丝桃苷标准贮备液用空白肠内液配制质量浓度为 0.05、1.00、50.00μg/mL的标准稀释液各5份,以上述色谱条件下,HPLC测定,根据标准曲线计算样品中一枝蒿酮酸、金丝桃苷浓度并求算得方法回收率。
2.3 金蒿滴丸有效成分一枝蒿酮酸、金丝桃苷在Krebs-Ringer营养液中的稳定性 用K-R液配制金蒿滴丸溶液2.33 mg/mL(一枝蒿酮酸质量浓度为10μg/mL,金丝桃苷质量浓度为 33μg/mL),先将Krebs-Ringer预热至37℃涡旋10 s,置于37℃水浴,75 r/min孵育,分别于0、0.5、1、2、4、6、8 h取样,与200μL甲醇混合终止反应,涡旋,10000 r/min离心,20μL进样。以上述色谱条件下HPLC法测定,根据标准曲线计算样品中一枝蒿酮酸、金丝桃苷质量浓度。
2.4 大鼠不同肠段在体肠灌流实验[8-13]
2.4.1 实验装置 实验前,先将已配置好的质量浓度为2.33 mg/mL金蒿滴丸溶液于恒温水浴锅中37℃预热。取体质量为250~300 g雄性SD大鼠,禁食12 h(自由饮水)。实验时先采用含10%水合氯醛试液腹腔注射,麻醉并且固定,并背位固定于解剖板上,保持37℃体温。首先沿腹中线从胸骨往下剃掉鼠毛,再用酒精棉球消毒露出的皮肤,并延腹中线剑突处开始,用手术刀纵向切开长约1.5 cm的口,打开腹腔,先找到胃,再分别沿幽门1 cm处为十二指肠开端,再往下10 cm为十二指肠的末端,此末端下4 cm为空肠的开端,沿开端向下10 cm为空肠的末端。然后再将大鼠的盲肠分离出,盲肠的上端10 cm为回肠的末端,再向上10 cm作为回肠的开端,盲肠的下端即为结肠的开端,开端往下10 cm为结肠的末端。分离好四段肠的开端和末端后,分别于各肠段的两端切口,用约40 mL预热至37℃的生理盐水缓缓地冲洗各肠段的肠内容物。分别于各肠段的开端切口处插管约1 cm,末端处接出液口插管,结扎。将种肠段插管安好后,将盲肠放回腹腔中,并将其它外露的肠段按原状放回至大鼠腹腔中,并在伤口用浸有生理盐水的纱布,保持湿润,并用红外灯保持大鼠体温。实验前用先用台氏液注满整个的管路,排除管路中的空气,然后以体积流量0.2 mL/min平衡20 min后,将每个肠段的进口管分别放入到装有约10 mL已知重量的供试液的小瓶的液面下,开始灌流,体积流量为0.2 mL/min,在各段肠的出口处每隔30 min采用已知重量的小瓶收集灌流液,称量供试液小瓶和接收液小瓶的质量,并测定一枝蒿酮酸、金丝桃苷的质量浓度,实验持续时间为120 min。最后将大鼠断颈椎处死,取下灌流的肠段,测量该肠段的长度(L)和周长(d),并计算出它们的半径(r),实验示意图如图1所示。
2.4.2 数据处理 采用重量法按以下公式计算药物的吸收速率常数(Ka)和表观吸收系数(Peff)。

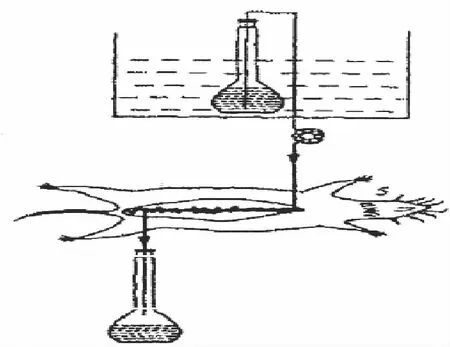
图1 大鼠在体肠灌流实验装置Fig.1 Rat single-pass intestinal perfusion instrument
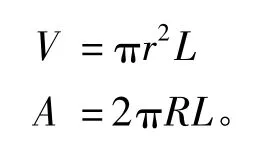
式中:Cout为接收液的质量浓度(μg/mL);Cin为供给液的质量浓度(μg/mL);Qin为灌流体积流量(mL/min);V为灌流肠段的体积(mL);Vin为供给液的体积;Vout为接收液的体积(mL)(假定供试液密度为1.0 g/mL);A为灌流肠段的表面积(cm2)。
2.4.3 样品处理 取肠灌流样品 100μL,与200μL甲醇沉淀蛋白,高速离心10 min(10000 r/min),取上清液20μL进样。
3 结果
3.1 金蒿滴丸中一枝蒿酮酸和金丝桃苷小肠吸收样品色谱分析方法的验证
3.1.1 专属性考察 HPLC分析空白K-R液、一枝蒿酮酸、金丝桃苷对照品溶液和经过肠液后的含有药物的灌流液,在一枝蒿酮酸、金丝桃苷出峰处无杂峰对含药量无干扰,表明专属性良好(结果见图2)。
3.1.2 标准曲线 精密量取对照品贮备液分别制成质量浓度为 0.05、0.50、2.00、4.00、8.00、10.00、20.00、50.00μg/mL 的对照品溶液,取20μL进样,记录色谱图,以峰面积(Y)为纵坐标,对照品质量浓度(X)为横坐标,进行线性回归。一枝蒿酮酸的线性回归方程分别为Y=90284X-50054,r=0.9992;金丝桃苷的线性回归方程分别为 Y=39558X-16405,r=0.9999。结果表明,一枝蒿酮酸和金丝桃苷质量浓度在0.05~50μg/mL范围内均与色谱峰面积呈良好线性关系。
3.1.3 方法精密度 同一份样品高中低3个质量浓度分别于1 d内连续进样5次和5 d内进样5次,记录峰面积,计算含量。实验结果表明一枝蒿酮酸高中低3个质量浓度日内精密度的RSD(%)分别为 1.59、1.26和 0.78,日间精密度的 RSD(%)分别为1.62、1.47和1.01;金丝桃苷高中低3个质量浓度日内精密度的RSD(%)分别为1.37、1.42和0.69,日间精密度的RSD(%)分别为1.52、1.48和1.05,符合要求。

图2 金蒿滴丸在K-R液中高效液相色谱图Fig.2 Chromatograms of Jinhao Kangliugan Dropping Pills in K-R solution
3.1.4 方法回收率 回收率结果均大于98%(结果见表1)。
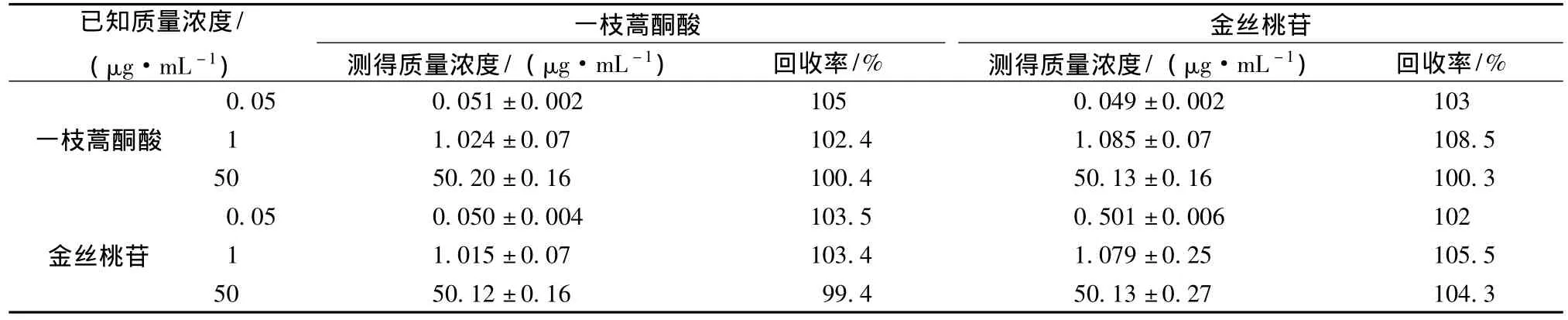
表1 高效液相色谱法测定一枝蒿酮酸、金丝桃苷的方法回收率Tab.1 Recovery of determination of rupestonic acid and hyperoside by HPLC
3.2 金蒿滴丸有效成分在Krebs-Ringer营养液中的稳定性 结果表明金蒿滴丸中一枝蒿酮酸、金丝桃苷在pH 7.4的Krebs-Ringer营养液中2 h内能够保持相对稳定(结果见图3)。

图3 一枝蒿酮酸和金丝桃苷在Krebs-Ringer营养液中的稳定性(n=3)Fig.3 Stability of rupestonic acid and hyperoside in K-R solution
3.3 金蒿滴丸的大鼠在体单向灌流实验
3.3.1 金蒿滴丸中一枝蒿酮酸和金丝桃苷不同肠段吸收情况考察
3.3.1.1 金蒿滴丸中一枝蒿酮酸的吸收情况考察
金蒿滴丸有效成分一枝蒿酮酸在空肠部位吸收的Ka和Peff最高,显著高于十二指肠、回肠和结肠。表明金蒿滴丸中一枝蒿酮酸的肠段吸收具有pH差异性,主动转运载体存在分布特异性,在小肠上端吸收较好。结果见图4。
3.3.1.2 金蒿滴丸中金丝桃苷的吸收情况考察金蒿滴丸有效成分金丝桃苷在十二指肠和空肠部位吸收的Ka和Peff较高,显著高于回肠和结肠。表明金蒿滴丸中金丝桃苷的肠段吸收具有pH差异性,主动转运载体存在分布特异性,在小肠上端吸收较好。结果见图5。影响;ATP抑制剂叠氮化钠(SOD)对金蒿滴丸有效成分一枝蒿酮酸肠段吸收有显著影响,显著降低了一枝蒿酮酸在十二指肠、空肠肠段吸收的Ka和Peff,对小肠下端的抑制不明显,进一步说明主动转运载体的分布具有生理部位特异性。结果见图6和图7。
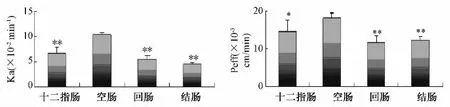
图4 金蒿滴丸中一枝蒿桃苷在十二指肠、空肠、回肠、结肠的Ka和Peff(n=6)Fig.4 Kaand Peffof rupestonic acid in Jinhao Kangliugan Dropping Pills in intestine(n=6)
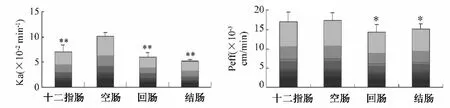
图5 金蒿滴丸中金丝桃苷在十二指肠、空肠、回肠、结肠的Ka和Peff(n=6)Fig.5 Kaand Peffof hyperoside in Jinhao Kangliugan Dropping Pills in intestine(n=6)

图6 P-gp抑制剂维拉帕米(VER)对金蒿滴丸中一枝蒿酮酸(Ra)肠段吸收的影响(n=6)Fig.6 Effects of P-gp inhibinitors(VER)on Ra absorption in Jinhao Kangliugan Dropping Pills(n=6)
3.3.2 抑制剂对金蒿滴丸中一枝蒿酮酸和金丝桃苷肠段吸收的影响
3.3.2.1 P-gp抑制剂(维拉帕米)、ATP抑制剂(叠氮化钠)对金蒿滴丸有效成分一枝蒿酮酸肠吸收的影响 P-gp抑制剂维拉帕米(VER)对金蒿滴丸有效成分一枝蒿酮酸的小肠吸收没有显著性的

图7 ATP抑制剂叠氮化钠(SOD)对金蒿滴丸中一枝蒿酮酸(Ra)肠段吸收的影响(n=6)Fig.7 Effects of ATP inhibinitors(SOD)on Ra absorption in Jinhao Kangliugan Dropping Pills(n=6)
3.3.2.2 P-gp抑制剂(维拉帕米)、ATP抑制剂(叠氮化钠)对金蒿滴丸有效成分金丝桃苷肠段吸收的影响 P-gp抑制剂维拉帕米(VER)对金蒿滴丸有效成分金丝桃苷的小肠吸收有显著性的影响,对金丝桃苷在小肠上端吸收的抑制要更为显著;ATP抑制剂叠氮化钠(SOD)对金蒿滴丸有效成分金丝桃苷在四个肠段的吸收均有显著影响,显著降低了金丝桃苷在十二指肠、空肠、回肠、结肠吸收的Ka和Peff,进一步说明主动转运载体的分布具有生理部位特异性。结果见图8和图9。
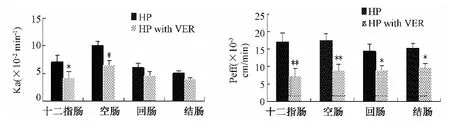
图8 P-gp抑制剂维拉帕米(VER)对金蒿滴丸中金丝桃苷(HP)肠段吸收的影响(n=6)Fig.8 Effects of P-gp inhibinitors(VER)on Ra absorption in Jinhao Kangliugan Dropping Pills(n=6)

图9 ATP抑制剂叠氮化钠(SOD)对金蒿滴丸中金丝桃苷(HP)肠段吸收的影响(n=6)Fig.9 Effects of ATP inhibinitors(SOD)on Ra absorption in Jinhao Kangliugan Dropping Pills(n=6)
4 讨论
研究药物的肠吸收方法主要有在体法和离体法。由于离体法需要从动物体内把肠段组织取出,易致肠段供血缺乏,而使细胞旁通路受阻和药物代谢酶活性降低,影响药物的吸收,与实际药物的体内吸收数值偏差较大。所以,在研究药物吸收时在体法更能接近药物的体内吸收程度而被广大研究者所接受。在体法,又分为单向灌流法和在体循环法。在体循环法由于长时间高流速的冲洗肠道,肠黏膜有可能受损,使药物吸收增大,造成不必要的实验偏差,结果仍不可靠。而单向灌流法(single pass intestine perfusion,SPIP),以低体积流量(0.2~0.3 mL/min),短时间(2~3 h)来模拟正常生理状态的体内环境,使实验结果更能反映真实的肠道吸收特征和程度[14-15]。
本实验主要采用在体单向灌流法考察了金蒿滴丸中一枝蒿酮酸和金丝桃苷在不同肠段的吸收速率常数(Ka)和表观吸收系数(Peff)。从结果可以看出,金蒿滴丸有效成分一枝蒿酮酸和金丝桃苷在小肠上端吸收较好,肠段吸收具有pH差异性,主动转运载体存在分布特异性。文献报道,大鼠Peff>1.2×10-2cm/min表示易于吸收,而当Peff<1.8×10-3cm/min时表示药物难以吸收,所以金蒿滴丸在小肠的吸收较好[16]。
抑制剂对金蒿滴丸中一枝蒿酮酸和金丝桃苷的小肠吸收影响实验中,P-gp抑制剂维拉帕米对金蒿滴丸有效成分金丝桃苷在小肠上端的吸收有更为显著的影响,对一枝蒿酮酸的吸收没有显著影响;ATP抑制剂叠氮化钠(SOD)显著降低了金蒿滴丸有效成分一枝蒿酮酸在小肠上端吸收有显著影响,同时也显著性抑制了金丝桃苷在四个肠段的吸收的Ka和Peff。进一步表明主动转运载体的分布具有生理部位特异性。
[1]王 燕,吐尔洪·阿西木,堵年生.新疆一枝蒿化学成分的研究[J].新疆医科大学学报,2004,27(4):361-363.
[2]刘 发,斯拉甫·艾白.维药贯叶金丝桃的研究进展[J].中国民族医药杂志,2008,9(9):53-56.
[3]徐广顺,陈希元,于德泉.新疆一枝蒿新倍半萜成分—一枝蒿酮酸的结构[J].药学学报,1988.23(2):122-125.
[4]王怀冲,范国荣.贯叶连翘提取物中金丝桃苷的分析鉴别与稳定性研究[J].时珍国医国药,2006,17(12):2544-2546.
[5]沈 凯,王景田.药物肠吸收实验研究方法进展[J].中国新药杂志,2003,12(12):988-990.
[6]高 坤,孙 进,何仲贵.口服药物吸收中的生物药剂学性质[J].沈阳药科大学学报,2007,24(3):186-189.
[7]杨 希.金蒿抗流感滴丸的生物药剂学与药物动力学研究[D].新疆医科大学,2012.
[8]聂淑芳,潘卫三,李 伟,等.长春西汀的大鼠在体肠吸收研究[J].中国医药工业杂志,2005(10):625-628.
[9]Dahan A,West B T,Amidon G L.Segmental-dependent membrane permeability along the intestine following oral drug administration:E-valuation of a triple single-pass intestinal perfusion(TSPIP)approach in the rat[J].Eur J Pharm Sci,2009,36(2-3):320-329.
[10]郑雪静,赵庆春,颜 鸣,等.盐酸洛美沙星大鼠在体肠吸收动力学研究[J].实用药物与临床,2011(1):25-27.
[11]孙佳轶,郭 盼,潘裕生,等.依托度酸大鼠在体肠吸收动力学[J].沈阳药科大学学报,2010(9):754-758.
[12]Sutton S C,Rinaldi M T,Vukovinsky K E.Comparison of thegravimetric,phenol red,and 14C-PEG-3350 methods to determine water absorption in the rat single-pass intestinal perfusion model[J].AAPS Pharm Sci,2001,3(3):E25.
[13]Wu Y N,Luan L B.In situ rats single pass perfusion intestinal absorption of the effectivein components in Radix Angelicae Pubescentis[J].Yao Xue Xue Bao,2008,43(1):102-107.
[14]程锦狄留庆.在体肠段灌流模型在中药吸收研究中的应用[J].中国中医药信息杂志,2008,15(2):98-100.
[15]谭晓斌,贾晓斌,陈 彦.在体肠灌流模型及其在中药研究中的应用[J].中成药,2007,29(11):1665-1668.
[16]Fagerholm U,Johansson M,Lennernas H.Comparison between permeability coefficients in rat and human jejunum[J].Pharm Res,1996,13(9):1336-1342.
