利用Cre/LoxP系统删除转基因山羊体内的选择标记基因
2013-10-31兰翀任丽娜吴敏刘思国刘国辉徐旭俊陈建泉马恒东成国祥
兰翀,任丽娜,吴敏,刘思国,刘国辉,徐旭俊,陈建泉,马恒东,成国祥
1 四川农业大学动物遗传育种研究所,四川 雅安 625014
2 上海转基因动物育种与制药工程技术研究中心 上海杰隆生物工程股份有限公司,上海 201210
转基因技术是当今基因工程领域中的重要应用性新技术。在植物新品种培育方面,利用转基因技术已获得了许多植物新品种,显著改善了农艺性状[1]。但在家畜新品种培育方面,转基因技术的成功案例仅局限在牛、羊上的几例[2],还需要进行完善和优化。目前,转基因家畜主要是通过体细胞遗传修饰联合体细胞克隆技术获得的[3]。在细胞遗传修饰期间不可避免的需要用筛选标记基因 (Selectable marker genes,SMGs)来富集转基因成功的细胞,之后不仅不再需要SMGs,还可能因其整合位点毗邻目的基因而影响目的蛋白的表达[4]。此外,我国的转基因安全评价政策将SMGs视同目的基因,要求进行复杂的安全评价[5]。
由上可见,删除SMGs不仅可以优化转基因的表达,还可以简化转基因动物的安全评价过程,加快转基因动物新品种的培育和产业化进程。之前,我们曾利用 Cre/LoxP系统成功删除了人溶菌酶转基因山羊体内的 SMGs[6]。但该过程需要两轮细胞遗传修饰和体细胞克隆过程,周期长,获得SMGs删除的转基因山羊至少需要2年才能完成。本文研究了在体细胞克隆前后两个时段内,利用 Cre/LoxP系统删除标记基因的可行性,比较了蛋白转导和质粒共转染两种 CRE蛋白导入方式的删除效率,获得了删除转基因山羊体内SMGs的时机和方法。
1 材料与方法
1.1 材料与试剂
人溶菌酶转基因山羊(Human lysozyme transgenic goats,hLYZ-G)人溶菌酶基因与SMGs紧密连锁,整合于山羊的5号染色体上,排列顺序为 5'-[LoxP→-neo-TK-LoxP→]-[人溶菌酶表达框架]-3'[6];sCT-G,hLYZ-G 为上海杰隆生物工程股份有限公司/上海转基因研究中心研制。SMGs载体质粒为 pGH4,实验室自存,内含有neoR和TK两种筛选基因以及LoxP位点,排列方式为:5'-LoxP→-neo-TK-LoxP→-3'。表达Cre蛋白质的质粒pBS185 (Addgene)。GMEM完全培养液:添加有10% FBS、青链霉素和非必需氨基酸的GMEM培养液 (GIBCO);GMEM筛选培养液:含有1 000 μg/mL G418的GMEM完全培养液。
1.2 TAT-Cre酶的制备、活性测定与细胞转染
TAT-Cre酶的表达与纯化方法参照文献[6]进行。TAT-Cre酶的活性测定:在酶切反应液(33 mmol/L NaCl, 50 mmol/L Tris-HCl (pH 7.5),10 mmol/L MgCl2)中加入1 μg的pGH4质粒和0.1 μg的TAT-Cre酶,37 ℃温育4 h,琼脂糖凝胶电泳检测酶切情况。
TAT-Cre蛋白转染按文献[6]进行,简述为:细胞生长至 90%汇合度时,PBS洗 3次,加入2 μmol/L 的 TAT-Cre酶,37 ℃、5% CO2培养 3 h后,PBS洗3次,换GMEM完全培养液培养1 d,之后按 100个细胞/皿传至 100 mm细胞培养皿中,添加GMEM选择培养液培养10 d后,利用克隆环法挑取单克隆细胞并进行扩大培养。
1.3 体细胞克隆山羊的制备和山羊成纤维细胞的分离
人工合成鲑鱼降钙素 (Salcalcitonin,sCT)基因(5'-atgaaggtcctcatccttgcctgtctggtggctctggccattgca caccaccaccaccaccacagaagaagaagaaagtgcagcaacctgag cacctgcgtgctgggcaagctgagccaggagctgcacaagctgcaga cctaccccgtgaccaacaccggcagcggcacccccggctaa-3'),将之装入牛β-乳球蛋白启动子调控的乳腺特异表达载体pBLG内,成为鲑鱼降钙素乳腺特异表达载体pBLG-sct。将pBLG-sct与SMGs载体pGH4共转染山羊胎儿成纤维细胞,经筛选和鉴定获得sCT基因整合细胞株并制备出体细胞克隆山羊,具体方法参见文献[9]。
按照文献[7]提供的方法分离鲑鱼降钙素转基因山羊 (Salcalcitonin transgenic goats,sCT-G)和人溶菌酶转基因山羊的耳皮成纤维细胞,分别命名为sCT-G-EFC和hLYZ-G-EFC。按照文献[8]分离正常山羊的 32 d胎儿成纤维细胞(Fetal fibroblasts of normal goat,G-FF)。
1.4 TAT-Cre蛋白转导细胞
细胞在培养皿中生长至 90%汇合时弃去培养液,PBS清洗细胞,加入OPTI-MEM培养液(GIBCO)稀释的 TAT-Cre酶,使酶终浓度为2 μmol/L,37 ℃、5% CO2培养 3 h后,PBS清洗细胞,换GMEM完全培养液培养,24 h后按100个细胞传至 1个 100 mm细胞培养皿的密度分板,添加GMEM选择培养液培养10 d,利用克隆环法挑取单克隆细胞,按96孔-48孔-24孔-12孔-6孔的顺序进行扩大培养。
1.5 脂质体转染细胞
按 照 Lipofectamine 2000 Transfection Reagent (Invitrogen 11668)的说明进行转染。简述为:在24孔细胞板中,细胞生长至90%汇合时,用 OPTI-MEM培养液稀释 pBS185质粒至10 μg/mL,每 100 μL DNA 中加入 1 μL PLUS 和3 μL脂质体,混匀后获得DNA-lipid复合物;在24孔细胞板中加入DNA-lipid复合物100 μL/孔,37 ℃、5% CO2培养,6 h后换GMEM完全培养基培养,12 h后按 100个细胞/皿的密度传至100 mm细胞培养皿中,按1.4方法进行单克隆细胞的筛选和培养。
1.6 PCR检测
按照细胞基因组提取试剂盒 (TIANGEN Cat No. DP304-03)说明提取细胞基因组,溶于50 μL超纯水中,4 ℃保存。利用表1中的引物检测neoR、β-actin、sCT、cre四种基因进行PCR扩增,条件为:94 ℃预变性5 min,94 ℃变性30 s,退火温度为表1列示,扩增30个循环,LA Taq酶为TaKaRa公司产品。
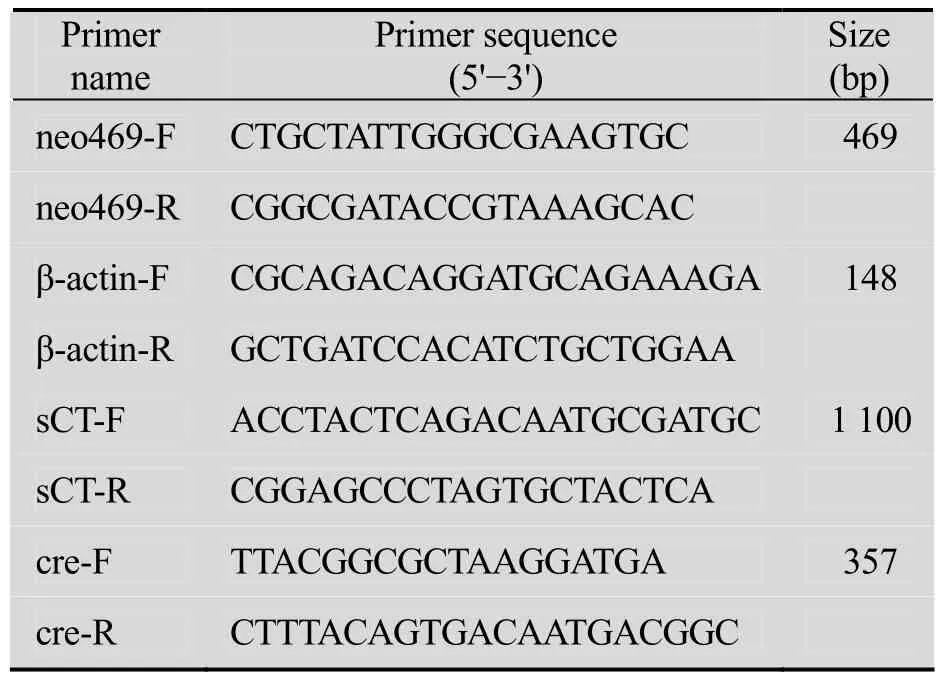
表1 PCR检测检测所需引物序列Table 1 Sequences of detection primers for PCR
2 结果与分析
2.1 TAT-Cre的纯化、浓度与活性测定结果
大肠杆菌中表达纯化的TAT-Cre酶有良好的纯度生物学活性,可有效地将pGH4中3.2 kb的筛选基因切出 (图1A和图1B)。经TAT-Cre转染的人溶菌酶转基因山羊成纤维细胞失去了对G418的抵抗能力,筛选培养4 d后出现了大面积的死亡 (图 1C),说明所纯化的 TAT-Cre具有穿透细胞膜,进入细胞发挥作用的功能。
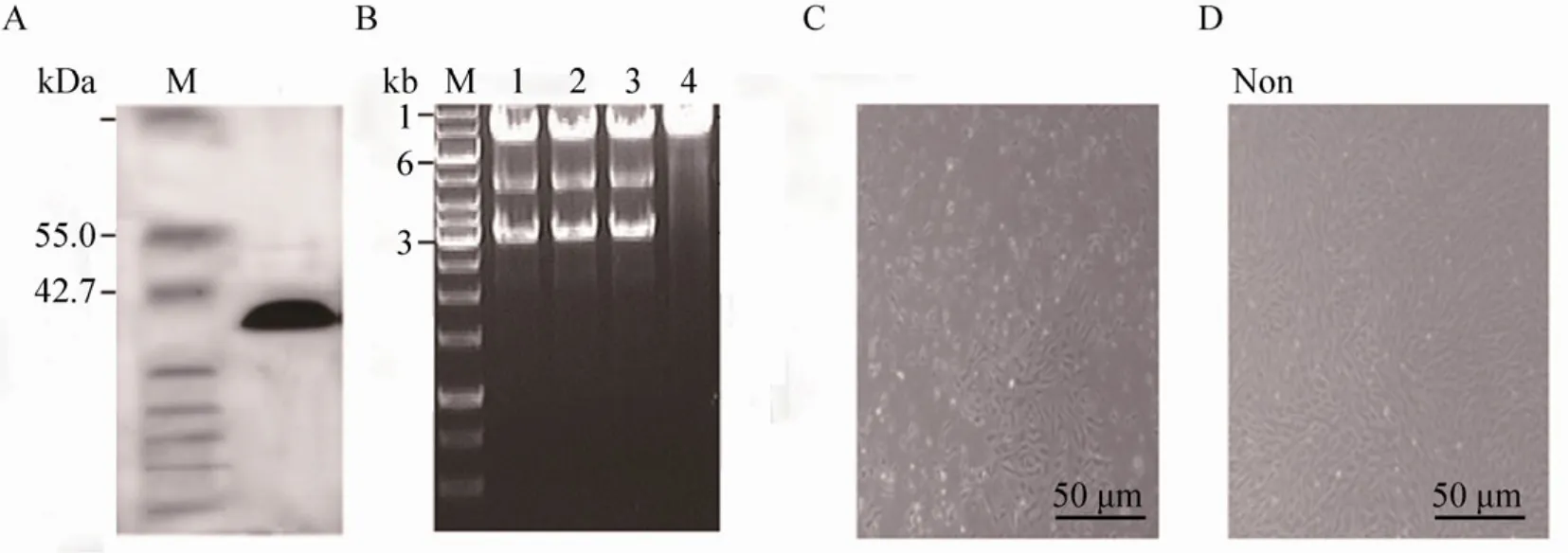
图1 TAT-Cre酶的纯化与活性检测Fig. 1 Purification and activity detection of TAT-CRE enzyme. (A)Identification of TAT-Cre through SDS-PAGE. 1:TAT-Cre; M: protein marker. (B)The activity detection of TAT-Cre in vitro. M: DNA marker; 1–3: the vector digested with TAT-Cre; 2: negative control. (C)TAT-Cre-treated cells with resistance of G418. (D)Normal cells with resistance of G418.
2.2 体细胞克隆前删除标记基因
利用TAT-Cre处理sCT-G的制备过程中得到的7个单克隆细胞株。随后在处理完的7株细胞中各取了100个细胞铺板于100 mm培养皿,10 d后挑出了57个单克隆。经检测,这57株细胞中有25株细胞中的neoR基因被删除 (图2),删除效率达到43.9%。这证明TAT-Cre在第一次细胞转染后即可有效删除与目的基因共整合的标记基因。但这一过程经历了连续两次低密度传代和单细胞克隆的挑取,所获得单细胞克隆严重老化,无法进一步传代,最终未获得可供克隆用的sCT转基因整合的单克隆细胞。
本研究尝试利用pBS185瞬间表达法删除首次转基因克隆内的标记基因,但因细胞老化严重,最终未获得可供检测用的sCT转基因整合的单克隆细胞。

图2 TAT-Cre酶对体细胞克隆前标记基因的删除Fig. 2 Deletion of TAT-Cre on somatic cell marker gene. 1–58: cell clones treated by TAT-Cre; c1-c8:positive cell without TAT-Cre selected by G418.
2.3 体细胞克隆后删除标记基因
用TAT-Cre酶处理hLYZ-G-EFC,挑取了共114个单克隆细胞株,neoR基因检测表明,其中有83个克隆细胞的neoR被成功删除 (图3),删除效率为:83/114=72.81%。
利用pBS185质粒瞬间表达法检测SMGs的删除效率。用 pBS185质粒瞬时转染hLYZ-G-EFC,共挑取了 64个单克隆细胞株,G418杀伤试验表明,其中5个克隆株细胞被杀死,删除效率为7.81% (5/64)。
为进一步验证TAT-Cre蛋白转导法删除标记基因的适用性。用TAT-Cre处理SCT-G-EFC,共挑取了16个克隆,经检测其中有13株细胞克隆中的标记基因被成功删除 (图 4),效率 46.2%(6/13)。这表明,TAT-Cre介导标记基因删除是一种广适性的方法。
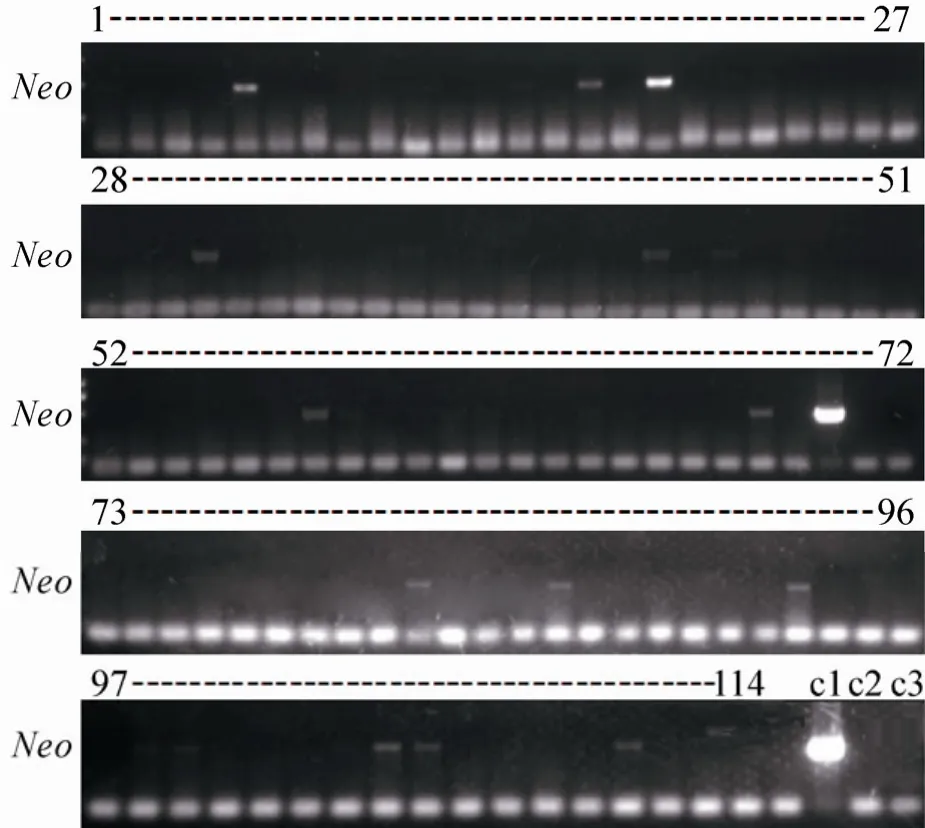
图3 TAT-Cre介导的克隆羊体细胞中 neoR基因的删除Fig. 3 Deletion of neoR gene in selected clone mediated by TAT-Cre. 1–114: selected clone; C1:positive control; C2, C3: blank.

图4 sCT转基因山羊体细胞内标记基因的删除Fig.4 Deletion of marker gene in sCT transgenic goat’s somatic cells. 1–13: selected sCT transgenic fibroblast cell clone; 14: blank; 15: plasmid control.
2.4 Cre质粒瞬时转染方法的载体掺入率
pBS185瞬时转染的方法也可以对SMGS有效删除,但所获得的部分克隆中难免整合有Cre表达质粒的序列。以该法获得9株删除了标记基因的ChLYZ-G-EFC,检测细胞中来自pBS185的Cre基因:有3株细胞整合了Cre基因 (图5),掺入率为33.3%。

图5 pBS185质粒瞬时转染中的质粒序列掺入情况Fig. 5 Condition of plasmid pBS185 sequences enter cell in transient transfection. 1–9: sCT transgenic integrated positive monoclonal cell strains; 2, 3 and 8:pBS185 plasmid sequences exist in clones.
3 讨论
SMGs删除在转基因植物中已较为成熟,主要有转座子介导基因再定位系统、共转化和遗传分离系统、重组酶介导的基因剪切系统和依赖染色体内同源重组的 SMGs切除系统等 4种技术[10]。在转基因动物中,SMGs删除多在ES细胞相关的研究[11],所用技术以同源重组和重组酶系统为主[12]。在大家畜上,因目前还未能建立有效的家畜ES细胞系,利用寿命有限的体细胞难以实现多次遗传修饰。本研究尝试了在体外对山羊胎儿成纤维细胞进行两次遗传修饰,均因细胞老化问题未能获得可供体细胞克隆用的 SMGs删除的转基因细胞株。由此,对SMGs的删除不得不推迟到体细胞克隆之后。在小鼠上,有通过显微注射方法将Cre表达质粒注射入转基因小鼠受精卵内,通过Cre酶的瞬时表达来删除两侧装接loxP的DNA序列的报道[13-14],但该方法低效且存在注射入的质粒整合入基因组内的风险,不适合转基因家畜。Kaartinen等报道通过携带表达Cre的腺病毒感染 16-细胞期桑椹胚来删除SMGs[15],显然病毒载体的安全性问题也不适合用于以产业化为目的的家畜转基因。目前在家畜上成功删除 SMGs的报道均是在获得转基因动物或转基因动物的胚胎后,再在分离出的转基因家畜成体细胞上进行的。Wang等在转基因牛成纤维细胞中瞬时转染Cre和eGFP共表达载体,以eGFP的表达指示Cre的表达,通过FACS技术筛选出了表达Cre的细胞,其中有80%的细胞内SMGs被删除[16]。Kuroiwa等通过在转基因牛成纤维细胞中转染 Cre瞬时表达质粒获得了无SMGs的免疫球蛋白μ链和PRNP双基因敲除的牛[17]。
但是上述通过转染Cre表达质粒成功删除转基因家畜体内SMGs的研究均指出:Cre表达质粒有较高的掺入率,Wang等报道为 1/3[16],Kuroiwa等报道为 4/5[17],本研究用同样方法证明其掺入率为 1/3。为了优化这一过程,本研究中使用了TAT-Cre蛋白直接转染细胞方法克服了质粒转染的不足。TAT-Cre是在野生型Cre蛋白的N端引入了HIV的蛋白转导结构域 (Protein transduction domains)——TAT序列形成的,它可以直接穿透细胞膜进入细胞内发挥功能,目前TAT-Cre已经得到了许多成功应用[18-19]。利用该方法获得的删除了 SMGs的羊成纤维细胞可用于体细胞克隆获得转基因山羊[6]。
Nolden研究显示血清的存在能够抑制TAT-Cre的细胞穿透活性,并表明TAT-Cre与胚胎干细胞孵育3 h可产生最大的重组效率[20]。本研究尝试了用 100、200、300、400、500 的 TAT-Cre酶对山羊成纤维孵育3 h,发现高于300 μg/mL时,TAT-Cre会对细胞产生毒害作用,最终确定了TAT-Cre的作用浓度为200 μg/mL (结果未给出)。最终结果表明,这一条件可以获得较高的删除效率 (表2)。
表2比较了删除SMGs的不同时机和方法的优缺点。从表中可见,尽管在体细胞克隆前删除SMGs最经济,但连续两次遗传修饰会导致细胞发生严重的老化,无法继续完成体细胞克隆工作。在转基因山羊获得后再进行SMGs删除不存在上述问题,但缺点是试验周期长、耗资大。因TAT-CRE转导方法对细胞损伤小,且不会引入新的外源基因,是一种较佳的SMGs删除手段。
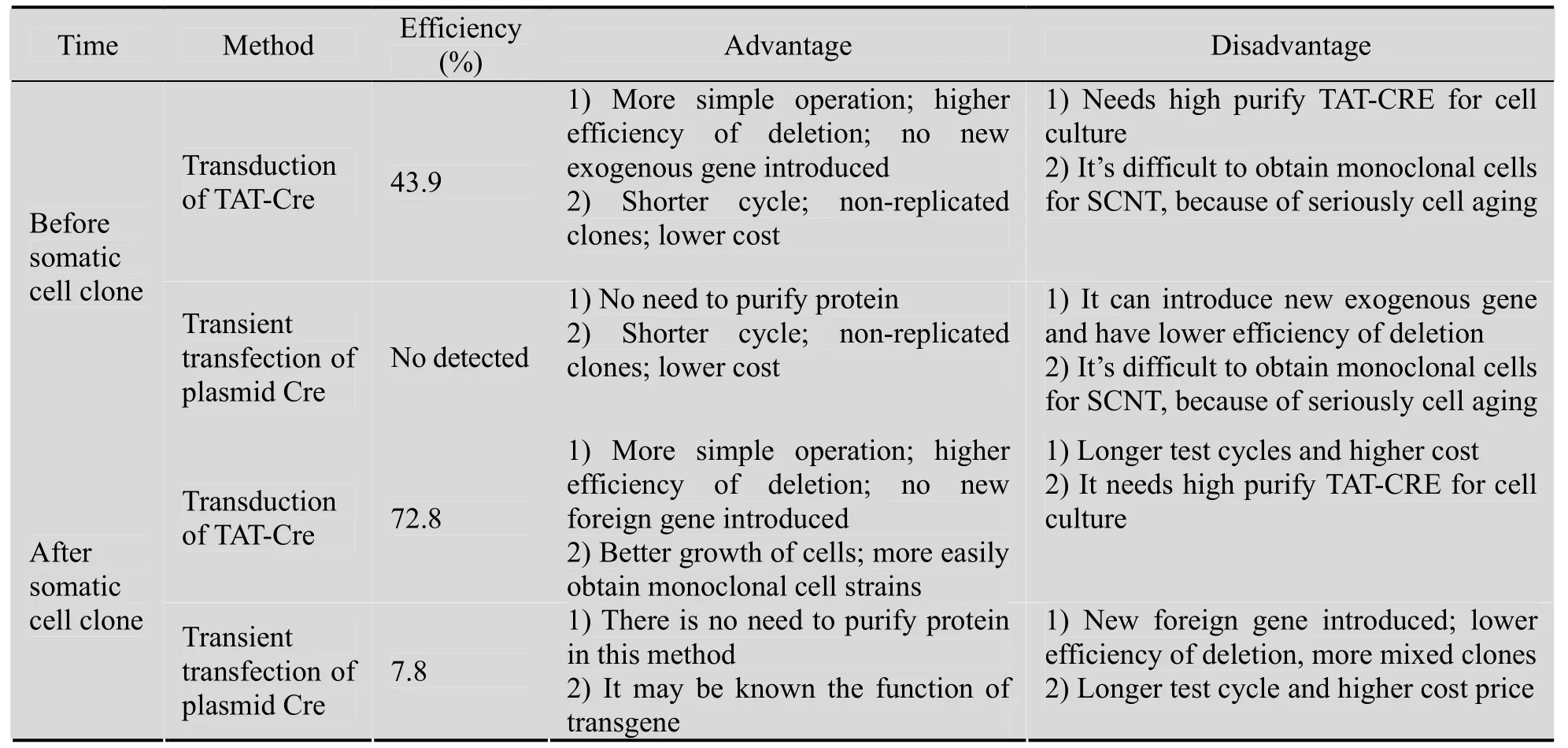
表2 删除标记基因的不同时机和方法比较Table 2 Comparison of deleting marker gene between different times and methods
[1]Lawlor DW. Genetic engineering to improve plant performance under drought: hysiological evaluation of achievements, limitations, and possibilities. J Exp Bot, 2013, 64(1): 83–108.
[2]Kues WA, Niemann H. Advances in farm animal transgenesis. Prev Vet Med, 2011, 102(2): 146–156.
[3]Samiec M, Skrzyszowska M. Transgenic mammalian species, generated by somatic cell cloning, in biomedicine, biopharmaceutical industry and human nutrition/dietetics--recent achievements.Pol J Vet Sci, 2011, 14(2): 317–328.
[4]Lanza AM, Kim DS, Alper HS. Evaluating the influence of selection markers on obtaining selected pools and stable cell lines in human cells.Biotechnol J, 2013, 8(7): 811–821
[5]Lian Q, Wang WW. Research progress and safety evaluation management of transgenic animals in China. Jiangsu Agric Sci, 2012, 40(8): 287–288 (in Chinese).连庆, 王伟威. 我国转基因动物研究进展及安全评价管理. 江苏农业科学, 2012, 40(8): 287–288
[6]Xu Y, Liu S, Yu G, et al. Excision of selectable genes from transgenic goat cells by a protein transducible TAT-Cre recombinase. Gene, 2008,419(1/2): 70–74.
[7]Behboodi E, Memili E, Melican DT, et al. Viable transgenic goats derived from skin cells. Transgenic Res, 2004, 13(3): 215–224.
[8]Baguisi A, Behboodi E, Melican DT, et al.Production of goats by somatic cell nuclear transfer. Nat Biotechnol, 1999, 17(5): 456–461.
[9]Chen JQ,Chen J, Xu XJ, et al. Effect of cytoplast on the development of inter-subspecies nuclear transfer reconstructed goat embryo. Mol Reprod, 2007,74(5): 568–573.
[10]Darbani B, Eimanifar A, Stewart CN Jr, et al.Methods to produce marker-free transgenic plants.Biotechnol J, 2007, 2(1): 83–90.
[11]Abuin A, Bradley A. Recycling selectable markers in mouse embryonic stem cells. Mol Cell Biol, 1996,16(4): 1851–1856.
[12]Seibler J, Schübeler D, Fiering S, et al. DNA cassette exchange in ES cells mediated by Flp recombinase: an efficient strategy for repeated modification of tagged loci by marker-free constructs. Biochemistry, 1998, 37(18): 6229–6234.
[13]Sunaga S, Maki K, Komagata Y, et al. Efficient removal of loxP-flanked DNA sequences in a gene-targeted locus by transient expression of Cre recombinase in fertilized eggs. Mol Reprod Dev,1997, 46(2): 109–113.
[14]Araki K, Araki M, Miyazaki J, et al. Site-specific recombination of a transgene in fertilized eggs by transient expression of Cre recombinase. Proc Natl Acad Sci USA, 1995, 92(1):160–164.
[15]Kaartinen V, Nagy A. Removal of the floxed neo gene from a conditional knockout allele by the adenoviral Cre recombinase in vivo. Genesis, 2001,31(3): 126–129.
[16]Wang S, Sun X, Ding F, et al. Removal of selectable marker gene from fibroblast cells in transgenic cloned cattle by transient expression of Cre recombinase and subsequent effects on recloned embryo development. Theriogenology, 2009, 72(4):535–541.
[17]Kuroiwa Y, Kasinathan P, Matsushita H, et al.Sequential targeting of the genes encoding immunoglobulin-mu and prion protein in cattle. Nat Genet, 2004, 36(7): 775–780.
[18]Grisanti L, Corallini S, Fera S, et al. Inactivation of numb and numblike in spermatogonial stem cells by cell-permeant Cre recombinase. Differentiation,2009, 78(2/3): 131–136.
[19]Peitz M, Jäger R, Patsch C, et al. Enhanced purification of cell-permeant Cre and germline transmission after transduction into mouse embryonic stem cells. Genesis, 2007, 45(8):508–517.
[20]Nolden L, Edenhofer F, Haupt S, et al. Site-specific recombination in human embryonic stem cells induced by cell-permeant Cre recombinase. Nat Methods, 2006, 3(6): 461–467.
