单萜醇类在啤酒发酵过程中的变化及对酒花香气的贡献*
2013-10-30全巧玲江伟王德良孙志伟宋涛
全巧玲,江伟,王德良,孙志伟,宋涛
1(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐,830052)
2(中国食品发酵工业研究院酿酒工程技术研究发展部,北京,100027)
啤酒的香气成分复杂,其中由酒花添加而带给啤酒的独特香气称为啤酒的酒花香气,通常被描述为花香、柑橘香、水果香、松脂味和辛辣味等。至今为止,啤酒酒花香气仍是一个颇具争议的话题,但业界普遍认为酒花中贡献啤酒酒花香气的物质主要是萜类化合物[1-2]。酒花萜类分萜烯类和萜醇类,在啤酒中检测到的α-蒎烯、β-蒎烯、香叶烯、柠檬烯、葎草烯、法尼烯和石竹烯[3-4]等萜烯类物质具有强疏水性,在煮沸过程中因高温蒸发而大量损失,促使其在啤酒中的含量远远低于其感官阈值,因此对啤酒酒花香气强度的贡献可以忽略[1]。而里那醇、香叶醇、β-香茅醇、香叶酸甲酯、乙酸香叶酯等萜醇类化合物及其衍生物在啤酒中的含量为数μg/L 至数十μg/L[5-6],对啤酒酒花香气的贡献明显,尤其是里那醇数年来一直被认为是评价啤酒酒花香气的“标志性化合物”[7-9],含量达到16 μg/L 就能很容易辨识[7]。近年来,专家们认识到啤酒的酒花香气十分复杂与来自酒花精油中风味活性物质的生酒花味道截然不同[10],没有哪种单一物质可以代替[11-12],尤其是这些萜类物质在发酵过程中通过生物化学变化生成的其他物质能极大地影响啤酒的香气类型和强度[10]:King 等人发现,香叶醇主要转化为β-香茅醇,其次是里那醇;里那醇主要转化为α-萜品醇,且α-萜品醇的转化仍会进一步进行[3]。这些单萜醇的生物转化并非自发形成,其中酵母菌起着重要的作用,酵母不同其转化途径和生成的物质也不尽相同[3,13]。此外,在不同的浓度下这些萜烯醇物质的其存在形式和作用也不同[14-15],其中里那醇、香叶醇和β-香茅醇共存时其协同作用能使啤酒酒花香气更加突出[1,6,16-19]。
为进一步探索里那醇、香叶醇和β-香茅醇在啤酒中的作用,本文研究了3 者在不同浓度下的单一作用和协同作用对啤酒香气质量的影响及它们在发酵过程中的变化规律,为进一步探索优化酒花香气的合理利用提供参考。
1 材料与方法
1.1 主要原料
麦芽:澳麦(中国食品发酵工业研究院);酵母:某啤酒厂家生产用菌种。
1.2 发酵工艺
采用某啤酒厂家下面发酵大生产工艺。
1.3 仪器与试剂
1.3.1 主要仪器
气相色谱Clarus 600,Perkin Elmer 公司;质谱仪Clarus 600T,Perkin Elmer 公司;低温恒温水浴锅XT5706-5203-BF28-R15C-D31,杭州雪中炭恒温技术有限公司;磁力搅拌器PC-420D,Corning 公司。
1.3.2 主要试剂
里那醇;香叶醇;α-萜品醇;β-香茅醇;橙花叔醇;乙酸香叶酯;乙酸香茅酯;香叶酸甲酯;内标试剂:2-壬醇(所有试剂均购自Acros 公司和Sigma-Aldrich 公司,纯度≥95%)。
1.4 主要分析方法
1.4.1 顶空固相微萃取结合GC/MS 的检测方法
气相色谱条件
色谱柱:Elite Wax ETR(30 m ×0.25 mm ×0.5 μm)。载气:氦气(纯度≥99.999%),流速:1 mL/min,进样口温度:240℃,-0.5 min 前不分流进样,1 min 后开阀,分流比10 ∶1。柱温:起始温度40℃,8℃/min 升至120℃,6℃/min 升至210℃,保持5 min。进样方式:固相微萃取,萃取头类型:85 μmPA,解析5 min。
质谱条件
离子源温度:230℃;传输线温度:230℃;电子轰击源:70eV,扫描范围:29 ~300amu。定性采用全扫描模式(SCAN),定量采用选择离子扫描模式(SIM)。扫描图谱如图1 所示。
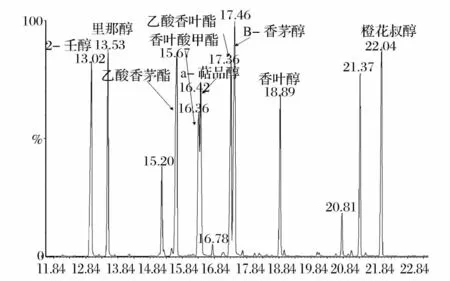
图1 酒花香气物质的气相色谱/质谱全离子连续扫描图谱Fig.1 The continuous scanion current profile of hop aroma components by GC/MS
前处理:称取3 g NaCl 于20 mL 顶空瓶中,加入除气啤酒5 mL 和内标(2-壬醇)溶液(样品中浓度为20 μg/L),放入磁力搅拌转,加盖密封垫和铝盖密封。将SPME 针管穿透样品瓶隔垫,伸入瓶中,推手柄使纤维头伸出针管,纤维头置于距离样品表面约20 mm 的上部空间,在45℃水浴温度下,以550 r/min搅拌45 min,取出手柄,直接进样,解析5 min。
1.4.2 感官品评
品评小组由8 位评委组成。
1.5 实验方法
1.5.1 里那醇、香叶醇和β-香茅醇对啤酒香气的影响
称取适量里那醇、香叶醇和β-香茅醇标准品,用无水乙醇溶解制备成一定浓度的单一母液,逐级稀释后在体积分数为4% 的乙醇溶液中分别配制成50 μg/L、25 μg/L 和12.5 μg/L 三种浓度的里那醇、香叶醇和β-香茅醇溶液。设计实验并结合感官品评,研究4%乙醇溶液中不同浓度里那醇、香叶醇和β-香茅醇对啤酒香气质量的影响。
1.5.1.1 不同浓度的里那醇、香叶醇和β-香茅醇单一物质对啤酒香气特性的影响
在4%乙醇溶液中,分别对里那醇、香叶醇和β-香茅醇单一物质的50 μg/L、25 μg/L 和12.5 μg/L三个浓度进行感官品评,针对花香、水果香、玫瑰香、柑橘味、松脂味和整体香气强度进行打分,对比分析研究其在不同浓度下的香气特性。
1.5.1.2 不同浓度的里那醇、香叶醇和β-香茅醇协同作用对啤酒香气强度的影响
为研究里那醇、香叶醇和β-香茅醇的协同作用对啤酒香气质量的影响,采用L9(33)正交试验,实验设计见表1。
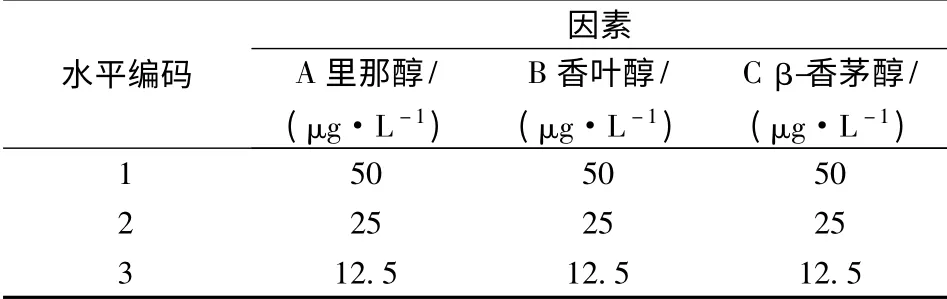
表1 实验设计因素水平编码表Table 1 Code table of test factors and levels
1.5.2 里那醇、香叶醇和β-香茅醇在发酵过程中的变化规律
在富含酒花香气啤酒的实验研究中作者曾对回旋槽添加酒花与发酵罐添加酒花两种工艺进行对比[20],发现发酵罐添加酒花的方式远比回旋槽添加酒花的方式更有利于啤酒酒花香气的提高。因此,本文主要研究里那醇、香叶醇和β-香茅醇在发酵过程中的变化规律。
实验方案:分别配制里那醇、香叶醇和β-香茅醇单一母液1 000 mg/L。取未添加酒花的熟麦汁4L 平均分装成4 组,分别取3 个母液1mL 至3 组麦汁中(即每种单萜类物质最终浓度为1 000 μg/L),以添加1 mL 无水乙醇的实验组为对照进行实验,其他酿造工艺和条件按正常工艺进行。跟踪分析发酵液中各物质含量变化情况。
2 结果与分析
2.1 里那醇、香叶醇和β-香茅醇对啤酒香气的影响
2.1.1 不同浓度里那醇、香叶醇和β-香茅醇单一物质对啤酒香气特性的影响
分别对50 μg/L、25 μg/L 和12.5 μg/L 的里那醇、香叶醇和β-香茅醇溶液进行品评,针对花香、水果香、玫瑰香、柑橘味、松脂香和整体香气强度进行打分,结果发现:(1)里那醇浓度为12.5 μg/L 时表现为极淡的玫瑰香味;浓度为25 μg/L 时呈现出明显的柑橘味,其中夹杂着淡淡的花香和微弱的松脂香,香气明显而典型;达到50 μg/L 时则以松脂香为主柑橘味为辅,且香气较为浓郁。由此可见,随着里那醇浓度的变化,其在4%乙醇溶液中呈现出来的香气特性也随之不同,如图2 所示。普通啤酒中里那醇浓度低于12.5 μg/L,在复杂的啤酒风味中消费者们无法感受到明显的酒花香气。当里那醇浓度达到25 μg/L时,明显的柑橘味在众多的啤酒风味中较为典型,这也是消费者能轻易辨识的原因之一。里那醇浓度达到50 μg/L 后,典型的柑橘味减弱较为优雅的松脂香占主导,这也许是一些啤酒中虽然里那醇浓度很高,香气也很浓郁,但并非呈现出强烈柑橘味的一个重要原因。(2)香叶醇浓度为12.5 μg/L 时以淡淡的柑橘味为主水果香为辅,且香气轻柔;在25 μg/L 时以水果香为主柑橘味和花香为辅,丝丝香甜;在50 μg/L 时则以花香为主,柑橘味和松脂香为辅,香气清新淡雅;由此可见,香叶醇的香气特性也会随着浓度的变化而改变:随着浓度的增加柑橘味减弱,水果香增强,此后水果味减弱转而由花香占主导,如图3 所示。(3)β-香叶醇浓度为12.5 μg/L 时表现为轻柔的玫瑰香和柑橘味,香气微弱;在25 μg/L 时显示出清新的松脂味和淡淡的玫瑰香,香气清新淡雅;在50 μg/L 时则以玫瑰香为主松脂香为辅,香气虽清新淡雅却极易辨识。由此可见,在4%乙醇溶液中β-香叶醇的香气特性亦会随着浓度的改变而变化,但主要表现为玫瑰香和松脂香,香气典型而优雅,如图4 所示。可见,3 种香气物质在不同浓度下均会呈现出不同的香气特性。
2.1.2 不同浓度里那醇、香叶醇和β-香茅醇协同作用对啤酒香气强度的影响
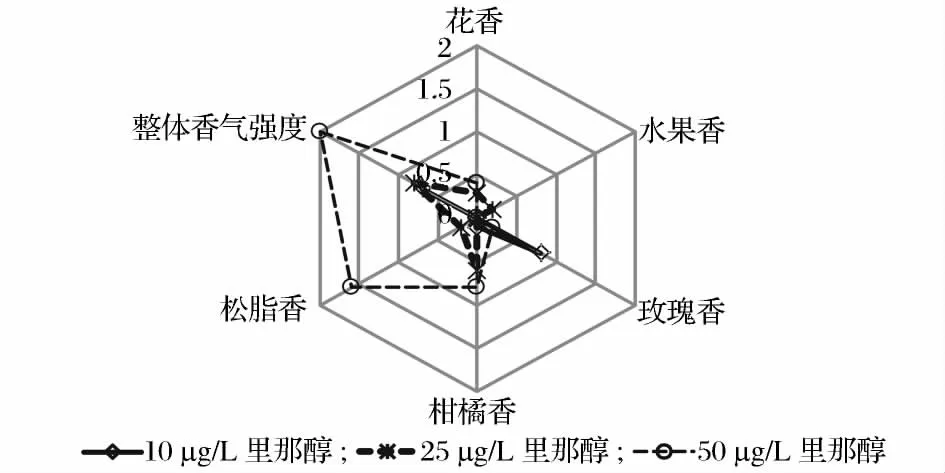
图2 4%乙醇溶液中不同浓度里那醇的香气特性Fig.2 Aroma characteristics of differentconcentrations of linalool in 4% (v/v)ethanol solution

图3 4%乙醇溶液中不同浓度香叶醇的香气特性Fig.3 Aromacharacteristics of differentconcentrations of geraniol in 4% (v/v)ethanol solution
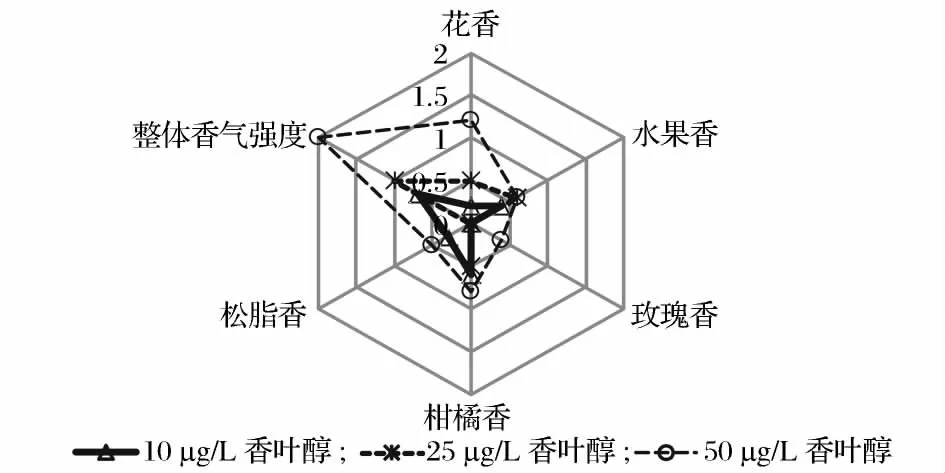
图4 4%(v/v)乙醇溶液中不同浓度β-香茅醇的香气特性Fig.4 Aroma characteristics of differentconcentrations of β-citronellol in 4% (v/v)ethanol solution
对里那醇、香叶醇和β-香茅醇3 个因素及50 μg/L、25 μg/L 和12.5 μg/L 三个水平进行正交试验设计并针对整体香气强度进行打分,如表2。经分析发现:因素A 的极差为0.63 最大,说明因素A 对实验指标啤酒香气强度的影响程度最大,因素C 次之,因素B 最弱。因素A 的3 个水平中第3 水平,即12.5 μg/L 对啤酒香气强度贡献最大,因素B 的3 个水平中第3 水平,即12.5 μg/L 对啤酒香气强度贡献最大,因素C 的三个水平中第二水平,即25 μg/L 对啤酒香气强度贡献最大,因此最优方案为A3B3C2,即:里那醇浓度为12.5μg/L,香叶醇浓度为12.5 μg/L,β-香茅醇浓度为25 μg/L 时能使啤酒获得最大的香气强度。该实验说明:在浓度为50 μg/L 以下,单一物质浓度越高的组合并不一定能够使啤酒获得越大的香气强度。
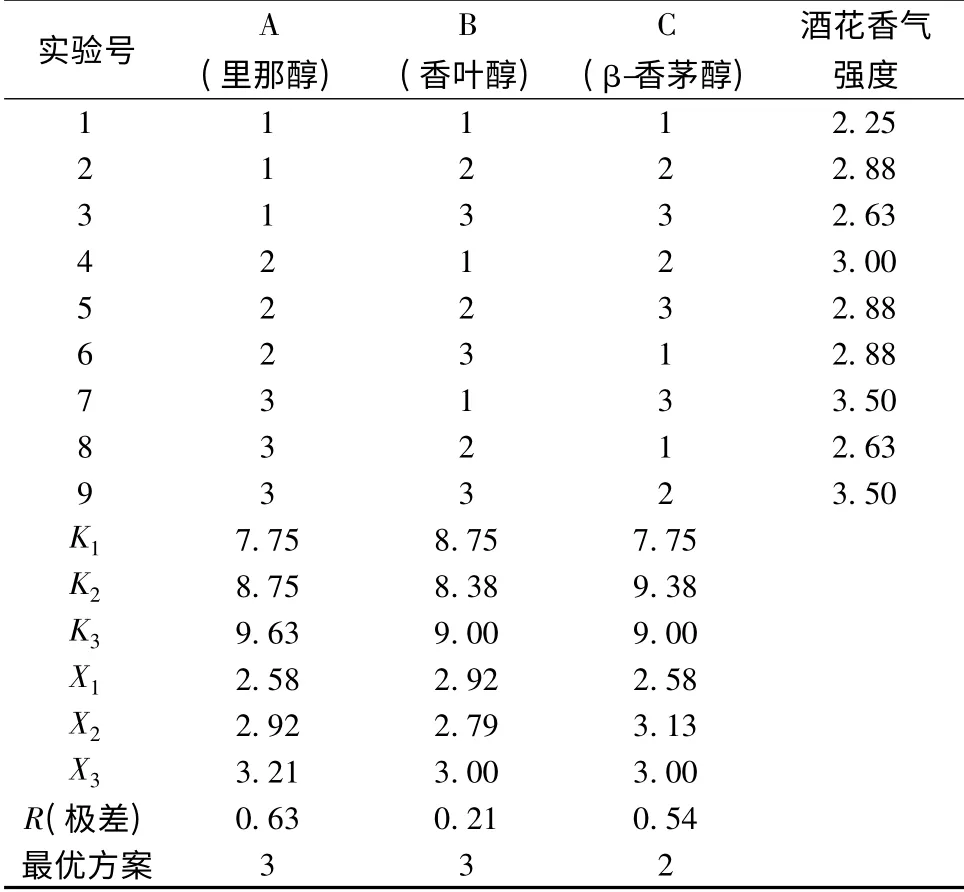
表2 不同浓度里那醇、香叶醇和β-香茅醇混合作用正交试验设计及结果Table 2 Orthogonal experimental design with different concentrations of linalool,geraniol and β-citronellol and results
2.2 里那醇、香叶醇和β-香茅醇在发酵过程中的变化
跟踪检测里那醇、香叶醇和β-香茅醇在发酵中的含量变化发现,里那醇进入发酵过程后含量先减少后有所增加,但总体仍为降低趋势,损失率为36.6%。随着发酵的进行,游离的里那醇很快被酵母利用而减少,使得α-萜品醇的含量持续增加。此外产生少量香叶醇,且整个发酵过程中其含量基本保持恒定。里那醇含量在第3 天达到最小值,此后随着酵母对糖苷键的利用释放出部分与糖苷键相连的里那醇而使其含量有所回升,如图5 所示;香叶醇在发酵过程中含量先减少后缓慢回升,总体为降低趋势,损失率为45.1%。经过酵母的生物转化作用β-香茅醇的含量大量增加,其中发酵前5 天β-香茅醇的积累较为缓慢,与此同时产生了少量的乙酸香叶酯,此后β-香茅醇不断持续增加且在第17 天时达到640.11 μg/L,而产生的少量乙酸香叶酯逐渐转化为少量的乙酸香茅酯,此外还有微量里那醇产生,如图6 所示;β-香茅醇在发酵过程中含量先降低后快速回升,但总体仍在降低,损失率为8.1%。随着发酵的进行酵母利用β-香茅醇主要使得乙酸香茅酯的含量有所增加,在第五天达到最高值20.24 μg/L,此后逐渐消失。其次产生微量香叶醇,且其含量在整个发酵过程中基本保持恒定,如图7 所示。通过该实验发现:发酵结束后3 种物质的自身含量均先降低后又回升,也许均因酵母水解糖苷键释放出部分单体物质,也许是酵母自溶释放出其体内的单体物质,也或许是两者均有,目前尚未得知。
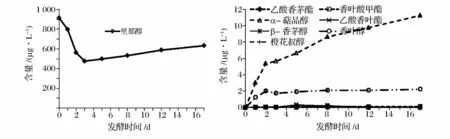
图5 1 000 μg/L 里那醇发酵过程的物质及其含量变化情况Fig.5 The changes of 1 000 μg/L linalool during fermentation
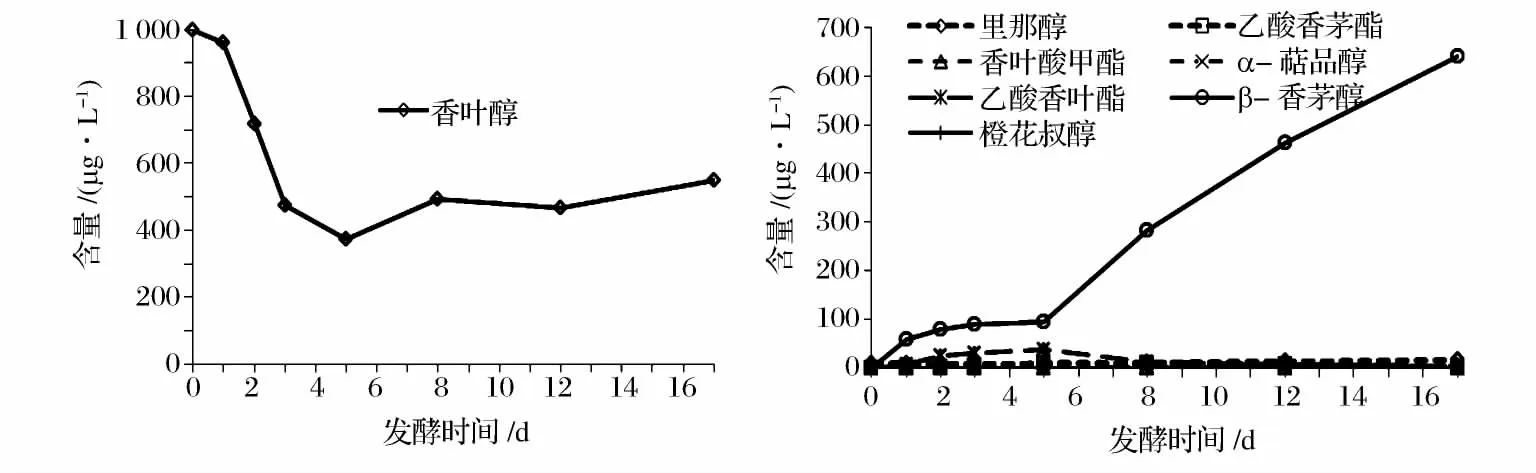
图6 1 000 μg/L 香叶醇发酵过程的物质及其含量变化情况Fig.6 The changes of 1 000 μg/L geraniol during fermentation

图7 1 000 μg/L β-香茅醇发酵过程的物质及其含量变化情况Fig.7 The changes of 1 000 μg/L β-citronellol during fermentation
结合上述两方面研究,发现在发酵罐添加酒花时,对已知里那醇、香叶醇含量的酒花,结合发酵过程中的损失率,计算并控制好其用量促使啤酒中里那醇、香叶醇和β-香茅醇的最终含量为12.5 μg/L,12.5 μg/L 和25 μg/L 时,便可达到最合理利用酒花香气资源的目的。
3 结论
在体积分数为4%的乙醇溶液中,里那醇、香叶醇和β-香茅醇在不同浓度下呈现出来的香气特性不同:里那醇浓度为12.5 μg/L 时表现为淡淡的玫瑰香味,25 μg/L 时呈现出明显的柑橘味,其中夹杂着淡淡的花香和微弱的松脂香,50 μg/L 时则以松脂香为主柑橘味为辅;香叶醇浓度为12.5 μg/L 时表现为淡淡的柑橘味,25 μg/L 时以水果香为主柑橘味和花香为辅且丝丝香甜,50 μg/L 时则以花香为主,柑橘味和松脂香为辅,香气清新淡雅;β-香茅醇浓度为12.5 μg/L 时表现为轻柔的玫瑰香和柑橘味,25 μg/L 时显示出清新的松脂味和淡淡的玫瑰香,50 μg/L 时则以玫瑰香为主松脂香为辅。将里那醇、香叶醇和β-香茅醇不同浓度混合后发现,里那醇对啤酒香气强度的影响程度最大,β-香茅醇次之,香叶醇最弱。且当里那醇、香叶醇和β-香茅醇浓度分别为12.5 μg/L,12.5 μg/L 和25 μg/L 时的协同作用能使啤酒获得最大的香气强度。该实验证明在50 μg/L 以下,单一物质浓度越高的组合并不一定促使啤酒获得越大的香气强度。
将3 种物质添加到麦汁中进行发酵,跟踪发酵过程中每种物质的含量变化及新物质生成情况。里那醇、香叶醇和β-香茅醇在发酵初期呈显著下降,此后略微上升,总体上其损失率分别为36.6%、45.1%和38.1%。发酵过程中3 种物质均会发生复杂的生物化学变化:里那醇主要转化为α-萜品醇,其次是香叶醇;香叶醇主要产生β-香茅醇,且在第5 天后持续快速增加,其次是乙酸香叶酯;而β-香茅醇则主要转化成乙酸香茅酯。另外,发酵结束后3 种物质的自身含量均先降低后又回升,也许均因酵母水解糖苷键释放出部分单体物质,也许是酵母自溶释放出其体内的单体物质,也或许是两者均有,目前尚未得知。
在发酵罐中添加酒花是提高啤酒酒花香气的有效措施[20],在此基础上结合里那醇、香叶醇和β-香茅醇3 种物质在发酵过程中的变化规律,将其在啤酒中的最终含量分别控制在12.5 μg/L、12.5 μg/L 和25 μg/L 既可使用最少量的啤酒花生产出酒花香气最丰富的啤酒,达到合理利用酒花香气资源的目的。此处对里那醇,香叶醇和β-香茅醇发酵过程中变化规律的研究仅为初步探索,今后还需在反应条件,反应机理等方面进行更仔细更深入的研究。
[1] Kishimoto T,Wanikawa A,Kagami N,et al. Analysis of hop derived terpenoids in beer and evaluation of their behavior using the stir bar-Sorptive extraction method with GC-MS[J]. Journal of Agricultural and Food Chemistry,2005,53 (12):4 701 - 4 707.
[2] Irwin A. Varietal dependence of hop flavour volatiles in lager[J]. Journal of the Institute of Brewing,1989,95(3):185 -194.
[3] King A,Dickinson J. Biotransformation of hop aroma terpenoids by ale and lager yeasts [J]. FEMS Yeast Research,2003(3):53 -62.
[4] Cocito. C,Gaetano. G,Delfini. C. Rapid extraction of aroma compounds in must and wine by means of ultrasound[J]. Food Chemistry,1995,52(3):311 -320.
[5] Tressl R,Friese L,Fendesk F. Gas chromatographic-mass spectrometric investigation of hop aroma constituents in beer [J]. Journal of Agricultural and Food Chemistry,1978,26(6):1 422 -1 426.
[6] Murakami A,Chicoye E,Goldstein H. Hop flavor constituents in beer by headspace analysis[J]. Journal of the American Society of brewing Chemists,1987,45(1):19 -23.
[7] Sakuma S,Hayashi S,Kobayashi K. Analytical methods for beer flavor control [J]. American Society of Brewing Chemists,1991,49(1):1 -3.
[8] Miedaner H,International B. Gas chromatographic investigations on beer[J]. Brauwelt International,1985 (2):206 -208.
[9] Fritch H,Brauerei B,Kaltner D,et al. Unlocking the secret behind hop aroma in beer[J]. Brauwelt Intemational,2005,23(1):22 -23.
[10] Praet T,Opstaele F V,Jaskula-Goiris B,et al. Biotransformations of hop-derived aroma compounds bySaccharomyces cerevisiaeupon fermentation [J]. Elsevier B V,2012,36(4):125 -132.
[11] 王志坚. 酒花组成对啤酒质量的影响[J]. 酿酒科技,2005(3):41 -42.
[12] Park S,Noble A. Monoterpene and monoterpene glycosides in wine aromas[J]. Beer and Wine Production,1993,536:98 -109.
[13] King A,Dickinson J. Biotransformation of monoterpene alcohols bySaccharomyces cerevisiae,TorulasporadelbrueckiiandKluyveromyceslactis[J]. Yeast,2000(16):499 -506.
[14] Nickerson G. Hop aroma component profile and the aroma unit[J]. American Society of Brewing Chemists,1992,50(3):77 -81.
[15] Murakami A,Goldstein H,Navarro A. Investigation of beer flavor by gas chromatography-olfactometry [J]. American Society of Brewing Chemists,2003,61(1):23-32.
[16] 王憬,崔巍伟,王莉娜,等. 啤酒中酒花香组分分析方法的研究及其在啤酒酒花香气质量评定中的应用[J]. 啤酒科技,2007(12):29 -34.
[17] Kishimoto T,Wanikawa A,Kono K,et al. Comparison of the odor-active compounds in unhopped beer and beers hopped with different hop varieties[J]. Journal of Agricultural and Food Chemistry,2006,54(23):8 855 -8 861.
[18] TakoiK,Koie K,Itoga Y,et al. Biotransformation of hopderived monoterpene alcohols by lager yeast and their contribution to the flavor of hopped beer[J]. Journal of Agricultural and Food Chemistry,2010,58(8):5 050 -5 058.
[19] TakoiK,Itoga Y,Koie K,et al. The Contribution of geraniol metabolism to the citrus flavour of beer:synergy of geraniol and β-citronellol under coexistence with Excess Linalool[J]. The Institute of Brewing,2010,116(3):251 -260.
[20] 全巧玲,江伟,王德良,等. 酒花香气成分的检测及富含典型酒花香气啤酒的试验研究[J]. 啤酒科技,2013(2):28 -36.
