Sulfolobus tokodaii strain 7 高温酸性α-淀粉酶基因在大肠杆菌中克隆表达及其酶学性质*
2013-10-30魏涛孙浩申玉龙毛多斌
魏涛,孙浩,申玉龙,毛多斌
1(郑州轻工业学院 食品与生物工程学院,河南 郑州,450002)
2(山东大学微生物技术国家重点实验室,山东 济南,250100)
高温酸性α-淀粉酶是淀粉制糖工业中重要的酶制剂,有着非常广泛的应用前景。发展淀粉制糖工业也是解决当前淀粉生产积压的重要途径。淀粉水解包括液化和糖化2 个步骤,高温α-淀粉酶在液化过程中起关键作用,现在常用的高温α-淀粉酶其最适pH 范围为6 ~7,并且在酸性糖化条件下酶活力会明显降低,不能满足在酸性条件下淀粉原料液化的要求,因此开发一种高温酸性α-淀粉酶具有重要意义[1-4]。
极端超嗜热古菌Sulfolobus tokodaiistrain 7 于1983 年在日本九州岛的别府热泉中发现,是一种好养性异养微生物,能利用淀粉等多种多糖营养物,最适生长条件为80 ℃,pH 2.5 ~3,分类上属泉古菌[5]。基因组测序结果和序列分析表明,在S.tokodaiistrain 7 基因组中存在多个淀粉酶基因[6]。本文将S.tokodaiistrain 7 中α-淀粉酶基因ST0817 在大肠杆菌中克隆表达,并详细研究了酶学性质,为对该酶进行定向进化以及高温酸性α-淀粉酶工业化应用奠定基础。
1 材料与方法
1.1 菌株与质粒
嗜热古菌S.tokodaiistrain 7 购自JCM (Japan Collection of Microorganisms);大肠杆菌Escherichia coliDH5a 与E.coliBL21-CodonPlus (DE3)-RIL 为本实验室保存。克隆与表达质粒pET15b 购自Novagen公司。
1.2 工具酶与试剂
限制性内切酶、DNA 连接试剂盒、ProbestTMDNA聚合酶,TaKaRa 公司产品;PCR 引物,由上海生工公司合成;质粒提取和琼脂糖凝胶回收试剂盒,购自北京天根生物科技有限公司;直连淀粉、可溶性淀粉、支链淀粉、β-极限糊精、糖原、环糊精和普鲁兰糖,购自Sigma 公司。
1.3 高温酸性α-淀粉酶基因克隆
根据S.tokodaiistrain 7 高温酸性α-淀粉酶基因(ST0817)设计引物:上游:下游:5'- GCCCTCA TTT CAG CCA CTC TTTT AAAT ATTTTTC -3',划线部分分别为上游引物的NdeⅠ酶切位点与下游引物的SalⅠ酶切位点。100 μL PCR反应体系:模板0.5 μL(25 ng),dNTP (25 mmol/l)0.5 μL,引物(100 μmol/L)各0.5 μL,10 ×缓冲液10 μL,ProbestTMDNA 聚合酶(5 U/μL)0.5 μL,超纯水87.5 μL。PCR 反应条件:94℃5 min;94℃30s,55℃30s,72℃1 min,30 个循环。PCR 产物回收经NdeⅠ和SalⅠ酶切后连接到经同样酶切的pET15b 上,连接产物转化大肠杆菌E.coliDH5α,筛选重组质粒,经双酶切NdeⅠ和SalⅠ及上海生工测序验证后将其命名为pET15b-ST0817。
1.4 蛋白的表达与纯化
将测序正确的重组质粒pET15b-ST0817 转入大肠杆菌E.coliBL21-CodonPlus (DE3)-RIL 中。带有重组质粒的表达菌在20 mL 含100 mg/L 氨苄青霉素和34 mg/L 氯霉素的LB 液体培养基中过夜培养,然后按1∶100 的体积比接到1 000 mL LB 液体培养基中继续培养至OD600nm为0.5,加入终浓度0.2 mmol/L IPTG 于37℃继续培养4h,4℃8 000 r/min 离心10 min。收集菌体悬浮破壁buffer(50 mmol/L Tris-HCl,pH 8.0,50 mmol/L NaCl)中,超声波破碎菌体(功率300W,超声时间5s,间隔时间5s,超声次数150 次)。破壁后的菌液于75℃热处理30 min,用10 000 g 离心10 min,去除不耐热的蛋白沉淀,得到粗酶液。将粗酶过Ni-NTA 琼脂糖亲和层析得到纯化的酶蛋白。将过镍柱后的蛋白在50 mmol/L Tris/HCl (pH 8.0)缓冲液中透析,然后继续过Superdex-200 (16/60)分子筛柱。利用50 mmol/L Tris/HCl,50 mmol/L NaCl(pH 8)的缓冲液进行洗脱,洗脱速度为0.5 mL/min,收集体积为0.5 mL。将纯化后的酶蛋白液用离心过滤器(10 kDa,Millipore)进行浓缩,然后加入等体积的50%(V/V)的甘油,于-20℃保存。蛋白质浓度用考马斯亮蓝比色Bradford 方法测定[7]。
1.5 高温α-淀粉酶的活性检测
高温α-淀粉酶活性测定参照文献[8]。酶活定义:1 g 固体酶粉(或1mL 液体酶),于70℃、pH 6.0条件下,1 h 液化1 g 可溶性淀粉,即为1 个酶活力单位。
1.6 高温α-淀粉酶反应最适温度和最适pH
酶最适反应温度:在50 ~80 ℃,每隔5℃测定1次酶活力,最大的活性定义为100%。
酶最适反应pH:分别使用柠檬酸钠缓冲液、乙酸钠缓冲液、磷酸缓冲液和Tris-HCl 缓冲液体系配制pH 3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0 的系列缓冲液,以最适反应pH 下所得酶活力定义为100%。
1.7 高温α-淀粉酶的热稳定性、pH 稳定性及耐酸性
酶的热稳定性:将适量的酶加入到500 μL 50 mmol/L Tris-HCl (pH 5.8)缓冲液中,分别在75、85、95℃处理2、4、6 和8 h 后取出样品,用标准测定方法测定残余的酶活力。未处理前的酶活力定义为100%。
酶的pH 稳定性:将适量的酶加入各种缓冲液中:在pH 3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0 中分别处理60 min,然后再分别在对应的pH 检测酶活,以处理前的酶活性为100%。
酶的耐酸性:将适量的酶加入50 mmol/L 乙酸钠缓冲液,pH 5.5、5.2 和5.0 处理30、60、90 和120 min后取出样品,用标准测定方法测定残余的酶活力。未处理前的酶活力定义为100%。
1.8 高温α-淀粉酶底物特异性
对以下底物进行底物特异性检测[9]:直链淀粉、可溶性淀粉、支链淀粉、β-极限糊精、糖原、环糊精和普鲁兰糖(浓度均为1 mg/mL)。
1.9 高温α-淀粉酶对变性剂抗性的研究
为研究各种变性剂对酶活性的影响,适量酶蛋白在于各种试剂中于室温下处理30 min,然后用标准酶活检测方法测定残余的酶活力。各种添加剂或变性剂为:重金属盐离子Mg2+,Mn2+,Co2+,Ca2+,Ni2+,Cu2+,Zn2+,Fe2+(分别为5 mmol/L);金属螯合剂EDTA(5 mmol/L);还原剂DTT(5 mmol/L);变性剂SDS(5%,W/V)、尿 素(4,8 mol/L)、Tween20、Tween80 和Trtion-X100(1%,5%,W/V);有机溶剂(50%,90%,W/V):乙醇、甲醇、丙酮、异丙醇、甲苯、氯仿和DMSO;丝氨酸变性剂PMSF(5 mmol/L)。
2 结果与分析
2.1 高温α-淀粉酶基因的扩增和表达质粒pET15b-ST0817 的构建
以S.tokodaiistrain 7 全基因组DNA 序列为模板,PCR 扩增得到与预期大小相符的目的片段(1 332bp)。构建的重组质粒pET15b-ST0817 经双酶切分析和DNA 测序验证。结果表明,克隆的高温酸性α-淀粉酶基因ST0817 与预期产物一致,表明重组质粒构建正确。
2.2 重组蛋白的表达与纯化
将重组质粒pET15b-ST0817 转化大肠杆菌E.coliBL21-CodonPlus (DE3)-RIL 中,经0.2 mmol/L IPTG 诱导表达目的蛋白,经超声破壁、70℃热处理、镍柱亲核层析和分子筛纯化,得到纯化高温α-淀粉酶,分子质量是53.0 kDa,如图1 所示。

图1 α-淀粉酶的SDS-PAGE 分析Fig.1 SDS-PAGE of the recombinant α-amylase
2.3 最适反应温度及热稳定性
酶最适反应温度为75℃,表明该酶为耐高温α-淀粉酶(如图2)。热稳定性实验表明,在85℃处理8 h,仍然保持50%左右的酶活力;75℃处理8 h,酶活力稳定在90%以上(如图3)。

图2 最适反应温度Fig.2 Optimal temperature of the recombinant α-amylase

图3 热稳定性Fig.3 Thermostability of the recombinant α-amylase
2.4 最适pH、pH 稳定性及耐酸性
该酶最适pH 为5.5,pH 4.5 ~7.5 处理60 min酶活力能保持最大活力的50%以上(如图4 所示)。在pH 5.2 处理120 min,仍然保持50%左右的酶活力(如图5 所示)。该酶的最适pH、pH 稳定性及耐酸性相关实验结果表明该酶是酸性α-淀粉酶。

图4 最适反应pH 和pH 稳定性Fig.4 Optimal pH and pH stability of the recombinant α-amylase

图5 耐酸性Fig.5 The acid tolerance of the recombinant α-amylase
2.5 α-淀粉酶底物特异性
α-淀粉酶对各种底物的催化活性如表1 所示。可以看出,该酶专一性水解直链淀粉和可溶性淀粉中的α-1,4 糖苷键,对这2 种底物的水解活性最高,对支链淀粉和β-极限糊精活性次之,糖原、环糊精和普鲁兰糖水解活性较小。

表1 重组α-淀粉酶的底物特异性Table 1 The substrate specificity of the recombinant α-amylase
2.6 金属离子和抑制剂对α-淀粉酶的作用
如表2 所示,重金属离子Mg2+,Mn2+,Co2+,Ca2+,Ni2+(为5 mmol/L)对该α-淀粉酶活性没有影响,金属螯合剂EDTA 对活力也没有影响,说明该α-淀粉酶不是金属离子依赖性酶。然而,Cu2+,Zn2+,Fe2+明显的抑制酶的活力,分别使酶活下降了55%、45%,32%左右。在5 mmol/L 还原剂DTT 作用下,该酶保持98%活性;丝氨酸变性剂PMSF(50 mmol/L)能使酶活力完全丧失(为起始酶活的1%),说明丝氨酸残基在酶的催化过程中起重要作用。

表2 金属离子和抑制剂对重组α-淀粉酶的作用Table 2 Effect of various metals and inhibitors on the activity of the recombinant α-amylase
2.7 有机溶剂和变性剂对α-淀粉酶的作用
有机溶剂和变性剂对α-淀粉酶的作用情况见表3。
该酶在有机溶剂(50%,90%,W/V)乙醇、甲醇、丙酮、异丙醇、甲苯、氯仿和DMSO 中保持起始酶活的80%以上,表明该酶具有较好的有机溶剂抗性;变性剂Tween20、Tween80 和Trtion-X100(5%,W/V)对酶活具有明显的抑制作用,分别使酶活下降了20%、45%,48%左右;酶在变性剂SDS(5%,W/V)、尿素(4、8 mol/L)中活性稳定(保持起始酶活的88%以上)。

表3 有机溶剂和变性剂对重组α-淀粉酶的作用Table 3 Effect of organic solvents and detergents on the activity of the recombinant α-amylase
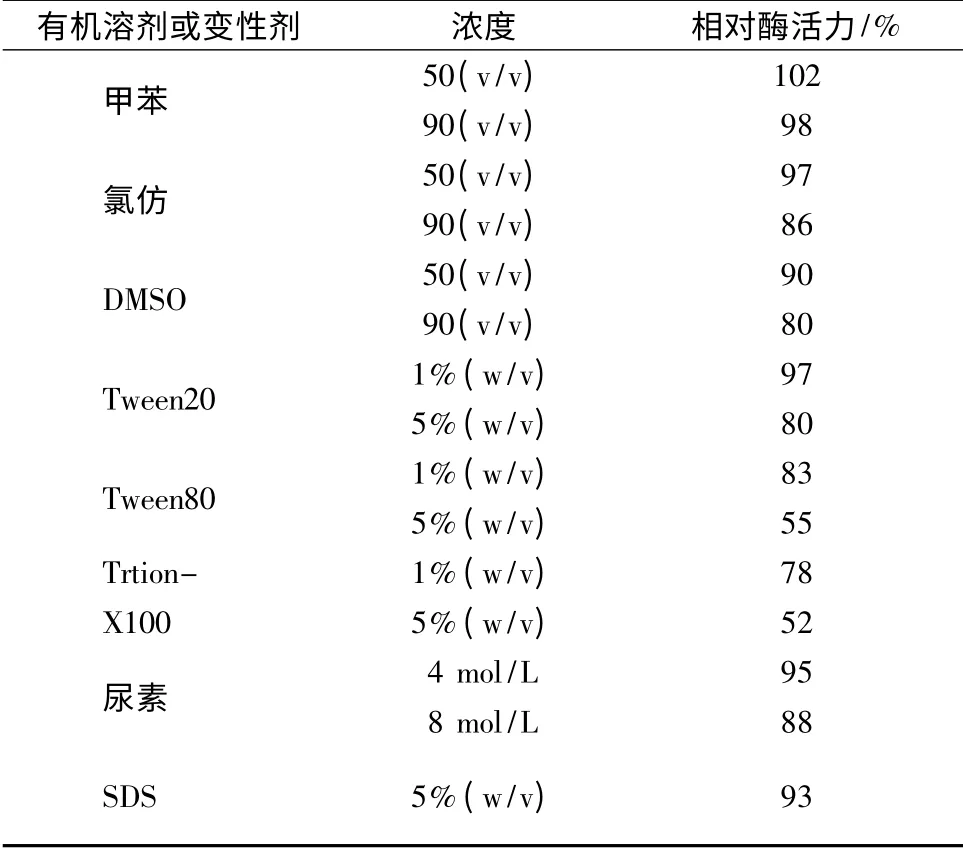
续表3
3 结论
本文将来自超嗜热古菌S.tokodaiistrain 7 预测的α-淀粉酶(ST0817)基因在大肠杆菌中克隆表达,IPTG 诱导表达,经超声波破壁,热处理,Ni-NTA 柱亲和层析和分子筛层析纯化后,得到纯化的α-淀粉酶。酶学性质研究表明,该酶的最适温度与最适pH 分别为75℃与pH 5.5,表明该酶是高温酸性α-淀粉酶。同时该酶具有明显的热稳定性,在85℃时的半衰期为8h。该酶对不同底物水解活性不同,直链淀粉>可溶性淀粉>支链淀粉>β-极限糊精>糖原>环糊精>普鲁兰糖。该酶对有机溶剂(乙醇、甲醇、丙酮、异丙醇、甲苯、氯仿和DMSO)、变性剂(SDS)、尿素和重金属离子(Mg2+、Mn2+、Co2+、Ca2+和Ni2+)等具有抵抗作用。金属离子Ca2+和EDTA 对该酶的活性没有影响,表明α-淀粉酶活性不依赖金属离子,在液化和淀粉糖工艺中也无需添加金属离子,可以简化生产工艺,降低生产成本。由于该高温酸性α-淀粉酶天然具有较强的pH 稳定性,并且在酸性环境中具有较高的耐酸性,因此具有重要的潜在工业应用前景。
[1] 张丽萍,徐岩,金建中. 酸性α-淀粉酶的研究与应用[J]. 酿酒,2002,29(3):19 -21.
[2] 赵荧,刘红岩,宫正宇,等. 地衣芽孢杆菌A.4041 耐高温α-淀粉酶的纯化及性质[J]. 吉林大学自然科学学报,1997,3(3):85 -88.
[3] Crab W,Mitchinson C. Enzymes involved in the precessing of starch to sugars[J]. Trends Biotechnol,1997,15(9):349 -352.
[4] 王希菊,蒋宇,邵蔚蓝. 海栖热胞菌胞外α-淀粉酶在E.coli中的高效表达[J]. 微生物通报,2005,32(4):25-30.
[5] Suzuki T,Iwasaki T,Uzawa T,et al.Sulfolobus tokodaiisp. nov. (f.Sulfolobussp. strain 7),a new member of the gennusSulfolobusisolated from Beppu Hot Springs,Japan[J]. Extremophiles,2002,6(1):39 -44.
[6] Kawarabayasi Y,Hino Y,Horikawa H,et al. Complete genome sequence of an aerobic thermoacidophilic crenarchaeon,Sulfolobus tokodaiistrain 7[J]. DNA Res,2001,8 (4):123 -140.
[7] Bradford M M. A rapid and sensitive method for the quantitation of microfram quantities of protein utilizing the principle of protein-dye binding[J]. Anal biochem,1976,72(5):248 -254.
[8] 沈微,王正祥,唐雪明,等. 古细菌Pyrococcus furiosus高嗜热α-淀粉酶基因在大肠杆菌中的分泌表达[J]. 中国酿造,2003,124(1):12 -14.
[9] Lee H S,Shockley K R,Schut G J,et al. Transcriptional and biochemical analysis of starch metabolism in the hyperthermophilic archaeonPyrococcus furiosus[J]. J Bacteriol,2006,188 (6):2 115 -2 125.
