乳清蛋白菊粉糖基化复合物的褐变特性与抗氧化活性*
2013-10-30王瑜周春生刘书云田然田雨姜瞻梅
王瑜,周春生,刘书云,田然,田雨,姜瞻梅
(东北农业大学乳品科学教育部重点实验室,东北农业大学食品学院,黑龙江 哈尔滨,150030)
糖基化反应,是一种氨基化合物和羰基化合物之间发生的非酶褐变反应,与化学修饰相比较,糖基化反应为食品和药品系统提供了更安全的接枝物,这种酶法修饰蛋白质可以用于改善蛋白质的稳定性、乳化性、溶解性[1]。Jimenez-Castano[2]等将葡聚糖引入到β-乳球蛋白中可改善β-乳球蛋白的溶解性和热稳定性;Chevalier[3]等将乳糖引入到β-乳球蛋白中可提高乳清蛋白的起泡性;Li[4]等发现,乳清蛋白麦芽糖的糖基化产物具有显著的凝胶形成特性。
菊粉是由D-果糖经β(1-2)糖苷键连接而成的链状多糖,是一种非消化性的碳水化合物,含有大量游离氨基,它不仅能够改善食品质构,提高流变学性质和营养特性,而且可以作为氨基的供应体与还原糖发生糖基化反应,对于菊粉糖基化反应的研究目前集中在乳化性方面[5],而抗氧化性方面的研究较少。本研究拟利用糖基化修饰技术,以乳清蛋白和菊粉为研究对象,制备乳清蛋白菊粉糖基化复合物,探讨糖基化反应条件对乳清蛋白菊粉糖基化复合物的褐变特性与抗氧化性能的影响,为拓展糖基化蛋白改性和提供天然的抗氧化剂提供基本技术依据。
1 材料与方法
1.1 材料与仪器
乳清蛋白分离物(WPI),北京Milky Way 商业公司;菊粉,定西市陇海乳品有限责任公司;2,2-Di(4-tert-octylphenyl)-1-picrylhydrazyl(DPPH),美国sigma公司;铁氰化钾,天津市博迪化工有限公司;过硫酸钾,天津市凯通化学试剂有限公司;三氯化铁,天津市双船化学试剂厂;三氯乙酸,上海凌峰化学试剂有限公司。
pH 计,赛多利斯科学仪器(北京)有限公司;GL-21M 离心机,上海市离心机械研究所;精密电子天平,梅特勒-托利多仪器(上海)有限公司;UT-1800 紫外-可见分光光度计,日本岛津公司;DK-8B 电热恒温水浴锅,上海精宏实验设备有限公司;KQ3200DE 型数控超声波清洗器,昆山市超声仪器有限公司;漩涡混合器,上海琪特分析仪器有限公司;电子恒温油浴锅,江苏金坛市亿通电子有限公司。
1.2 实验方法
1.2.1 乳清蛋白糖基化复合物的制备
将乳清蛋白与菊粉按照一定的比例混合、溶解,在一定温度和pH 值下于具塞离心管中油浴反应,并测定反应后pH 值,反应产物在-20℃贮存备用。
1.2.2 褐变程度的测定
参考Ajandouz[6]等人的方法,并稍作修改。将不同湿热反应条件下制备的样品用蒸馏水稀释4 倍,在420 nm 处测定其吸光值变化。
1.2.3 DPPH·清除能力的测定
参考Saiga[7]的方法,并稍作修改。取稀释4 倍的样品液1.0 mL(0.01 mol/L pH 值为7 的磷酸盐缓冲液稀释)及4.0 mL 0.1 mmol/L 的DPPH 乙醇溶液(体积分数为95%),混合均匀,室温下避光静置0.5 h,用体积分数95%的乙醇溶液作参比,在517 nm 测定吸光度Ai,95%的乙醇代替样品溶液,得吸光度Ac,95%的乙醇代替DPPH 溶液,得吸光度Aj。

1.2.4 还原能力测定
参考Oyaizu[8]的方法,并稍作修改。取0.5 mL的2 倍稀释样品(0.01 mol/L pH 值为7 的磷酸盐缓冲液稀释),加入2.5 mL 的0.2 mol/L,pH 值为6.6的磷酸盐缓冲溶液和2.5 mL 的1%的K3Fe(CN)6溶液混合均匀,将混合物于50℃下保温20 min 后快速冷却,再加入2.5 mL 的10%的三氯乙酸溶液,混匀后再3 000 r/min 离心10 min。取2.5 mL 上清液,加入2.5 mL 的蒸馏水和0.5 mL 的0.1%的FeCl3溶液,混合均匀,静置10 min 后,在700 nm 处测定吸光值。
1.2.5 实验设计
分别研究不同反应物浓度(2%、4%、6%、8%、10%),反应温度(80℃、90℃、100℃、105℃、110℃),反应起始pH 值(7、8、9、10、11、12)对乳清蛋白糖基化复合物的褐变特性与抗氧化活性的影响,并对乳清蛋白糖基化反应条件进行优化。
1.2.6 统计分析
数据分析采用SPSS17.0 软件,进行方差分析(Dundan 多重比较)和独立样本T 检验,数据以平均值±标准差表示(n=4)。
2 结果与讨论
2.1 反应物浓度对乳清蛋白糖基化复合物的褐变特性与抗氧化活性的影响
2.1.1 反应物浓度对乳清蛋白糖基化复合物褐变程度的影响
棕褐色的生成(420 nm)是最容易衡量的糖基化反应的结果,因为它提供了一个可视化估计(Morales& Jimenez-Perez,2001)[9]。420 nm 处的吸光值在一定程度上反映了糖基化反应程度的大小,吸光值越大,说明其反应程度越大,反之则较小。将乳清蛋白与菊粉按1 ∶1 配制成2%、4%、6%、8%、10%的溶液,在100℃,起始反应pH 值9 条件下反应6 h,制得乳清蛋白菊粉糖基化复合物。反应物浓度对乳清蛋白糖基化复合物褐变程度影响的实验结果见图1。
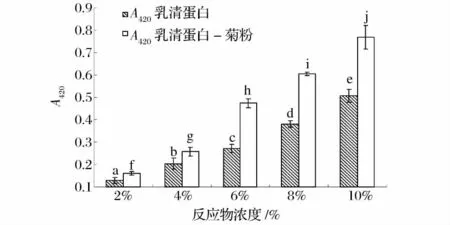
图1 反应物浓度对乳清蛋白糖基化复合物褐变程度的影响Fig.1 The effect of reactant concentration on browning intensity of glycosylated WPI
从图1 的T 检验结果可知,糖基化乳清蛋白与单独加热的乳清蛋白相比,420 nm 处吸光值差异显著(P<0.05),这说明糖基化反应可使乳清蛋白发生褐变反应,色泽变深。由方差分析的试验结果可知,单独加热后的乳清蛋白和糖基化乳清蛋白的褐变强度,随反应物浓度增加,逐渐增大(P<0.05),这表明增加反应物浓度,可增强乳清蛋白糖基化复合物褐变程度。
2.1.2 反应物浓度对乳清蛋白糖基化复合物抗氧化活性的影响
本文评价乳清蛋白糖基化复合物的抗氧化活性,主要包括DPPH 自由基清除能力和还原能力的两个方面。反应物浓度对乳清蛋白糖基化复合物抗氧化活性的影响试验结果见表1。

表1 反应物浓度对乳清蛋白糖基化复合物抗氧化活性的影响Table 1 The effect of reactant concentration on antioxidant property of glycosylated WPI
从表1 中T 检验试验结果可知,与单独加热乳清蛋白相比,当反应物浓度为6%、8%、10%时,乳清蛋白菊粉糖基化复合物的DPPH 自由基清除能力和还原能力显著增强(P<0.05)。
由表1 中方差分析试验结果可知,单独加热乳清蛋白的DPPH 自由基清除能力随着反应物浓度的增加,略微增大;然而,乳清蛋白菊粉糖基化复合物的DPPH 自由基清除能力,随着反应物物浓度增加,其显著增大(P<0.05)。当反应物浓度为10%时,乳清蛋白菊粉糖基化复合物的DPPH·清除率是反应物浓度为2%时的4.5 倍,远远高于单独加热乳清蛋白的自由基清除能力。这可能是糖基化蛋白可通过提供氢,使得DPPH·形成稳定的DPPH-H 分子,从而达到清除DPPH·的目的(Matthaus)[10]。由此,可推断乳清蛋白菊粉糖基化复合物能够有效的为自由基提供氢,是自由基抑制剂,可以作为抗氧化剂。
单独加热乳清蛋白的还原能力变化差异不显著(P>0.05),而乳清蛋白菊粉糖基化复合物的还原能力随着反应物浓度升高,其显著增大(P<0.05)。反应物浓度为10%时的乳清蛋白菊粉糖基化复合物的还原能力是反应物浓度为2%的3 倍。
综合上述结果表明,增加反应物浓度可有效提高乳清蛋白糖基化复合物的抗氧化活性。
2.2 温度对乳清蛋白糖基化复合物的褐变特性与抗氧化活性的影响
2.2.1 温度对乳清蛋白糖基化复合物褐变程度的影响
在糖基化反应中,温度相差10℃,褐变速度就可相差3 ~5 倍。将乳清蛋白与菊粉按1∶1 比例配制成6%的溶液,调节起始反应pH 值为9,分别在80℃、90℃、100℃、105℃、110℃条件下反应6 h,制得乳清蛋白菊粉糖基化复合物。反应温度对乳清蛋白糖基化复合物褐变程度影响的试验结果见图2。

图2 温度对乳清蛋白糖基化复合物褐变程度的影响Fig.2 The effect of temperature on browning intensity of glycosylated WPI
从图2 的T 检验结果可知,不同反应温度条件下的糖基化乳清蛋白与单独加热的乳清蛋白相比,420 nm 处吸光值差异显著(P<0.05)。从图2 中方差分析的试验结果可知,单独加热后的乳清蛋白和糖基化乳清蛋白在420 nm 处的吸光值,随着反应温度升高而缓慢增加(P>0.05),可能是由于温度的升高,可促进羰氨缩合反应,使得生成的褐色物质增加,但由于多糖反应较慢,只有较少量的中间产物形成了褐色物质,这表明升高反应温度可增强糖基化反应的褐变程度,但影响程度较小。
2.2.2 温度对乳清蛋白糖基化复合物抗氧化活性的影响
温度是糖基化反应的重要影响因素,可以影响还原酮,类黑精等抗氧化物质的生成。温度对乳清蛋白糖基化复合物抗氧化活性影响的试验结果见表2。

表2 温度对乳清蛋白糖基化复合物抗氧化活性的影响Table 2 The effect of temperature on antioxidant property of glycosylated WPI
从表2 中T 检验试验结果可知,与单独加热乳清蛋白相比,当温度超过100℃后,乳清蛋白菊粉糖基化复合物的DPPH 自由基清除能力及还原能力显著增强(P<0.05)。
由表2 中方差分析试验结果可知,糖基化乳清蛋白的DPPH 自由基清除能力随温度升高呈上升趋势,在90℃时显著增强(P<0.05),单独加热乳清蛋白的DPPH 自由基清除能力在90℃、105℃时显著增强(P<0.05),这与Manzocco 等在许多反应模式中发现的反应温度与抗氧化性呈现正相关的研究结果一致[11]。
乳清蛋白菊粉糖基化复合物的还原能力随温度升高而缓慢增加(P<0.05),而单独加热乳清蛋白的还原能力对不同反应温度变化,其差异不显著(P>0.05)。这可能是因为提高反应温度可以促进糖基化反应产生还原酮和一系列杂环化合物,还原酮物质具有还原和螯合作用,杂环类化合物之间具有相互缔合和协同作用,这对抗氧化活性有很大的作用。
综合所述可知,升高反应温度,可以提高乳清蛋白菊粉糖基化复合物的抗氧化性。
2.3 起始反应pH 值对乳清蛋白糖基化复合物的褐变特性与抗氧化活性的影响
2.3.1 起始反应pH 值对乳清蛋白糖基化复合物褐变程度的影响
较高起始反应pH 值有助乳清蛋白与菊粉发生糖基化反应,导致褐变。将乳清蛋白与菊粉按1:1 比例配制成6%的溶液,分别调节起始反应pH 值为7、8、9、10、11、12,在100℃下反应6 h,制得乳清蛋白菊粉糖基化复合物。起始反应pH 值对乳清蛋白糖基化复合物褐变程度影响的试验结果见图3。
从图3 的T 检验结果可知,糖基化乳清蛋白与单独加热乳清蛋白相比,除起始反应pH 值8 以外,420 nm 处吸光值差异显著(P<0.05),说明不同反应条件下的糖基化反应,对乳清蛋白褐变程度影响较大。同时,由方差分析的试验结果可知,单独加热乳清蛋白,在起始反应pH 值8 ~11 范围内,420 nm 处的吸光值差异不显著(P>0.05);糖基化乳清蛋白,随起始反应pH 值的升高逐渐增大,在起始反应pH 值为10、11、12 时,420 nm 处的吸光值差异显著(P<0.05),由此可知,碱性条件有利于糖基化反应的进行,这与Moreno 等在葡萄糖—赖氨酸体系中发现的结果一致[12]。

图3 起始反应pH 值对乳清蛋白糖基化复合物褐变程度的影响Fig.3 The effect of initial pH on browning intensity of glycosylated WPI
2.3.2 起始反应pH 值对乳清蛋白糖基化复合物抗氧化活性的影响
褐色素的形成和抗氧化活性有很大的关联,因此,起始反应pH 值会对糖基化蛋白的抗氧化活性产生影响。起始反应pH 值对乳清蛋白糖基化复合物抗氧化活性的影响试验结果见表3。

表3 起始反应pH 值对乳清蛋白糖基化复合物抗氧化活性的影响Table 3 The effect of initial pH on antioxidant property of glycosylated WPI
从表3 中T 检验试验结果可知,当起始反应pH值7 ~10 范围内,与单独加热乳清蛋白相比,乳清蛋白菊粉糖基化复合物的DPPH 自由基清除能力显著增强(P<0.05);在起始反应pH 值7 ~12 范围内,乳清蛋白菊粉糖基化复合物的还原能力显著增强(P<0.05)。
由表3 中方差分析试验结果可知,单独加热乳清蛋白和乳清蛋白菊粉糖基化蛋白的DPPH 自由基清除能力,呈现先升高后降低的变化趋势。这可能由于氨基酸是两性分子,它在碱性介质中呈阴离子,此时,氨基反应性较强,易发生反应,因此起始反应pH 值偏向碱性有利于糖基化反应的进行,但是碱性过强,蛋白质的一级结构可能发生变化,如脱氨、脱羧和肽键断裂,引起“胱赖反应”,将氨基酸转变成有毒的化合物,反而不利于糖基化反应的进行。
在起始反应pH10 ~12,单独加热乳清蛋白的还原能力逐渐增大(P<0.05),而糖基化乳清蛋白的还原能力,随着起始反应pH 值增大而显著增强(P<0.05)。起始反应pH 值为7 时,糖基化乳清蛋白的还原能力最低,可能由于还原酮及裂变产物在较高的pH 值条件下更容易形成[13]。
3 结论
在乳清蛋白糖基化反应过程中,反应物浓度越大,反应温度越高,乳清蛋白菊粉糖基化产物的褐变强度越大,抗氧化活性越强;起始反应pH 值越大,乳清蛋白菊粉糖基化产物的褐变强度及还原能力越强,而其DPPH 自由基清除能力呈现先升高后降低的趋势。当反应物浓度为6%,温度为100℃,起始反应pH 值为9 时,所获得的乳清蛋白糖基化产物抗氧化活性较强。乳清蛋白与菊粉的糖基化反应是一种具有应用前景的改善乳清蛋白抗氧化活性的方法,其糖基化产物可以作为一种天然抗氧化剂应用于食品工业中。
[1] 芦晶,布冠好,罗永康. 乳清蛋白-多糖的制备及功能特性的研究[J]. 中国乳品工业,2007,35(5):5 -25.
[2] Laura Jimenez-Castano,Mar Villamiel,Rosina Lopez-Fandino. Glycosylation of individual whey proteins by Maillard reaction using dextran of different molecular mass [J].Food Hydrocolloids,2007,21(3):433 -443.
[3] Chevalier F,Chobert J -M,Dalgalarrondo,et al. Maillard glycation of b-lactoglobulin induces conformation changes[J]. Nahrung-Food,2002,46 (12):58 -63.
[4] Li C P,Enomoto H,Ohki S,et al. Improvement of functional properties of whey protein isolate through glycation and phosphorylation by dry heating [J]. International Dairy Science,2005,88 (1):4137 -4145.
[5] Hao Jing,Melissa Yap,Peter Y Y. Wong et al. Comparison of physicochemical and antioxidant properties of eggwhite proteins and fructose and inulin maillard reaction products[J]. Food Bioprocess Technol,2009,8 (3):291 -298.
[6] Ajandouz E H,Tchiakpe. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Food Science,2001,66 (7):926 -931.
[7] Saiga A,Tanabe S,Nishimua T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J]. Journal of Agricultural and Food Chemistry,2003,51 (12):3661 -3667.
[8] Oyaizu M. Antioxidant activities of browning reaction prepared form gulcosamine [J]. Japanese Journal of Nutrition,1986,44 :307 -315.
[9] Morales F J,Jimenez-Perez. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J]. Food Chemistry,2001,72 (5):119 -125.
[10] Soottawat Benjakul,Wittayachai Lertittikul,Friedrich Bauer. Antioxidant activity of Maillard reaction products from a porcine plasma protein-sugar model system [J].Food Chemistry,2005,93(2):189 -196.
[11] Sumaya-Martinez M T,Thomas S,Linard B,et al. Effect of Maillard reaction conditions on browning and antiradical activity of sugar-tuna stomach hydrolysate model system[J]. Food Research International,2005,38(8/9):1 045 -1 050.
[12] Wittayachai Lertittikul,Soottawat Benjakul,Munehiko Tanaka. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry,2007,100(2):669 -677.
[13] Bates L,Ames MacDougall. Laboratory reaction cell to model Maillard reaction colour development in a starchglucose-lysine system [J]. Journal of Food Science,1998,63(5):1 991 -1 996.
