大豆11S 球蛋白-麦芽糖共价改性及其凝胶流变特性*
2013-10-30李冰迟玉杰鲍志杰孙临政
李冰,迟玉杰,鲍志杰,孙临政
(东北农业大学食品学院,教育部大豆生物学重点实验室,黑龙江 哈尔滨,150030)
优良的凝胶特性对大豆蛋白在食品领域中的应用起到了不可替代的作用,如在饮料、汤、酱,这样的流体或半流体食品中,以及在香肠、丸子、肉类罐头,这样的固体或半固体中。而大豆蛋白在胶凝过程中的流变特性对食品最终优良的理化及凝胶特性的形成至关重要。大豆蛋白的胶凝过程是溶液体系由液态到半固态(或固态)转变的过程。动态旋转流变仪对待测样品进行小振幅震荡,即施加交变应力,通过测量参数(弹性模量G’及黏性模量G”)的反馈来检测蛋白质凝胶的形成过程[1]。
为满足食品领域对于具有专项高凝胶型产品的需求,常采用特定方法对大豆分离蛋白进行改性,其中糖基化反应是目前众多改性方法中较为理想的一种[2]。糖基化改性是基于一种自发反应,不需要额外添加任何化学试剂,通过加热就可以很大程度地加速该反应的进程[3]。大豆分离蛋白根据沉降系数的不同可将其分为2S、7S、11S 和15S 4 种组分,其中7S 组分占30%以上主要由7S 球蛋白组成,11S 组分占40%以上由单一的11S 球蛋白构成[4]。7S、11S 组分对凝胶的形成及其性质起主要的作用,朱建华[5]等人采用小变形振荡流变手段研究了葡聚糖分子质量对大豆7S 蛋白凝胶的影响,结果表明,热致大豆7S 蛋白凝胶的黏弹性质随所添加的葡聚糖分子质量的增加而增加;许彩虹[6]等将3 种不同分子量葡聚糖与β-伴大豆球蛋白进行干热反应,得出以共价键结合的葡聚糖能够和蛋白质分子均匀的分布在凝胶网络结构中,不会引起相分离。故而以提高大豆分离蛋白凝胶特性为目的,针对主要组分的糖基化改性研究具有深远意义。
本实验在前人[2]研究基础上,选用麦芽糖对大豆11S 球蛋白进行糖基化湿热改性,Box-Behnken 模型进行工艺优化,并运用流变学手段对糖基化产物胶凝过程进行监测分析,旨在寻找到一种有效提高凝胶特性并适合工业化生产的改性方法。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕,哈高科大豆食品有限公司提供,经粉碎,过60 目筛得到脱脂豆粉;麦芽糖,天津市天理化学试剂有限公司;其他化学试剂均为国产分析纯。
飞鸽TGL-16aR 高速冷冻离心机,上海安亭科学仪器厂;电热恒温鼓风干燥箱(DGG-9023A 型),上海森信实验仪器有限公司;FDU-1100 型冷冻干燥机,日本Tokyo Rikakikai 公司;Bohlin Gemini2 旋转流变仪,英国Malvern 公司;TA. XT. Plus 质构仪,Stable Micro system Ltd。
1.2 实验方法
1.2.1 大豆11S 球蛋白分离纯化
根据Nagano 法[7]从低温脱脂豆粕中提取大豆11S 球蛋白,冷冻干燥后备用。
1.2.2 糖基化蛋白样品的制备
将不同质量的麦芽糖溶解于0.01 mol/L 磷酸盐缓冲液(pH 7.0)中,再与纯化后的11S 球蛋白混匀制成100 g/L 蛋白浓度的混合物,保鲜膜封口置于一定温度的水浴中,反应一定时间后立即取出,冷却至室温,冻干后得到11S 球蛋白-麦芽糖糖基化产物。
1.2.3 糖基化蛋白凝胶的制备与测定[8-9]
将糖基化改性后的混合粉溶解于0.01 mol/L 磷酸盐缓冲液(pH 7.0)中,蛋白含量(以11S 蛋白计)120 g/L,充分搅拌3 h 后,于4℃下冷藏过夜确保蛋白质充分水化,测定操作参照刘燕[10]等人的方法。
1.2.4 糖基化蛋白凝胶流变性质的测定
采用马尔文旋转流变仪对样品进行测定,样品制备参照1.2.2 方法。测定时取待测样品置于60mm平行板间,调节间距为0.5 mm,小心擦去过量样品,在样品裸露部分滴加一层薄硅油以防止加热过程中水分的蒸发。采用动态振荡模式,平衡溶液温度30 s后自25℃升温至90℃,恒温30 min 后降温至25℃,整个过程升降温速率设为2℃/min,保持频率0.1Hz,固定形变0.01。记录此过程待测样品的弹性模量(G’)及黏性模量(G”)随时间变化的趋势[11]。
1.2.5 响应面设计方案
在单因素实验的基础上,考虑到实际生产要求,以麦芽糖添加量(X1)、反应温度(X2)、反应时间(X3)为自变量,11S 球蛋白凝胶强度(Y)为响应值,采用响应面分析方法进行优化,试验设计因素水平见表1。

表1 试验因素水平表Table 1 Experiment design for levels of factors
2 结果与讨论
2.1 大豆11S 球蛋白与麦芽糖糖基化反应的单因素试验
2.1.1 麦芽糖添加量(X1) 对凝胶强度的影响
由图1 可知,在相同的反应温度、反应时间下,糖基化产物凝胶强度随着麦芽糖添加量的增加而呈先上升后下降,最终趋于平缓的变化趋势,当麦芽糖添加量为2%时,所得产物凝胶强度最高,这可能是因为糖的接入使蛋白质结构展开,疏水作用力增强。随后的下降趋势可能是因为生成的糖基化产物溶解性差,导致凝胶强度下降。当麦芽糖添加量超过3%时,糖基化反应趋于饱和,凝胶强度基本不变。

图1 不同麦芽糖添加量对凝胶强度的影响Fig.1 Effect of adding contents of maltose on gel strength
2.1.2 反应温度(X2) 对凝胶强度的影响
从图2 可以看出,在相同的麦芽糖添加量、反应时间条件下,产物凝胶强度随着反应温度的升高呈先上升后下降的变化趋势,当反应温度为70℃时所得产物凝胶强度最高。分析原因可能是由于加热初期大豆球蛋白空间结构受热展开,暴露出了原本埋藏在结构内部的疏水性氨基酸残基及巯基[12],导致蛋白质表面疏水性发生变化;而随着反应温度的继续升高,一方面蛋白和麦芽糖反应剧烈,生成的麦芽糖-蛋白复合物不易溶解;另一方面,蛋白间通过S-S 发生聚集,形成粗糙、富含不溶物的凝胶,从而使凝胶的强度有所下降。

图2 不同反应温度对凝胶强度的影响Fig.2 Effect of different reaction temperature on gel strength
2.1.3 反应时间(X3) 对凝胶强度的影响
如图3 所示,在相同的麦芽糖添加量、反应温度条件下,产物的凝胶强度随着反应时间的增加呈先上升后下降的变化趋势,当反应时间为50 min 时所得产物凝胶强度最大。大豆球蛋白反应活性随着反应时间的增加而逐步提高,但达到某一时刻,蛋白质分子内或分子间的巯基会交联形成S-S,使蛋白质间彼此聚集,溶解性降低,凝胶强度下降。

图3 不同反应时间对凝胶强度的影响Fig.3 Effects of different reaction time on gel strength
2.2 响应面试验结果
2.2.1 糖基化反应模型的建立
按照试验设计方案进行试验,结果见表2。

表2 响应面试验设计条件及结果表Table 2 Design and results of response surface experiment
应用Design Expert7.1 软件,对表2 中的数据进行多元回归拟合,可得麦芽糖添加量(X1)、反应温度(X2)、反应时间(X3)与11S球蛋白凝胶强度(Y)的二次多项回归方程:
Y1= 267.5 - 21.97X1- 17.76X2- 1.62X3-27.63X1X2+ 0.7X1X3+ 17.81X2X3- 60.02X12 -
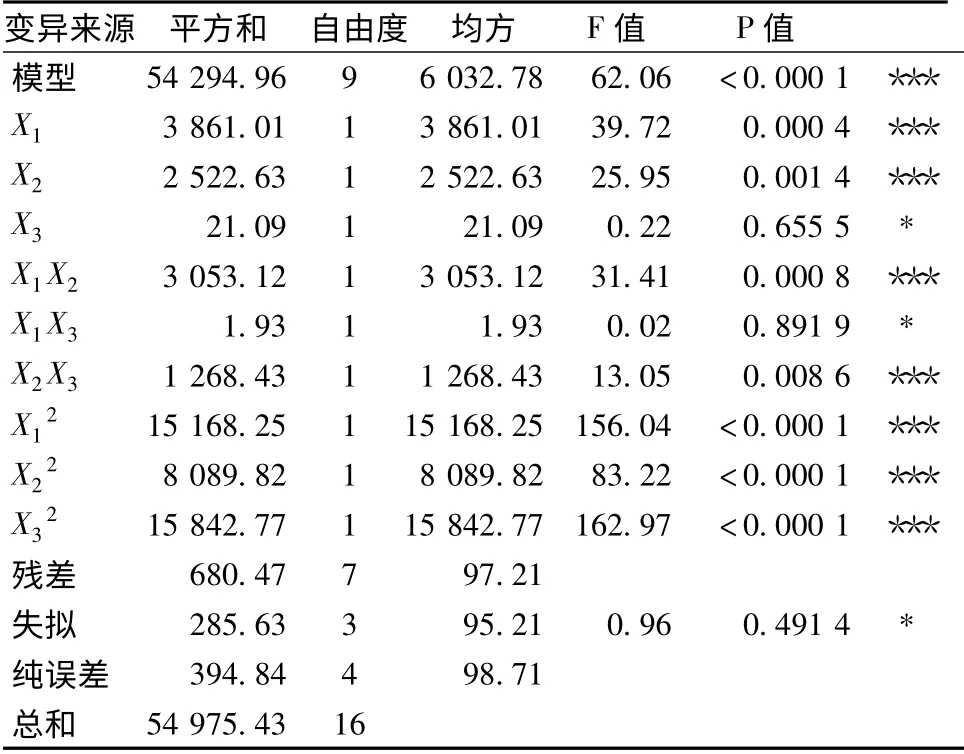
表3 11S 球蛋白凝胶强度的方差分析Table 3 Variance analysis of gel strength of 11S globulin
由表3 的方差分析可以看出,11S 球蛋白凝胶强度回归方程模型F 检验显著(P<0.05),失拟P值为0.491 4 大于0.05,失拟项不显著,说明回归方程的拟合程度较好,试验误差较小。同时,模型的决定系数R2=0.987 6,说明98.76%的变更可通过该模型解释;模型的调整决定系数是0.971 7,说明该模型可以解释97.17%的影响值变化,进而表明此模型拟合度高,可用于预测和分析不同反应条件下,糖基化复合物的凝胶特性及对反应条件的优化[13]。
2.2.2 响应面的优化
根据试验结果,经回归分析,得到各因素对凝胶硬度影响的响应曲面图,并确定最佳因素水平,结果如图4 所示。
利用软件Design Expert 7.1 对糖基化改性工艺进行优化,以糖基化11S 球蛋白凝胶强度为指标,当麦芽糖添加量为1.85%,反应温度68.42℃,反应时间50.08 min 时,凝胶强度可以达到269.43 g。根据实际情况,将麦芽糖添加量设定为2.0%,反应温度设定为70℃,反应时间设定为50 min,在此条件下进行了3 次验证试验(数据未显示),取平均值,得到结果为270.52 g,相对偏差0.4%,表明Box-Behnken 模型可用于大豆球蛋白-麦芽糖糖基化反应条件的优化。且与未改性11S 球蛋白相比,共价改性的11S 球蛋白凝胶强度提高了20.7%,表明糖基化有效的提高了蛋白的凝胶特性。
2.3 大豆11S 蛋白及其糖基化产物凝胶流变学性质

图4 凝胶强度影响因素的响应面分析Fig.4 Response surface analysis of influencing factors for gel strength
2.3.1 小振幅动态测试
检测物质的胶凝过程通常采用动态流变学手段[14-15]。动态测试中有2 个独立参数,弹性模量G’和粘性模量G”,在凝胶形成过程中分别反映弹性性质和粘性性质,对于典型的凝胶体系,G’和G”相互平行,前者大于后者[6]。
图5 所示为大豆11S 球蛋白及其糖基化产物G’和G”随时间变化的趋势。从图5 中可以看出温度扫描开始时,大豆11S 球蛋白的G’和G”均处于较低水平(<10Pa),体系以液态为主。当升温至90℃左右时,大豆11S 球蛋白G’和G”突然增长,当G’>G”时(90℃持续加热10 min 后即2 648 s 处)出现凝胶点(当聚集的蛋白质从黏性的流体转变为弹性的凝胶,在流变学中,该转变点被称为凝胶点,相对应的温度被称为凝胶温度。而事实上G’和G”的交叉点也被定义为凝胶温度Tg[16]),说明样品溶液已经开始从以液体性质为主的溶胶状态转变为以固体性质为主的凝胶状态,这是由于蛋白质受热变性,不久后形成了初步的网络结构所致[17]。

图5 11S 及其糖基化产物的G’和G”随凝胶加热时间的变化Fig.5 Dependence of Storage G’(open symbols),loss G’’(filled symbols)module and temperature on time for glycinin and glycated products
糖基化蛋白的G’和G”变化规律与11S 球蛋白单独体系相类似,11S-麦芽糖糖基化产物溶液在温控初始阶段的弹性模量G’和黏性模量G”值略高于大豆11S 球蛋白单一体系,说明体系中糖分子的接入,提高了大豆11S 蛋白溶液的黏弹特性,使此时的蛋白样品具有一定的弱凝胶性。随着对糖基化产物蛋白体系的进一步加热,温度升至83℃左右时,糖基化产物弹性模量G’和黏性模量G”骤然升高,在G’>G”时(90℃持续加热8 min 后即2 489 s 处)出现凝胶点,表明样品溶液已开始从液体状态转变为以固体状态为主的凝胶态。
在90℃恒温阶段,糖基化产物凝胶黏弹性较11S单一体系显著提高,这是因为糖基化反应使得体系中引入了麦芽糖分子即大量羟基,分子间氢键的形成机会大大增加所致。在此阶段,11S 球蛋白结构充分展开,凝胶网络初步形成。之后的降温阶段,蛋白G’和G”上升平缓且趋于平行,说明体系已形成了较稳定的凝胶网络结构。
3 结论
(1)利用Box-Behnken 模型对大豆11S 球蛋白与麦芽糖糖基化反应进行了优化,方差分析表明拟合较好。优化后的工艺条件为麦芽糖添加量1.85%,反应温度68.42℃,反应时间50.08 min,凝胶强度可达269.43 g。根据实际情况,将麦芽糖添加量设定为2.0%,反应温度70℃,反应时间50 min,此条件下验证结果为270.52g,相对偏差为0.4%,且与未改性11S 球蛋白相比,凝胶强度提高了20.7%。
(2)采用旋转流变仪对大豆11S 球蛋白及其糖基化产物的凝胶形成过程进一步分析得出:在整个温度扫描过程中,大豆11S 糖基化产物凝胶的粘、弹性均大于大豆11S 球蛋白单一体系,宏观表现为具有较好的凝胶特性,且相比于黏性模量G”,其弹性模量G’增长较快,凝胶形成点有所提前(即从2 648 s 提前到2 489 s),说明糖基化反应使得大豆11S 球蛋白形成了硬度较高的凝胶结构,此结果与凝胶质构分析结论相一致。
[1] Schooneveld-Bergmans M E F,Dignum M J W,Grabber J H,et al. Studies on the oxidative cross-linking of feruloylated arabinoxylans from wheat flour and wheat bran[J].Carbohydrate Ploymers,1999,38(4):309 -317.
[2] 迟玉杰,范淼. 高凝胶性大豆球蛋白制备工艺优化[J]. 农业机械学报,2012,43(10):124 -130.
[3] 布冠好,刘伯业,陈复生,等. 糖基化修饰对大豆蛋白功能特性的影响[J]. 农业机械,2011(4):77 -80.
[4] Fukushima D. Recent Progress of Soybean Protein Foods:Chemistry,Technology and Nutrition[J]. Food Reviews International,1991a,7(3):323 -351.
[5] 朱建华,杨晓泉,龚倩,等. 葡聚糖对大豆7S 蛋白凝胶流变性质及微观结构的影响[J]. 中国粮油学报,2009,24(8):21 -27.
[6] 许彩虹,于淑娟,杨晓泉. 糖基化对大豆7S 球蛋白凝胶流变性质的影响(Ⅱ)[J]. 现代食品科技,2010,26(12):1 293 -1 337.
[7] Nagano T,Hirotsuka M,Mori H,et al. Dynamic viscoelastic study on the gelation of 7S globulin from soybeans[J]. Journal of Agricultural and Food Chemistry,1992,40:941 -944.
[8] 范淼,迟玉杰,姜剑,等.Box_Behnken 模型优化大豆分离蛋白共价改性[J]. 食品与发酵工业,2011,37(6):60-64.
[9] Jing H,Kitts D. Chemical and biochemical properties of asein-sugar Maillard reaction products[J]. Food and Chemical Toxicology,2002,40:1 007 -1 015.
[10] 刘燕,裘爱泳. 大豆蛋白与多糖的接枝改性[J]. 中国油脂,2006,31(1):39 -41.
[11] Kim K H,Renkema J M S. Rheological properties of soybean protein isolate gels containing emulsion droplets[J].Food Hydrocolloids,2001,15:295 -302.
[12] A Ruqaie M,Kasapis S,Abeysekera R. Structural properties of pectin-gelatin gels. Part II,effect of sucrose /glucosesyrup [J]. Carbohydrate Polymers,1997,34(4):309 -321.
[13] 张波,迟玉杰.β_伴大豆球蛋白糖基化改性对其乳化性影响的研究[J]. 食品工业科技,2012,33(23):85-89.
[14] Schramm G. A practical approach to rheology and rheometry[M]. Germany:Gebrueder Haake,1994:321 -325.
[15] 刘翀,杨晓泉,唐传核,等.β_伴大豆球蛋白水分散液的弱凝胶流变学性质[J]. 现代食品科技,2009,25(4):348 -352.
[16] Sittikijyothina W,Sampaiob P,Goncalves M P. Heat-induced gelation of β-lactoglobulin at varying pH:Effect of tara gum on the rheological and structural properties of the gels[J]. Food Hydrocolloids,2007,21:1 046 -1 055.
[17] 陈欣,周春霞,洪鹏志,等. 糖基化改性对罗非鱼肉肌原纤维蛋白功能特性的影响[J]. 现代食品科技,2010,26(8):793 -796.
