芝麻香型白酒高温大曲嗜热功能菌的筛选与鉴定*
2013-10-30姚粟张明娟刘勇信春晖许玲张柏林程池
姚粟,张明娟,刘勇,信春晖,许玲,张柏林,程池
1 (北京林业大学 生物科学与技术学院,北京,100083)
2(中国食品发酵工业研究院 中国工业微生物菌种保藏管理中心,北京,100027)
3(山东扳倒井股份有限公司,山东 高青,256300)
芝麻香型白酒是我国传统白酒的重要创新香型之一,其融合了浓香、酱香、清香型白酒的特点,并以优雅的芝麻香味而闻名,受到广大消费者青睐[1]。高温制曲是芝麻香型白酒生产中重要的特点,在制曲过程中最高温度可达到65℃,独特的高温环境富集了大量嗜热菌[2-3],研究发现,嗜热芽孢杆菌能够代谢2,3-丁二醇生成4-甲基吡嗪等芝麻香微量香味物质,且能够产生多种蛋白水解酶,为美拉德反应提供多种氨基酸,进而推动美拉德反应的进行,生成芝麻香香味成份及其前体物质,因此嗜热菌对芝麻香型白酒的酒质有着重要的贡献[4]。施安辉[5]等采用传统分离培养方法对徐坊芝麻香型白酒大曲的微生物的分布进行了分析,发现芽孢杆菌属(Bacillussp.)为高温大曲中优势菌属,徐泽江[6]利用DGGE(变性梯度凝胶电泳)技术对芝麻香型白酒高温大曲细菌群落结构进行研究,发现高温大曲细菌群落结构由高温放线菌属(Thermoactinomycessp. )和乳酸杆菌属(Lactobacillussp. )等6 个菌属构成。曹建全[4]等利用高温大曲和芝麻香老窖池中选育出的5 株产酶能力较好的嗜热芽孢杆菌制作麸曲,发现麸曲质量好,能很好地提高芝麻香型白酒产品质量,使酒体更加丰满醇厚,芝麻香更优雅。芝麻香型白酒高温大曲中蕴含有丰富的嗜热细菌菌种资源,并且这些菌种与芝麻香型白酒酒质有密切关系。因此,从高温大曲中筛选获得嗜热功能菌,为白酒酿造提供优良的菌种资源,具有十分重要的意义。
本研究在此基础上,通过可培养方法从芝麻香型白酒高温大曲中筛选高温细菌,并测定其蛋白酶活性,对其进行形态特征观察和分子生物学鉴定,为芝麻香型白酒酿造过程中的微生物强化提供菌种资源,同时为芝麻香型白酒产香机理研究提供微生物学基础。
1 材料和方法
1.1 实验材料
1.1.1 样品
芝麻香型白酒高温大曲曲块:由山东扳倒井酒厂提供。
1.1.2 菌株
对照菌株:从浓香型酒曲中分离的1 株地衣芽孢杆菌。
1.1.3 培养基
分离筛选培养基:成品R2A 固态培养基。生长保藏培养基:成品NA 固体培养基。蛋白酶初筛培养基:脱脂奶粉1.5%,琼脂
1.5 %。
蛋白酶复筛培养基:15 g 麸皮,15 mL 蒸馏水。
1.1.4 试剂
干酪素,北京奥博星生物技术有限责任公司;结晶紫染液,北京陆桥技术有限责任公司;福林试剂,北京索莱宝科技有限公司;TaqDNA 聚合酶、dNTP、DL 2000 Marker、100bp Marker,天根生物有限公司;Gold-View,北京塞百盛基因技术有限公司;溶菌酶,Sigma公司、蛋白酶K,Merk 公司;细菌基因组DNA 提取试剂盒,天根公司。其余试剂均购自北京化工厂。
1.2 实验方法
1.2.1 嗜热菌株筛选
无菌条件下取芝麻香型白酒高温大曲样品约10 g 放入研钵中,将样品研磨分散后,准确称取10 g 磨过的样品放入已灭菌的三角瓶中,摇匀,制成10-1稀释液;将三角瓶放入摇床振荡30 min(37℃,200 r/min);振荡后,取出静止1 h;依次稀释成10-2、10-3、10-4、10-5、10-6、10-7稀释度;选取合适稀释度,吸取100 μL 涂布于R2A 平板上,每个稀释度做3 个平行[7];倒置放于55℃下培养24 h;观察菌落特征,选取差异明显的菌落进一步纯化培养,4℃保存备用。
1.2.2 产蛋白酶菌株初筛
将分离纯化的菌株,用接种针点种于牛奶琼脂平板上,55℃下培养24 h 后观察透明圈情况,若产生透明圈,则用直尺测透明圈直径(R)与菌落直径(r),根据平板上透明圈直径和菌落直径的比值(R/r),选出能产生较大透明圈的菌株。
1.2.3 产蛋白酶菌株复筛
(1)发酵培养
将初筛所得菌株分别接种于液体NA 培养基中,于50℃、200 r/min 下,培养24 h;将菌液接种于蛋白酶复筛培养基上,接种量为10%,50℃度下培养24 h。
(2)粗酶液制备
称取4 g 固体发酵产物,用pH 7.5 的磷酸盐缓冲液定容至20 mL,混匀,置室温浸取30 min,每10 min 搅动1 次,用低速离心机(4 000 r/min)离心10 min 取上清液,即为粗酶液[8]。
(3)福林酚法测定中性蛋白酶活力[9]
福林酚法规定,1 g 固体发酵产物在pH 7.5,40℃下,每分钟水解酪蛋白产生1 μg 酪氨酸所需的酶量为1 个酶活单位;具体测定方法见GB/T23527—2009。
1.2.4 菌株鉴定
(1)形态学观察
将菌株划线培养获得单菌落,观察菌落形态。通过结晶紫染色在油镜下观察菌株菌体形态。
(2)分子生物学方法鉴定
A 16S rDNA 序列分析
利用细菌基因组DNA 提取试剂盒(Tiangen 公司)提取所选菌株的基因组DNA,具体步骤参见试剂盒说明书。以基因组DNA 为模板,利用通用引物对16S rRNA 基因进行扩增。引物序列为:正向引物27f(5'-AGAGTTTGATCCTGGCTCA-3'),反向引物1492r(5'-GGTTACCTTGTTACGACTT-3')[10]。
50 μL PCR 反应体系为:50 ng DNA 模板,1 ×Taqreaction buffer,引物各20 pmol,20 μmol dNTP,1.5 单位Taq酶(Ferments)。反应程序为:95℃预变性5 min,94℃变性30 s,50℃复性40 s,72℃延伸80s,35 个循环后72℃延伸10 min。PCR 扩增产物用1% 的琼脂糖进行检测。纯化后的PCR 产物用ABI3700 基因测序仪测序。测序由北京诺赛基因组研究中心有限公司完成。测序结果用Chromas 软件参照正反序列图谱人工校对。
将测序得到的结果在EzTaxon server 2.1[11]进行比对,确定与已知序列的同源关系。
B 功能基因分析
以基因组DNA 为模板,利用gyrA 基因通用引物进行扩增。引物序列为:正向引物gyrA-f(5'-CAGTCAGGA AATGCGTACGTCCTT-3'),反向引物gyrA-r
(5'-CAAGGTAATGCTCCA GGCATTGCT-3')[12]。
50 μL PCR 反应体系为:50 ng DNA 模板,1 ×Taqreaction buffer,引物各20 pmol,20 μmol dNTP,1.5 单位Taq酶(Ferments)。反应程序为:95℃预变性5 min,94℃变性30 s,50℃复性40 s,72℃延伸80s,35 个循环后72℃延伸10 min。PCR 扩增产物用1% 的琼脂糖进行检测。纯化后的PCR 产物用ABI3700 基因测序仪测序。测序由北京诺赛基因组研究中心有限公司完成。测序结果用Chromas 软件参照正反序列图谱人工校对。
将测序得到的结果在NCBI 数据库上进行比对[13],确定与已知序列的同源关系。
2 结果与分析
2.1 嗜热菌筛选结果
根据菌落形态,挑取形态差异明显的菌株,分离纯化,共获得85 株嗜热菌,4℃斜面保藏,备用。
2.2 产蛋白酶菌株初筛结果
从高温大曲中分离得到10 株肉眼明显可见透明圈的菌株,透明圈直径与菌落直径见表1。
2.3 产蛋白酶菌株复筛结果
2.3.1 标准曲线
通过稀释不同浓度级的标准酪氨酸溶液,在680 nm 下测定光密度OD值,得其标准曲线见表2 和图1。

表1 蛋白酶初筛结果Table 1 the result of the first screening

表2 中性蛋白酶标准曲线Table 2 the standard curve of neutral protease

图1 中性蛋白酶标准曲线Fig.1 the standard curve of neutral protease
2.3.2 中性蛋白酶酶活测定结果
将10 株初筛所得的菌株和对照菌株分别发酵培养,应用福林酚法测定中性蛋白酶活力,结果见表3。

表3 蛋白酶复筛结果Table 3 the result of the second screening
从表1 和表3 结果可以看出,M5 菌株的透明圈直径D(cm)/菌落直径d(cm)值最大,固体发酵后测得酶活也最高,酶活力约是对照菌株酶活力的3 倍,说明M5 有很好的蛋白分解作用。由于菌株的准确鉴定是生产应用的前提,所以本研究选择M5 菌株进行鉴定,以确定其种属。
2.4 M5 菌株鉴定
2.4.1 M5 菌株形态特征观察
M5 菌株菌落为乳白色,表面粗糙,边缘整齐,不透明,较黏稠。菌体呈长杆状,单个居多,有少数两连杆、三连杆、链状现象,见图2。

图2 M5 菌体、菌落形态Fig.2 The mycelia and colonial morphology of strain M5
2.4.2 M5 分子生物学方法鉴定结果
(1)16S rDNA 序列分析和系统发育分析
以菌株M5 的基因组DNA 为模板,PCR 扩增出16S rDNA 序列,大小约为1500bp,电泳检测结果见图3。将M5 的16S rDNA 序列在EzTaxon server 2.1 上进行比对,依16S rDNA 序列经B1ast 比对后构建的系统发育树如图5,通过分析可知该菌为芽孢杆菌属(Bacillussp. )。
(2)功能基因序列分析和系统发育分析
以菌株M5 的基因组DNA 为模板,PCR 扩增出gyrA 基因序列,大小约为1000bp,电泳检测结果见图4。将M5 的gyrA 基因序列在NCBI 数据库中进行比对,依gyrA 基因序列经BLAST 比对后构建的系统发育树如图6,通过系统发育树分析可知,菌株M5 与枯草芽孢杆菌枯草亚种(Bacillus subtilissubsp.Subtilis)的模式菌株KCTC 3135 聚类在一个系统发育分支,序列同源性为100%以上,可确定M5 为枯草芽孢杆菌枯草亚种(Bacillus subtilissubsp.subtilis)。

图3 M5 的16S rDNA 序列电泳检测Fig.3 PCR amplification of 16S rDNA fragments of the strain M5

图4 M5 的gyrA 基因序列电泳检测Fig.4 PCR amplification of gyrA fragments of the strain M5

图5 菌株M5 16S rRNA 基因系统发育分析Fig.5 The phylogenetic analysis of M5 16S rRNA genes
3 讨论
嗜热菌为高温大曲中的优势菌属,包括芽孢杆菌属(Bacillussp. )和高温放线菌属(Thermoactinomycessp. )等[5-6]。嗜热芽孢菌可在高温环境中产生蛋白酶以增加游离氨基酸的含量,为美拉德反应提供充足的前提物质[4],从而有利于形成白酒中各种风味物质。研究发现在细菌麸曲的培养过程中,地衣芽孢杆菌所产的中性蛋白酶可以辅助河内白曲等霉菌产的酸性蛋白酶对原料中的复杂蛋白质进行降解,对于提高芝麻香型白酒的出酒率和品质具有重要的意义[14]。此外,有研究指出,将枯草芽孢杆菌制作成麸曲应用于白酒生产,可以增加白酒中吡嗪类化合物含量,有助于赋予白酒良好的酱香和芝麻香风味[15],嗜热芽孢菌对于揭示白酒中香味物质的形成机制,提高优质酒率有重要意义。高温放线菌属菌种由于其形态学特征最初被归为放线菌类,但是近年来系统发育分析已将其归入芽孢杆菌目(Bacillales)、高温放线菌科(Thermoactinomycetaceae)[16]。徐泽江[6]利用变性梯度凝胶电泳(DGGE)技术对芝麻香型白酒高温大曲细菌群落结构进行研究,发现高温放线菌属菌种为高温大曲中的优势菌属,与姚粟等[17]利用16S rDNA克隆文库技术对芝麻香型白酒高温大曲细菌群落结构研究的结果一致。刘洋[18]等通过可培养方法从芝麻香型白酒高温大曲中分离获得高温放线菌ZM60,经多相分类鉴定为普通高温放线菌(Thermoactinomyces vulgaris)。高温放线属菌种在芝麻香型白酒酿造及香味成分形成过程中发挥的作用有待于进一步研究。
本研究筛选出的嗜热细菌M5 蛋白酶活力较高,从55℃下分离,且在50℃下生长良好,经分子生物学方法鉴定该菌株为枯草芽孢杆菌枯草亚种(Bacillus subtilissubsp.Subtilis)。枯草芽孢杆菌因其能够产生蛋白酶、α-淀粉酶、纤维素酶、β-葡聚糖酶、植酸酶、果胶酶、木聚糖酶等特点,已被广泛应用于各类食品生产中[19]。有研究者从枯草芽孢杆菌代谢产物谱中检测到一定浓度的乙偶姻、四甲基吡嗪、三甲基吡嗪、2,3,5-三甲基-6-乙基吡嗪、2,3-丁二酮、2,3-丁二醇、乙醇和乙酸乙酯等挥发性物质以及乳酸和乙酸等有机酸[20],这些代谢产物均为白酒中风味前体物质或风味物质,对白酒香气有重要贡献。大多数枯草芽孢杆菌在50℃的高温环境中不能生长或生长不良[21],而本研究分离得到的这株枯草芽孢杆菌枯草亚种在50℃下生长良好,产酶能力较强。后续研究可将以分离得到的Bacillus subtilissubsp.subtilisM5 菌株作为出发菌株,对其产酶产香机理进行研究,并进一步将该菌种应用于白酒生产过程中,以期提高和稳定芝麻香型白酒的产量和酒质。
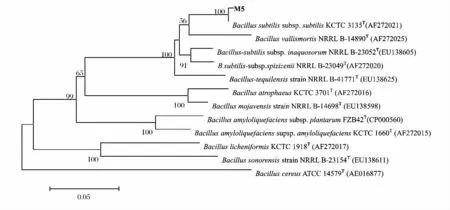
图6 菌株M5 gyrA 基因系统发育分析Fig.6 The phylogenetic analysis of M5 gyrA genes
[1] 王海平,来安贵,赵德义. 芝麻香型白酒的发展[J]. 酿酒科技,2006,147(9):104 -107.
[2] 信春晖. 芝麻香酒典型风格的形成[J]. 酿酒科技,2006(6):104 -105.
[3] 信春晖. 扳倒井复粮芝麻香型白酒生产工艺的特点[J]. 酿酒科技,2010,189(3):65 -66.
[4] 曹建全,刘建波,薛德峰. 芝麻香型白酒细菌曲研制[J]. 酿酒,2010,37(6):35 -38.
[5] 施安辉,李丽莉,卞建平. 徐坊芝麻香型酒专用大曲中主要微生物的分布、优势菌种的鉴定及代谢产物的初步分析[J]. 山东食品发酵,2010,156(1):8 -10.
[6] 徐泽江. 芝麻香型白酒酿造微生物多样性研究[D].浙江理工大学,2012:44 -46.
[7] 杜连祥. 工业微生物学实验技术[M]. 天津:科学技术出版社,1992:123.
[8] 胡喜巧,李兰,蒋爱凤. 米曲霉产中性蛋白酶提取与粗酶性质研究[J]. 河南科技学院学报,2011,39(2):43 -48.
[9] GB23527 -2009 ICS67.220.22 X69 -2009,蛋白酶制剂[S].
[10] Yang Liu,Lin Liu,Fubin Qiu,et al.Paenibacillus hunanensissp.nov.,isolated from rice seeds[J]. International Journal of Systematic and Evolutionary Microbiology,2010,60:1266 -1270.
[11] Chun J,Lee J H,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J]. Int J Syst Evol Micr,2007,57:2 259 -2 261.
[12] Jongsik Chun,Kyung Sook Bae.Phylogenetic analysis of Bacillus subtilis and related taxa based on partialgyrA gene sequences[J]. Antonie van Leeuwenhoek,2000,78(2):123 -127.
[13] Kim D Pruitt,Donna R Maglott.RefSeq and LocusLink:NCBI gene-centered resources[J]. Nucleic Acids Research,2000,29(1):137 -140.
[14] 袁超,崔乐芳,王瑞明. 地衣芽孢杆菌在麸曲中产中性蛋白酶发酵工艺条件的研究[J]. 酿酒科技,2011,201(3):40 -42.
[15] 施小明,徐岩,崔凤元,等. 枯草芽孢杆菌在白酒生产中的应用[J]. 酿酒科技,2012,212(2):49 -53.
[16] 张燕新,吴莹,张迹. 高温放线菌分类的研究进展[J]. 微生物学杂志,2007,27(1):64 -68.
[17] 姚粟,葛媛媛,李辉,等. 利用非培养技术研究芝麻香型白酒高温大曲的细菌群落多样性[J]. 食品发酵与工业,2012,38(6):1 -6.
[18] 刘洋,赵婷,姚粟. 一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J]. 生物技术通报,2012(10):210 -216.
[19] 马明,杜金华. 枯草芽孢杆菌酶在工业生产中的应用[J]. 山东科学,2006,19(3):35 -37.
[20] 徐岩,吴群,范文来,等. 中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J]. 酿酒科技,2011,205(7):37 -40.
[21] 东秀珠,蔡妙英. 常见细菌鉴定手册[M]. 天津:科学技术出版社,2001:63.
