配合物[Cd(phen)2O2]的结构及其与脱氧核糖核酸(DNA)的相互作用
2013-10-30李梅瑜高恩军
张 董, 姚 泉, 李梅瑜, 高恩军
(1.沈阳化工大学应用化学学院,辽宁沈阳 110142;2.沈阳市无机分子基材料化学(国际)重点实验室,辽宁沈阳 110142)
自顺铂出现以来,人们己经合成出数千种铂化合物,并研究了它们的抗肿瘤性质.以细胞为理论依据的传统思路及工作方法正在受到冲击,抗癌(肿瘤)药物研究的范围正在大大扩展,非铂过渡金属抗癌(肿瘤)药物的研究正在逐渐成为一个研究热点.其中丰富多样的过渡金属配合物因其卓越的放射化学性质、光化学性质、生物化学性质吸引了众多的科学家投身到此类配合物的研究中.相关配合物的组成及结构更是丰富多彩,包括氨基酸配合物、杂环配合物、Schiff碱配合物、二茂金属配合物和双核配合物、含碳硼烷的配合物等经典和非经典的金属配合物.其中,以邻菲啰啉(l,10-phenanthroline,phen)为代表的多吡啶过渡金属配合物与DNA的作用已成为目前活跃的研究领域之一.本课题是构筑金属镉(Ⅱ)和1,10-菲啰啉的配合物,表征其结构,研究其生物活性及作用机理,为以后的工作提供一定的基础.
含有邻菲啰啉的二羧酸类配体能够完全或部分质子化,能提供多种配位方式.邻菲啰啉环既含有N配位原子,又有一定的刚性,能够促进晶体的形成,羧基在限定的范围旋转,能从不同方向与金属离子配位.镉与1,10-菲啰啉所形成的二元或三元配合物在结构与性质上也有研究[1].因此,为进一步探索此类化合物的生物活性,本文合成了一个单核镉(Ⅱ)的1,10-菲啰啉配合物,并对它们与DNA的作用方式进行了初步探索.
1 实验部分
1.1 实验试剂及仪器
1,10-菲啰啉、硝酸镉均为分析纯;HC-DNA从本实验室培养的 HeLa细胞提取;pBR322-DNA为生化试剂.
X-射线单晶衍射仪,Bruck smart 1000 CCD;红外光谱仪,Nicolet FT-IR 470;元素分析仪,Finnigan EA 1112;磁力搅拌器,D-MS-I;精密数显酸度计,PHS-3C;电子分析天平,AR2140;复合电极,E-201-C pH;日立23010荧光光谱仪、上海JS380A自动凝胶图像分析仪.
1.2 配合物的合成
称取1,10-菲啰啉和 Cd(NO3)2·3H2O 一定量,各用10 mL蒸馏水溶解,用KOH调节pH值到接近中性后搅拌,在搅拌条件下反应2 h,溶液过滤,得到无色透明液体,室温下静置3周后有无色粒状晶体析出,得到固体配合物.
1.3 配合物的红外光谱数据
σ,cm-1:3 425(m),3 051(w);1 578(w),1 622(w);1 384(s),1 291(m);1 142(m),1 102(m),1 034(m);849(m),729(s).
1.4 配合物的结构
配合物晶体结构中主要的键长(nm)如下:Cd(1)—N(4):2.409(7);Cd(1)—N(2):2.461(8);Cd(1)—N(1):2.429(8);Cd(1)—O(3):2.507(3);Cd(1)—N(3):2.489(10);Cd(1)—O(1):2.527(3).
配合物晶体结构中主要的键角(°)如下:N(4)—Cd(1)—N(2):88.6(2);N(4)—Cd(1)—N(1):154.8(3);N(2)—Cd(1)—N(1):67.9(3);N(4)—Cd(1)—O(3):106.13(18);N(2)—Cd(1)—O(3):156.8(2);N(1)—Cd(1)—O(3):93.86(19);N(4)—Cd(1)—N(3):67.6(3);N(2)—Cd(1)—N(3):81.7(3);N(1)—Cd(1)—N(3):98.9(3);O(3)—Cd(1)—N(3):87.40(19);N(4)—Cd(1)—O(1):90.11(18);N(2)—Cd(1)—O(1):91.5(2);N(1)—Cd(1)—O(1):99.1(2);O(3)—Cd(1)—O(1):105.98(11);N(3)—Cd(1)—O(1):156.7(2).
其他晶体数据:F(000)=1 750;R(int)=0.018 2;Z=25;-11≤h≤10,-16≤k≤18,-18≤l≤17;R1=0.109 9,wR2=0.390 5(I>2σ(I);R1=0.1145,wR2=0.402 0(所有数据).
通过X-射线衍射数据分析其分子结构可得该配合物的基本结构,如图1所示.由图1可以看出,配合物以镉离子为配位中心,展示了一个扭曲的八面体构型.在分子结构中,N1、N2、N4、O3处于扭曲八面体的赤道平面上,而N3和O1则分布在赤道平面两端的轴向位置且不为一条直线,N3—Cd1—O1 角度为 156.708(223)°,有较大程度的扭曲.而赤道位置的4个配位原子Cd1、N1、N2、N4、O3 几乎在同一平面上,O3—Cd1—N4为 106.102(184)°、N4—Cd1—N2 为 88.640(268)°、N2—Cd1—N1 为 67.887(276)°、N1—Cd1—O3 为93.869(190)°,和约为356.499°.在配合物Cd-1,10-菲啰啉中,以Cd1为中心离子的结构之间由于1,10-菲啰啉芳香环之间存在π-π堆积弱作用,这种作用是由π键的负静电势与阳离子间发生的非共价相互作用,具有相当的强度,它不等同于氢键,在生物体系中起很大的作用.芳环中心原子间距离为0.361 9 nm,均符合π-π堆积弱作用范围,从而形成一维链状结构,其一维链状结构如图2所示.
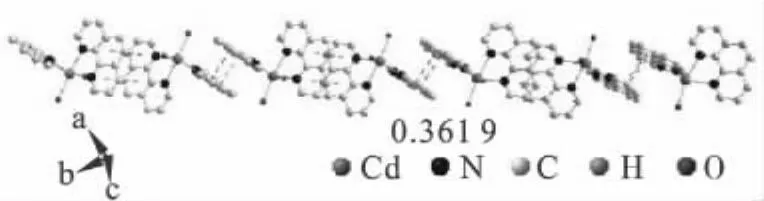
图2 配合物的一维结构Fig.2 One-dimensional net structure of the complex
一维分子链之间存在氢键和C—H…π键弱作用,键长分别为0.266 6 nm和0.281 5 nm.氢键和C—H…π键弱作用的存在从而把一维链状结构相互连接起来形成二维网状结构如图3所示.由于分子间存在π-π堆积弱作用,氢键作用和C—H…π键弱作用,分子间堆积构成了三维立体网状结构如图4所示.
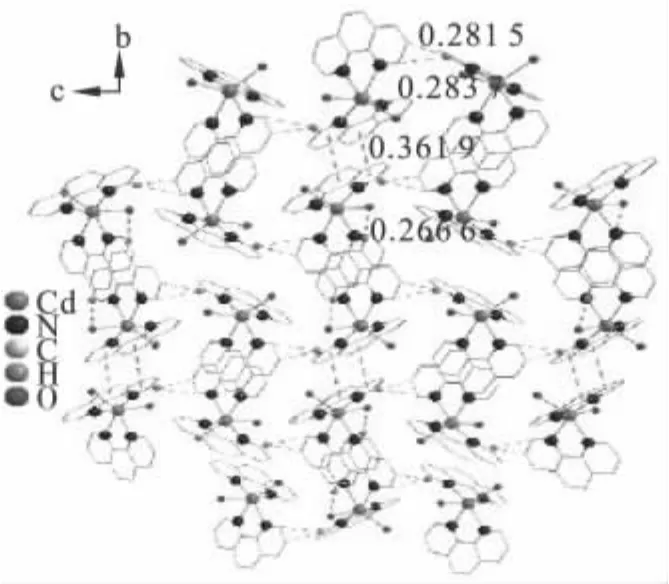
图3 配合物的二维氢键作用和π-π堆积弱作用Fig.3 The 2D network of the complex constructed through hydrogen bonds
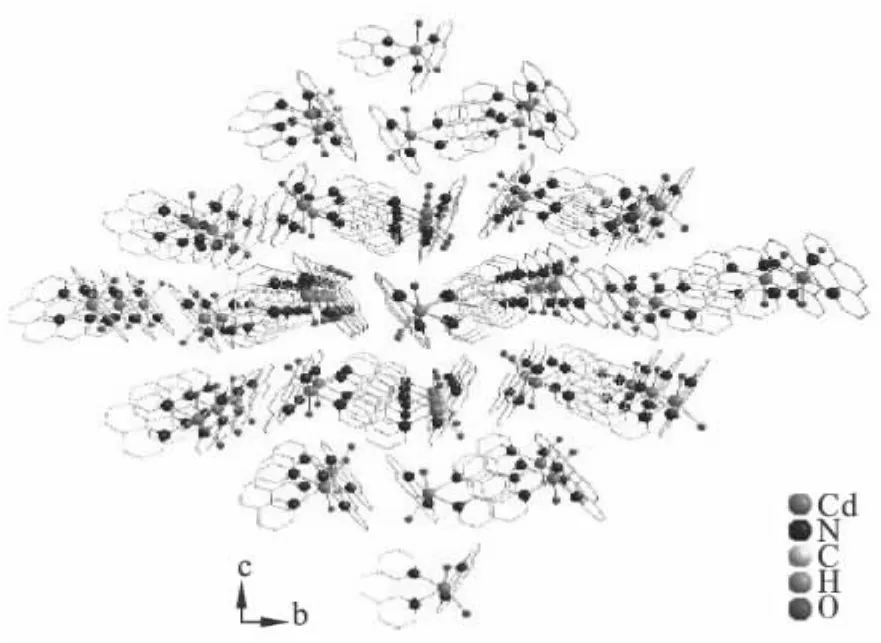
图4 配合物三维结构Fig.4 Three-dimensional structure of complex
1.5 配合物与HC-DNA作用的荧光光谱测定
溴化乙锭(EtBr)是一种荧光染料,具有共轭芳香环的平面分子,这种共轭扁平分子可以平行地嵌入DNA双链的配对碱基对之间,形成堆积.EtBr本身具有较弱的荧光,而DNA分子没有荧光,当EtBr插入DNA分子之后,EtBr分子好像平行地“固定”在DNA分子内部,从而使EtBr分子平面刚性增加,碰撞淬灭减小,荧光显著增强.EtBr只能插入双螺旋DNA分子中,而不能插入单链DNA中.DNA/EtBr复合物中,EtBr发出的荧光比游离的EtBr本身发射的荧光强度大10倍[2].当EtBr从双螺旋中游离出来或双螺旋结构减少时,荧光就会显著降低.所以当有其他也能嵌入DNA碱基之间的分子存在时,将会与Et-Br竞争DNA,EtBr将被从 DNA/EtBr复合物中挤出,而DNA/EtBr体系的荧光产生猝灭,因而EtBr可作为DNA结构的荧光探针[3].根据经典斯特恩公式[4]:I0/I=1+Ksqr,其中:I,I0分别代表配合物/EtBr/DNA复合物中存在和不存在配合物时复合物的荧光强度,Ksq表示斯特恩淬灭常数,定性描述配合物与DNA的作用强弱,r为复合物中配合物与DNA的浓度比.
从图5可看出配合物对DNA-EtBr体系荧光强度的影响,DNA-EtBr复合物的荧光发射峰处于617 nm处;随配合物浓度的增加,DNA-Et-Br复合物体系的荧光强度均逐渐减弱,且发生不同程度的淬灭,并且浓度越大,荧光猝灭逐渐趋于平衡.当配合物的浓度逐渐增加到最大时,配合物把DNA-EtBr复合物体系的荧光强度由96.42淬灭到78.94,下降幅度为17.48,这些现象说明配合物与DNA发生了插入作用.
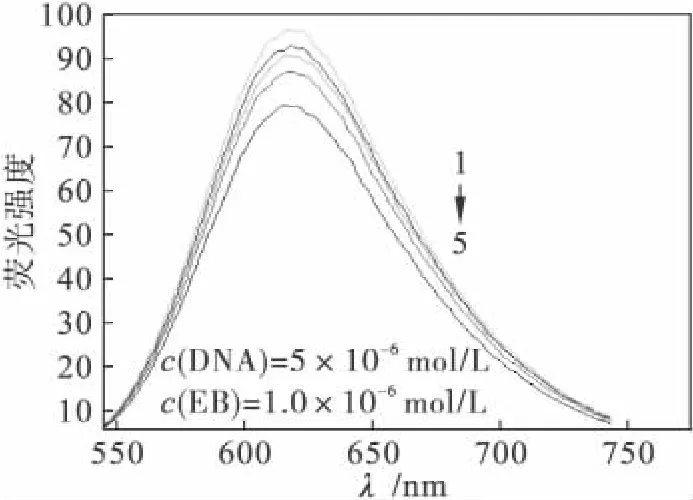
图5 配合物与DNA作用的荧光图Fig.5 Fluorescence spectra binding to DNA of complex
从图6可以看出配合物的淬灭常数Ksq=0.103,对HC-DNA具有一定的插入能力.
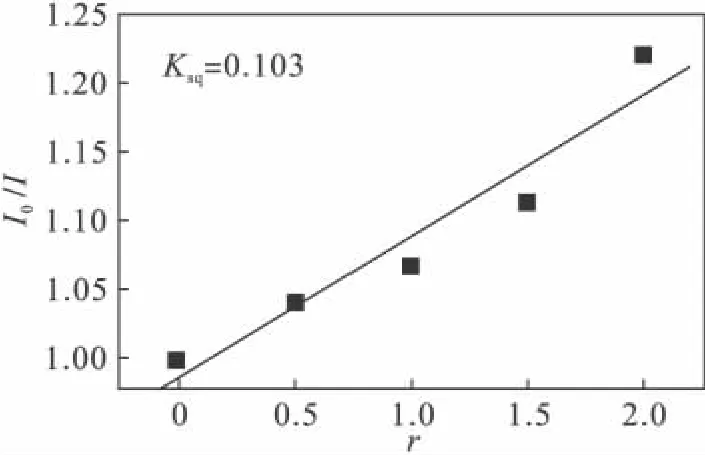
图6 配合物的猝灭常数Fig.6 Stern-volmer quenching plot of the complex with the value of the slope
1.6 凝胶电泳法研究镉配合物对pBR322-DNA的切割作用
在外电场作用下,带电颗粒如不处于等电状态的蛋白分子,将向着与其相反的电极移动,这种现象称为电泳.核酸DNA在一定的pH值下带有负电荷,在电场中向正电极移动.电泳时,样品在电槽中外电场的作用下发生移动,超螺旋带(FormⅠ)相对分子质量较小,在电场的作用下迁移速率较大,开环带(FormⅡ)次之.实验中,随着配合物浓度增加,FormⅠ解旋慢慢转化为FormⅡ,同时DNA会发生一定降解[5-6].以琼脂糖为支持介质的凝胶电泳是测定金属配合物对DNA发生切割或嵌入、解旋作用的重要实验方法,为DNA分子及其片段的相对分子质量测定和DNA分子构象的分析提供了重要手段,广泛应用于分子生物学领域,是定量、分离、鉴定和纯化DNA片段的主要方法[7].
凝胶电泳经常使用的核酸有pBR322质粒DNA[8-9],PUC18 质 粒 DNA[10],PUC19 质 粒DNA[11]和 K562 细胞 DNA[12],其中 pBR322 质粒DNA是电泳过程中用得最普遍的核酸,它是细菌质粒DNA,呈共价闭环状超螺旋DNA状态,长度为4 363 bp,相对分子质量2.88×106.当超螺旋型(ccc)DNA的一条链上出现一个缺口(nick)时,超螺旋结构解开,形成开环型(oc)[13].若2条链在同一位置均发生断裂时,则变为线形分子(linear).另外,某些能插入DNA双螺旋碱基对之间的试剂如EtBr、放线菌素D可以改变DNA的超螺旋状态,使负超螺旋减少,以至完全松开形成 oc甚至形成正超螺旋[13-14].
图7是配合物对pBR322-DNA断裂实验结果.Lane 0是纯的pBR322-DNA,Lane 1~3为配合物(浓度分别为:13.2,6.6,3.3 mol/L)与DNA在有氧条件下反应2 h的电泳图像.根据琼脂糖凝胶电泳原理FormⅠ与配合物作用发生解旋逐渐转化为FormⅡ,从图7可以看出,随着化合物浓度的增加,FormⅠ在逐渐减少.此现象表明这些配合物对细胞DNA具有切割能力,使DNA大分子发生降解.但配合物在不同浓度下FormⅠ解旋转化为FormⅡ的量不一样,根据活性越大,FormⅠ解旋转化为FormⅡ的量越多的凝胶电泳原理[15-16],可以看出配合物的活性较大,这与荧光光谱测定结果一致.
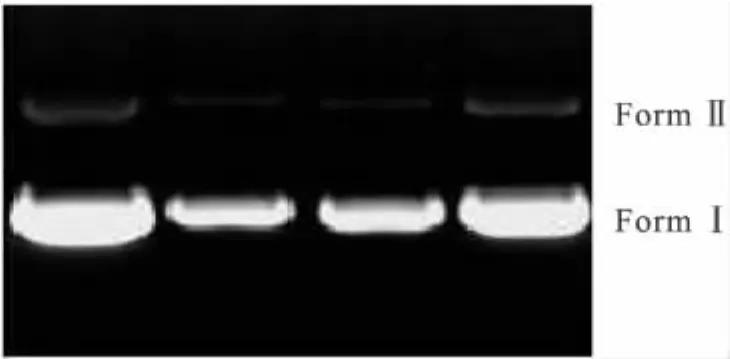
图7 配合物对pBR322-DNA的切割电泳图Fig.7 Photoactivated cleavage of pBR322-DNA for complex
2 结论
(1)采用常温法合成镉(Ⅱ)与1,10-菲啰啉的配合物.其分子形式为[Cd(phen)2O2],其中phen为1,10-菲啰啉.通过元素分析、红外光谱两种手段对配合物进行了表征,表明合成的配合物为预期目标产物.
(2)用X-射线单晶衍射技术测定配合物单晶的晶体结构.在镉(Ⅱ)配合物晶体结构中,中心离子Cd(Ⅱ)采取六配位模式,与4个N原子(来自2个1,10-菲啰啉)和2个O原子配位,形成扭曲的八面体结构.相邻的2个1,10-菲啰啉芳环之间存在π-π堆积作用,形成一维链状结构,同时在配合物中氧和相邻的1,10-菲啰啉芳环之间还存在氢键作用与C—H…π键作用形成二维层状结构,在层与层之间的弱作用下配合物又形成了三维网状结构.这不但使其结构更加新颖,而且增添了更多性质和功能.
(3)配合物与DNA作用的荧光光谱研究表明:DNA/EtBr复合物中加入配合物后,会发生荧光猝灭现象,而且浓度越大猝灭现象越明显,这说明配合物能与溴化乙锭竞争插入DNA碱基对中.
(4)配合物电泳实验表明:配合物对pBR322-DNA具有一定的切割能力,这与荧光光谱测定的结论一致.
[1] 刘祁涛,高恩君,李涵.某些铅(Ⅱ)、镉(Ⅲ)的三元配合物中的直线自由能关系[J].辽宁大学学报:自然科学版,1992,19(3):1-3.
[2] Lepecq J B,Paoletti C.A Fluorescent Complex between Ethidium Bromide and Nucleic Acids:Physical—Chemical Characterization[J].Journal of Molecular Biology,1967,27(1):87-106.
[3] Chao H,Mei W J,Huang Q W,et al.DNA Binding Studies of Ruthenium(Ⅱ)Complexes Containing Asymmetric Tridentate Ligands[J].Journal of Inorganic Biochemistry,2002,92(3/4):165-170.
[4] Holder A A,Swavey S,Brewer K J.Design Aspects for the Development of Mixed-metal Supramolecular Complexes Capable of Visible Light Induced Photocleavage of DNA[J].Inorganic Chemistry,2004,43(1):303-308.
[5] Wang X L,Chao H,Li H,et al.DNA Interactions of Cobalt(Ⅲ)Mixed-polypyridyl Complexes Containing Asymmetric Ligands[J].Journal of Inorganic Biochemistry,2004,98(6):1143-1150.
[6] Farinas E T,Tan J D,Mascharak P K.Photoinduced DNA Cleavage Reactions by Designed Analogues of Co(Ⅲ)-Bleomycin:the Metalated Core Is the Primary Determinant of Sequence Specificity[J].Inorganic Chemistry,1996,35(9):2637-2643.
[7] 何忠效,张树政.电泳[M].北京:科学出版社,1999:161-163.
[8] Ichikawa K,Tarnai M,Uddin M K,et al.Hydrolysis of Natural and Artificial Phosphoesters Using Znic Model Compound with a Histidine-containing Pseudopeptide[J].Journal of Inorganic Biochemistry,2002,91(3):437-450.
[9] Lutterman D A,Fu P K L,Turro C.Cis-[Rh2(μ-O2CCH3)2(CH3CN)6]2+as a Photoactivated Cisplatin Analog[J].J.Am.Chem.Soc.,2006,128(3):738-739.
[10] Moreno R G,Alipázaga M V,Gomes O F,et al.DNA Damage and 2'-deoxyguanosine Oxidation Induced by S(Ⅳ)Autoxidation Catalyzed by Copper(Ⅱ)Tetraglycine Complexes:Synergistic Effect of a Second Metal Ion[J].Journal of Inorganic Biochemistry,2007,101(5):866-875.
[11] Belicchi F M,Bisceglie F,Gasparri F G,et al.Synthesis,Characterization and Biological Activity of Two New Polymeric Copper(Ⅱ)Complexes with α-ketoglutaric Acid Thiosemicarbazone[J].Journal of Inorganic Biochemistry,2002,89(1/2):36-44.
[12] Tusek-Bozic L,Furlani A,Scarcia V,et al.Spectroscopic and Biological Properties of Palladium(Ⅱ)Complexes ofEthyl 2-quinolylmethylphosphonate[J].Journal of Inorganic Biochemistry,1998,72(3/4):201-205.
[13]桑瑞丽.联咪哇类配体配合物的合成、表征及其切割DNA活性研究[D].太原:山西大学,2003:215-218.
[14]袁彩霞.DNA断裂剂的合成、与识别基寡聚脱氧核苷酸的偶联及其作用机理[D].太原:山西大学2004.
[15]王得宝,祁国荣.核酸:上册[M].北京:科学出版社,1987:55.
[16] Wong E,Giandomenico C M.Current Status of Platinum-based Antitumor Drugs[J].Chemical Reviews,1999,99(9):2451-2466.
