界面核和高级发声中枢与鸣禽鸣曲的学习和维持
2013-10-28李东风刘少艺
李东风, 冯 理, 刘少艺, 张 萌
(华南师范大学生命科学学院,广东广州 510631)
界面核和高级发声中枢与鸣禽鸣曲的学习和维持
李东风*, 冯 理**, 刘少艺, 张 萌
(华南师范大学生命科学学院,广东广州 510631)
鸣禽鸣唱和人类语言都是经过后天学习而获得的.幼鸟在学习鸣唱时先记住教习曲模板,再通过发声反馈比较自鸣曲和模板并调整发声输出,成年后同样需要听觉反馈来维持自鸣曲的特征和稳定.因此,鸣禽听觉系统和运动系统对刺激的感觉运动整合非常重要.近年研究发现,感觉期幼鸟编码并记忆模板的过程需要NIf-HVC投射的参与;这一突触联系与维持成年鸣禽可塑性鸣曲空间特征和鸣曲节律至关重要.其中,NMDAR、AchR和NE可能参与调节NIf-HVC突触的效能.HVC类似于人类的Broca’s Area,而NIf类似于人类的Spt区,因此研究NIf-HVC突触在神经环路中的作用有助于揭示人类这2个脑区在语言形成中潜在的功能,有利于探索发声过程相关的感觉运动信息整合的机制.
鸣唱学习; 听觉反馈; NIf; HVC; 感觉运动信息整合
与人类语言相似,鸣禽鸣唱是一种复杂的习得性行为,通过教习完成.在发育期,鸣禽幼鸟通过听觉反馈(auditory feedback)评价并调整发声输出的运动模式,练习自鸣曲(Birds own songs, BOS)以匹配感觉期记住的教习曲模板(template)[1].成年后,雄鸟仍需要听觉反馈维持定型鸣曲(crystallized song)空间和时间的结构特征.有人认为鸣曲维持是鸣曲学习的延伸[2],因为这2个阶段都是通过听觉反馈使BOS匹配于内化的鸣曲模板.所以鸣禽是一种研究感觉运动信息整合机制的重要模型,这种机制与人类的语言学习密切相关.
鸣唱的学习和维持依赖于鸣唱系统(song system)和听觉系统(auditory system)的活动.鸣禽鸣曲的产生由一些感觉运动核团所控制,这些核团称为鸣唱系统.有2条主要的通路:发声运动通路(vocal motor pathway, VMP)和前端脑通路(anterior forebrain pathway, AFP).发声运动通路起源于高级发声中枢(high vocal center, HVC),投射至前运动核团弓状皮质栎核(robust nucleus of the arcopallium, RA), 换元后再投射至脑干的呼吸和发声运动核团.前端脑通路也由HVC发出,由基底核-丘脑-皮质环路组成,与HVC-RA汇合.发声运动通路主要负责鸣曲的产生,前端脑通路与幼鸟鸣唱的感觉运动学习以及成鸟鸣曲的可塑性相关[3].鸣禽中的听觉系统主要包括与哺乳类听皮质同源的L区(Field L complex,Field L)、巢状皮质尾内侧区(caudomedial nidopallium, NCM,相当于人脑Wernicke’s Area)和旧皮质尾部(caudal mesopallium, CM)等结构[4].鸣唱系统和听觉系统之间的联系相对有限,大多数听觉核团投射至HVC周围的HVC壳(HVC shelf)和RA周围的杯区(RA cup),只有界面核(Nucleus Interfacialis nidopallii, NIf)能把来自丘脑葡萄形核 (uvaeformis, Uva)的听觉和感觉信息直接上传至HVC(图1).因此,NIf-HVC突触联系是听觉信息直接传递至HVC的最主要来源,其功能研究成为热点.有研究表明,NIf可明显影响HVC自身的神经活动[5],是正常鸣唱产生所必需的,同时NIf-HVC投射与幼鸟模板记忆和成鸟鸣曲维持有关,表明该突触联系在鸣禽鸣唱中发挥重要作用.了解NIf-HVC的功能有助于探讨鸣唱系统和听觉系统对信息的整合作用.
传统观点认为,鸣禽感觉期模板形成和储存的位点可能是某个听觉核团或整个听觉通路.CLAYTON等[6]检测20~30 d斑胸草雀NCM中与长时记忆相关的Zenk蛋白表达,与感觉模板获得的时期相一致,推测NCM可能是模板储存的位点.HELEKAR等[7]也有相同的结论,同时发现NCM对教习曲听觉刺激有特异性反应.而BOLHUIS等[8-9]认为鸣禽和鹦鹉NCM和旧皮层尾中部区(caudomedial mesopallium, CMM)参与处理有关鸣曲的感觉信息,这2个核团可能是模板记忆的存储位点,而且成年斑胸草雀NCM是否激活和鸣唱学习的质量相关.

图1 鸣禽的鸣唱通路和听觉通路[10]
1 运动核团HVC参与教习曲模板记忆
近期研究发现,HVC的功能可受到听觉信息的影响.树突棘是脊椎动物脑中兴奋性突触传递的主要位点,突触效能的增强伴随树突棘稳定性、数目和直径等形态的变化.2010年,MOONEY等[11]将雄性斑胸草雀幼鸟从孵化后就一直隔离于亲鸟教习曲直至感觉运动学习期,然后使用扫描双光子显微镜(Scanning Two-Photon Microscope)观察这些隔离的幼鸟首次教习前后HVC投射神经元树突棘形态的变化,发现教习经历中的听觉信息可迅速稳定high-turnover组(HT组,turnover=100 (Nspine gained+Nspine loss)/2Nspine total)幼鸟中HVC树突棘,使其密度增加、体积增大.同时电生理研究表明,教习后HVC的自发突触活动增强.相反,手术摘除成年雄鸟双侧耳蜗后,发现致聋后HVC投射至X区的神经元(HVCX)树突棘直径变小,同时树突棘形态不稳定,这不利于突触之间信息的传递.对HVCX神经元进行全细胞膜片钳记录表明,虽然致聋后HVCX神经元自发的去极化突触后电位(spontaneous depolarizing postsynaptic potentials, dPSPs)和自发动作电位的平均频率没有显著影响,但dPSPs的幅度降低,同时峰间距(inter-spike intervals, ISIs)时程缩短,表明听觉隔离可降低HVCX神经元自发突触活动的幅度,选择性弱化HVC支配AFP中的突触,而此环路是听觉依赖的发声可塑性所必需的.行为学研究发现,致聋降低了鸣曲的熵值,表明鸣曲退化[12].因此,听觉信息(教习曲刺激或听觉隔离)可以诱导HVC结构和功能的变化,从而改变HVC传递至下游核团的信息,最终影响鸣曲的特征.这暗示HVC可能参与对听觉信息的处理和加工过程.那么,作为听觉信息与鸣唱运动信息整合的主要位点,HVC在幼鸟感觉期,即模板的形成时期中是否发挥重要作用呢?HVC是否对教习曲有特异性反应并参与编码记忆模板呢?
研究者以往只关注HVC对亲鸟教习曲听觉刺激的反应,然而幼年斑胸草雀在教习期间不仅能听到教习曲,还会听到BOS或其它声音.如果单纯用药物阻断HVC活动,则不清楚获得的实验结果是由于发声运动通路的变化引起还是对教习曲或自鸣曲等听觉反应所引起.为了检测HVC是否参与编码教习曲模板,MOONEY等[13]采用光遗传技术(optogenetics technology)对HVC核团进行精确调控,先将一种对光敏感的阳离子通道蛋白(human channelrhodopsin-2, hChR2)转染至HVC,利用不同频率的光抑制HVC核团中光敏感蛋白的活性,从而实现控制HVC的活动.这种技术能准确可靠地控制毫秒级别的神经活动,调节兴奋性和抑制性突触传递,具有空间上的特异性和时间上的精确性[14].在幼鸟听到教习曲时给特定频率的光刺激抑制幼鸟HVC的活动,而不在其它时间干扰HVC功能.幼鸟只在实验期间才接触到教习曲,实验结束后隔离处理,直至幼鸟成年(>90 d).检测成年后鸣曲与教习曲的相似度发现,实验组教习过程中抑制HVC的幼鸟,成年后的鸣曲与教习曲差异明显,而与从未教习过的隔离组幼鸟成年后鸣曲的相似性水平相当(图2A).此实验说明,HVC受到干扰的幼鸟没有记住鸣唱模板,表明HVC在感觉期参与教习曲模板的编码.
为了更加精确地证明HVC参与感觉期模板的编码,MOONEY等[13]改进了实验,将幼鸟 (感觉期,43~53 d)双侧HVC植入微电极,教习期间软件识别某个特定音节(syllable c)出现时触发电刺激抑制HVC的活动,实验结束后再将幼鸟隔离处理,检测幼鸟成年后鸣曲c音节与教习曲c音节的相似程度.这些微刺激干扰的鸟无法复制教习曲中的音节c,但是可准确学会前一个和后一个音节(图2B).与光遗传学实验结果相一致,这些幼鸟在教习时因为HVC的活动受到干扰没有记住这些音节或鸣曲,推测可能是由于感觉期相应模板的编码受到影响,因此推测运动核团HVC参与编码教习曲的听觉信息,是幼鸟模板形成过程中所必需的.

(A)使用光遗传学技术干扰感觉期教习中的幼鸟HVC活动可影响幼鸟对教习曲的复制.灰色为实验组;黑色表示对照组;灰色填充菱形代表一直从未受到教习的隔离组幼鸟;黑色填充菱形代表教习时一直没有接触到光遗传学实验中教习者的幼鸟,以排除社会情景对实验的影响. (B)在鸣曲中特定音节c出现时微刺激抑制HVC活动的幼鸟成年后无法复制音节c.
图2 干扰感觉期教习时,幼鸟HVC的神经活动可影响鸣曲的复制[13]
Figure 2 Disruption of neural activity in the pupil’s HVC during tutoring impairs copying[13]
2 NIf-HVC突触联系与教习曲模板的形成
NIf是输入至HVC的主要听觉核团.为了验证NIf在感觉期是否影响幼鸟模板的编码,MOONEY等[13]在首次教习前,将斑胸草雀隔离至36~47 d,损伤双侧NIf核团,教习结束后再隔离至成年(>90 d),比较幼鸟自鸣曲和教习曲的相似度.结果发现,损伤NIf可严重影响幼鸟对教习曲的模仿,同时NIf的损伤程度与自鸣曲和教习曲的相似度成反比.这暗示幼鸟感觉期教习曲的听觉信息可能通过NIf传入HVC.为了检测NIf损伤对教习曲记忆的影响,每天上午教习前向NIf注入河豚毒素(TTX)可逆性抑制NIf,教习后注入生理盐水,结果发现幼鸟鸣曲与教习曲的相似性下降,与对照组(教习前注入生理盐水,教习后注入TTX)呈极显著性差异,表明NIf失活严重干扰幼鸟对教习曲的记忆.这些发现表明,感觉期NIf输入至HVC的信息是编码教习曲模板所必不可少的.除了NIf外,听觉核团Field L可投射至HVC外围的HVC shelf[15].同样在教习前向幼鸟Field L注入TTX,发现这些抑制L区的幼鸟自鸣曲与教习曲仍有很高的相似性,与对照组(教习后注入TTX)无显著性差异,说明感觉期间听觉信息可能不是经过Field L输入鸣唱系统.这些实验表明了NIf-HVC突触联系在感觉期参与整合教习曲的记忆以及模板编码过程,暗示模板的形成可能是听觉系统和鸣唱系统对听觉信息共同整合、加工和编码的结果.
关于鸣禽幼鸟在感觉期对模板的编码有2种假说.传统观点认为,教习曲听觉信息的编码只限于听觉环路,当幼鸟进行发声练习时,听觉系统将模板信息提取出来并传递至HVC,然后根据听觉反馈评价BOS的质量,通过AFP对BOS进行调整.而MOONEY[13]认为听觉模板的记忆很可能是听觉系统和鸣唱运动系统共同处理整合的结果,但是模板编码或储存的位点还不确定,可能2个系统同时参与模板的编码.传统意义上的模板只是听觉系统和发声运动通路对同一教习曲听觉信息共同编码整合后固定下来的一种神经发放模式.还有一种可能是听觉信息通过听觉系统传递至HVC,通过对听觉信息的加工再编码后才能储存到听觉通路,即运动系统起到了对听觉信息的筛选和门控(Gating)作用.
前文提到,HVC神经元的树突棘形态在首次教习前后会发生变化.在鼠的研究中,认为树突棘的形态变化与突触后N-甲基-D-天冬氨酸受体(N-Methyl-D-Aspartate Receptor, NMDAR)的活动有关[16].为了检测鸣禽幼鸟HVC树突棘在教习后增大是否依赖于NMDAR,MOONEY等[13]在幼鸟每天教习前向HVC注入NMDAR阻断剂APV,通过双光子成像技术观察每次教习后HVC神经元树突棘形态是否发生变化.结果发现,注入APV的教习组中HVC树突棘形态与教习前相比没有显著性变化,表明幼鸟感觉期教习曲听觉信息诱发的HVC树突棘的形态变化同样依赖于NMDAR,暗示HVC参与教习曲听觉信息的处理和模板的形成可能与NMDAR活动有关,推测如果阻断感觉期幼鸟HVC中NMDAR可能影响幼鸟对教习曲的记忆,而这一观点也在后续的实验中得到证实.每次教习前将APV注入隔离至感觉期的幼鸟(43~53 d)HVC,教习后注入生理盐水,实验连续5 d,结束后隔离直至成年.与对照组(教习前注入生理盐水且教习后注入APV)相比,实验组APV处理过的幼鸟成年后和教习曲的相似性降低.这些实验说明NIf-HVC在编码教习曲听觉记忆的过程与突触后NMDAR的活动相关.这一结论与之前在鼠中的研究是一致的[16],NMDAR参与介导突触可塑性,突触这种效能强弱的变化与动物的记忆有关.
NIf-HVC联系还可能受到去甲肾上腺素(noradrenaline,NE)的调节.已有实验表明,NE可影响鸣禽幼鸟NCM对教习曲的记忆和幼年家鸡视觉的铭记(imprinting)[17].免疫组织化学实验证明,NIf有酪氨酸羟化酶(TH)的表达,暗示NIf可能接受儿茶酚胺类神经递质的调节.SCHMIDT等将NE注入NIf后发现,NE对NIf和同侧HVC的自发活动和听觉反应有非常复杂的影响[18],出现一种门控现象[19].将低浓度NE(0.5 mmol/L或1 mmol/L)注入NIf可降低同侧HVC自发和诱发活动,但增强HVC对BOS的听觉反应.HVC这种对BOS的听觉反应只有实验动物被注入低剂量的安定(diazepam)后出现的镇静状态时才能检测到[20],现在认为镇静状态下的听觉反应与鸣禽发声学习有关.相反,高浓度(5 mmol/L) NE可抑制NIf和HVC的活动,同时抑制对BOS的听觉反应,向NIF注入8 mmol/L NE则完全观察不到同侧HVC对BOS的听觉反应.由此可见,NE参与调节NIf-HVC突触的效能,但这种门控对鸣禽鸣唱时NIf-HVC突触的影响以及在幼鸟感觉期时的作用还不清楚,需要进一步探讨NE对NIf-HVC突触的影响是否与感觉期幼鸟编码记忆听觉模板相关.
3 NIF-HVC与成鸟鸣曲的产生和维持
NIf接受来自CM,Uva的躯体感觉、视觉和听觉等方面信息,再传递至HVC.因此,NIf输入至鸣唱系统的信息是比较复杂的,在鸣禽鸣曲的产生和维持中有着极其重要的作用.
NIf可驱动HVC神经元的自发兴奋性活动[21].在体记录麻醉状态下鸣禽NIf和HVC细胞内活动表明,NIf的自发放领先于HVC (HVC神经元可分为3类:投射至RA的神经元HVCRA、中间神经元HVCINT和投射至X区的神经元HVCX)的兴奋性突触后电位(EPSPs),抑制或损毁NIf活动明显减弱了HVC对听觉刺激的反应并降低HVC神经元的自发放.将GABAA受体激动剂蝇蕈醇(muscimol)或Na+通道阻断剂利多卡因(lidocaine)注入到NIf后可引起HVC短暂的无发放现象,但HVCINT在NIf抑制后仍有发放.抑制CM可引起HVC对听觉刺激反应的消失,表明HVC也接受来自CM的听觉输入,尤其是CM中的Av核团[5].Av、NIf和HVC这3个核团形成了环路(图3),使听觉系统和鸣唱运动系统相互联系,成为感觉系统和运动系统相互影响的神经解剖基础之一.这一环路与鸣曲学习和产生相关[13,22].

图3 Uva和Av-NIf-HVC感觉运动环路之间的联系[23]
在睡眠或安静状态下,NIf可驱动HVC和RA的发放[23].在体电生理多单位记录(multi-recording)表明,NIf、HVC和RA三个核团的发放活动是相似的.与声谱学的研究相结合,表明NIf活动提前于鸣曲的输出并持续到整首鸣曲结束,同时在音节产生之前很短的时间内.整个音节活动强度最强,在音节间隔最弱.NIf和HVC都接受Uva的投射,Uva核团中有2种投射神经元:投射至NIf的UvaNIf和HVC的UvaHVC.睡眠中,UvaHVC神经元抑制HVCINT和RA活动,抑制RA对BOS的听觉反应,如果药物抑制Uva则提高HVCInt和RA神经元发放活动以及RA对BOS听觉反应,表明Uva可直接影响鸣唱运动通路的活动.而UvaNIf神经元通过NIf间接将兴奋性信息输入至HVCInt,UvaNIf电位发放先于HVCInt,抑制NIf则完全观察不到HVCInt的活动,表明Uva间接输入至HVC的信息受到NIf的调节,NIf可能增强UvaNIf的输入.因此,睡眠中NIf通过调节Uva输入至HVC的兴奋性投射,影响发声运动通路HVC和RA的活动.但这种调节活动受到实验动物行为状态的影响,如接受少量安定注射后的斑胸草雀受到感觉刺激而唤醒后,UvaHVC活动增强,RA不产生电位的发放[23].此时NIf和HVC对BOS的听觉反应也被抑制,SCHMIDT[17]认为感觉刺激可能使NE释放,抑制了HVC的听觉反应.为了证明此观点,将NE受体的阻断剂注入NIf后仍使用同样的刺激,在HVC则可记录到对BOS的听觉反应,表明NIf对运动通路的调节可受到NE的影响.这些实验在一定程度上揭示了感觉通路对运动通路信息输出的影响,说明感觉运动整合过程的复杂性和多元化.
在睡眠或麻醉状态下的鸣禽,对NIf和HVC进行在体电生理记录发现,这2个核团对BOS或其它听觉刺激有特异的反应.作为NIf的上级输入核团,CM中有些神经元对BOS有特异的听觉反应,但有些神经元却无此现象,这暗示对BOS强烈的特异性反应是NIf核团加工整合的结果.NIf对BOS或相似的鸣曲,如逆序自鸣曲(REV)和同种鸣曲都有听觉反应,但HVC仅对BOS有特异的听觉反应,而对非自鸣曲则无电位发放,暗示HVC对BOS的特异性反应也是HVC对输入信息进行再加工的结果.在清醒鸟,NIf和HVC对BOS的听觉反应弱于睡眠或麻醉状态的鸟,但鸣唱时没有观察到2个核团的听觉反应,说明NIf-HVC的听觉敏感性在鸣唱时被调控抑制,这种调控抑制可能发生在HVC,也可能是NIf的功能受到抑制.MARGOLIASH等[24]研究发现,阻断HVC中mAchR可抑制HVC和RA对听觉刺激的活动,但阻断nAChR只对HVC的反应有强烈的影响,对RA的听觉反应很弱甚至没有影响.提示HVC的听觉反应与AchR的作用相关.HAHNLOSER等[25]认为HVC直接受到Uva活动的影响.SCHMIDT[18]认为可能是NIf功能受到NE的调节而影响听觉反应,将α1受体和α2受体阻断剂注入NIf,即在没有NE发挥作用时,HVC和NIf的听觉反应完全被抑制.也有人认为听觉敏感性受到干扰也可能与Field L和CM功能变化有关[26].
在清醒状态下,NIf-HVC联系对鸣曲的维持也很重要.HAHNLOSER等[23]利用药物分别抑制不同年龄斑胸草雀(36~50 d(亚鸣曲)、51~83 d(可塑性鸣曲)和>100 d(定型鸣曲))的 NIf核团,发现NIf失活对亚鸣曲没有显著性影响,但是对可塑性鸣曲具有复杂的影响,引起可塑性鸣曲空间特征和鸣曲节律等方面的退化,趋向亚鸣曲,与损毁幼鸟HVC的结果一致,即没有改变亚鸣曲特征但引起可塑性鸣曲退化至亚鸣曲状态[27].由于NIf位于HVC上游并驱动其活动,这些实验结果表明,NIf不但是幼鸟记忆编码教习曲模板所必需的,也是幼鸟发声练习过程中必不可少的.损毁成鸟NIf引起音节顺序的变化,即中间motif出现的概率增大、偶然的音节丢失或谐波的去稳定化,但没有发现定型鸣曲特征的退化[28],这一结论与损毁成鸟HVC的结果不同,损毁成鸟HVC引起定型鸣曲退化至亚鸣曲时期[27].MOONEY等[29]的实验也证明损毁成年斑胸草雀NIf对鸣唱没有永久性损伤,对发声反馈也没有影响.鸣曲音节顺序的变化表明,NIf的兴奋性输入可能有助于固定HVC的发放特性,在成年斑胸草雀中,NIf功能缺失可能很快得到弥补,因此鸣曲的特征变化不大.斑胸草雀定型鸣曲只有一种主题(motif),而孟加拉雀的鸣曲有复杂的语法结构,由许多不同的短语(phrases)组成,每种短语由1个或多个音节以固定的顺序排列,因此每个短语都有一定的概率出现.与斑胸草雀相反,损伤孟加拉雀NIf对成年鸣曲的产生有复杂的影响.NIf损伤降低小概率短语出现的可能甚至消失,所以引起鸣曲可变性降低,音节顺序更加固化,这个实验提示,NIf可能影响鸣曲的高级语法结构,NIf信息的输入缺失引起HVC发出短语顺序更加稳定的鸣曲[24].斑胸草雀的鸣曲缺乏复杂高级的语法结构,因此NIf损伤对鸣曲的影响不明显.以上实验说明NIf对成鸟鸣曲的产生和维持具有重要作用.
4 发声学习模型
鸣禽的鸣唱学习和人类的语言学习都是模仿学习的特例.模仿学习中,大脑的运动系统必须学会产生合适的神经发放编码记忆教习曲模板.在传统模型中,鸣禽在 “比较区域C” 根据记忆中的教习曲模板通过听觉反馈评估自鸣曲的质量,根据这种比较的结果判断是否将增强或弱化的信号传递至运动通路突触以加强或减弱这种鸣唱行为,经过许多次这种比较的过程,幼鸟不断调整BOS直至鸣曲固化定型.在此过程中,皮质纹状体突触可能通过神经递质多巴胺(DA)对一些输入信号产生偏向并影响鸣曲的可塑性学习[30].但这种比较模型并没有阐述睡眠或安静状态下鸣禽一些核团的听觉反应在学习期中的意义.
实验表明,幼鸟在首次教习时,听觉刺激诱导RA的活动同当天幼鸟睡眠时再次听到同一教习曲引起的RA反应是一致的.基于听觉核团NIf和运动核团HVC和RA在睡眠、麻醉和安静等离线(off line)状态(相对于鸣唱或觉醒等on line状态)下听觉反应的研究,HAHNLOSER等[23]提出鸣唱学习的逆模型(Inverse model).感觉期形成的模板就是听觉神经元对教习曲听觉刺激产生的固定神经发放模式.逆模型认为感觉运动学习期,清醒鸟通过听觉反馈将听觉信息输入至运动系统,在突触水平上,听觉系统固定的神经发放改变运动通路中的神经元活动,最终影响鸣曲的输出;在睡眠离线状态,模板等固定的神经发放输入到运动系统中的神经元,改变这些神经元原来的发放模式,则表明鸣禽正在对BOS进行调整,主要特征是不依赖听觉反馈,可以在鸣禽刚刚结束鸣唱后或睡眠等非典型鸣唱学习的时候发生,并且使产生某种声音特征的发声运动神经元和对相同声学特征有反应的听觉神经元联系在一起.逆模型中,幼鸟在感觉期听到教习曲,储存听觉模板;在感觉运动学习期,幼鸟回忆起教习曲的听觉记忆,驱动运动神经元发放,形成教习曲的运动记忆,即听觉记忆驱动运动记忆的形成.这一阶段中的听觉反馈可能不用于提高BOS的质量,但与固定运动神经元的发放模式有关(图4).2种鸣唱学习模型的区别在于听觉反馈促进幼鸟学习的方式不同,也可认为逆模型是传统比较模型的延伸和拓展,对于感觉运动整合机制的研究具有重要的意义.
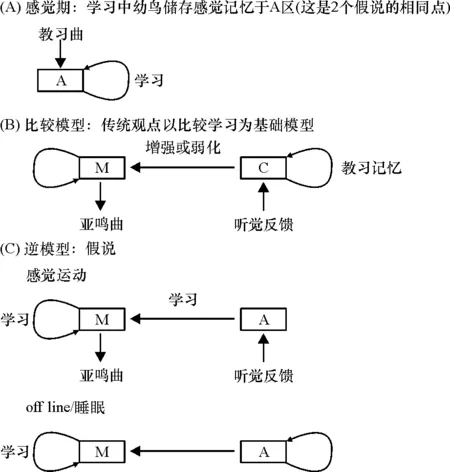
图4 感觉运动学习中的传统比较模型和逆模型[23]
5 鸟鸣与人言
鸣禽鸣唱和人类语言学习有许多相似处.第一,在发声学习过程中,幼鸟和人类婴儿都需要听觉反馈获得感觉模板并进行发声练习,最终形成固定的结构或语法,利于稳定鸣曲或语言的产生.从婴儿最初的听觉经历到幼儿最终对语言的掌握是需要2~3年时间的,一般认为与语言相关的大脑运动区域可能没有参与到听觉经历的编码过程,而仅仅与运动学习的最后阶段有关.而在鸣禽中,HVC参与听觉信息模板记忆编码的实验提示在语言学习的最初阶段人类婴儿的Broca区是否也发挥相应的重要作用呢?Broca区是否参与或协助语言方面记忆的储存呢?这些还都需要大量实验进一步探讨.第二,在神经环路功能的研究中,两者之间也有相互借鉴之处.鸣禽HVC类似于人类运动性语言中枢Broca’s Area[31],该区域在语言产生中与语音编码和音节划分有关,fMRI检测中发现言语产生时Broca’s Area处理的时间进程最长,在人类语言产生中具有重要作用[32].而鸣禽NIf与人类的Spt区(Sylvian parietal-temporal)有许多相似的特征.
一般来讲,人脑对语音信息的加工是将语音信息转换成语义的过程,即大脑的左右初级听觉皮质先解码识别听觉词汇,再经由左侧语言加工系统实现语义的通达和言语-运动的表征[32].左侧语言加工系统可分成2部分:腹侧通路,经由颞上沟(STS)并最终到达颞下回后部(pITL),包括部分颞中回(MTG)和颞下回(ITG)区域,负责语义加工;背侧通路从背后方投射到顶叶,并最终到达额叶言语产出中枢,因位于外侧裂(也称为西尔维亚沟)-顶叶-颞叶3个部分的交界处也称为Spt,是人类感觉性语言中枢Wernicke’s area的一部分,主要负责言语运动的表征[33].与鸣禽类似,运动表征的存在使婴儿没有经过言语运动的训练,仅仅通过接受外界语音的输入就学会了发音,同时成人也需要知觉自己的言语来对言语运动做出反馈,这对人类准确发音具有重要意义.因此,人类语言产生中必然存在听觉输入影响言语运动输出的整合过程,神经解剖学发现Spt可投射至Broca’s area,正如鸣禽中NIf投射至HVC,但Spt对Broca’s area的具体影响尚不清楚,两者之间功能上的联系在人类语言学习和产生中的功能需要进一步研究(图5).

图5 人脑中Broca’s area、Wernicke’s area和Spt area示意图[32]
第三,人类和鸣禽的语言中枢都发现了显著的侧别优势现象.人类婴儿接触到语言时大脑就表现出左侧优势,再者,出生2个半月婴儿的Wernicke’s area在言语感知时就能体现出记忆方面的左侧优势.幼年和成年斑胸草雀HVC神经元的激活对教习曲或不熟悉的鸣曲刺激都可表现出左侧优势,但同样类似于Wernicke’s area的NCM只对教习曲有左侧优势,目前还未有研究NIf是否具有侧别优势现象[31].本实验室曾致力于探讨斑胸草雀的侧别优势.LIAO等[34]断鸣管神经后发现斑胸草雀鸣曲开始去稳定化,其中断右侧对鸣曲影响较大,同时与人类基底核类似的X区中Zenk蛋白表达也存在右侧优势.这些实验结果说明了在侧别优势方面,鸣禽和人类具有高度的相似性,这也表明鸣禽可作为一种非常好的模式动物用以研究有关人类语言的相关问题.
脑与语言的关系一直是困惑科学界的核心问题之一.语言的复杂性和模式动物的缺乏使发声学习的研究受到了极大的限制.因此,鸣禽作为一种发声学习的模型,了解NIf-HVC突触联系的功能有助于研究鸣禽鸣曲的学习和产生,有利于揭示人类大脑Broca区和Spt区在语言形成中潜在的功能和发声相关的感觉和运动信息整合的机制.听觉反馈对于鸣禽鸣唱是至关重要的,通过听觉隔离(如致聋等)干扰听觉反馈的过程可显著使鸣唱去稳定化,所以人们对这个方面的研究有着极大的兴趣.左明雪等人通过电镜和在体电生理技术发现致聋后孟加拉雀鸣唱核团HVC和RA突触效能降低[35-36].但以往对致聋的研究对突触或神经元水平的研究较少,特别是干扰听觉反馈对于与感觉运动信息整合有关的NIf-HVC突触功能或其他鸣唱核团的影响以及相关分子机制还不清楚.目前,本实验室主要运用膜片钳、在体电生理、分子生物学以及声谱分析等技术研究声音隔离(如致聋等)对斑胸草雀鸣唱及其生理生化指标的影响,以探讨感觉信息缺失在神经元、突触和鸣唱行为等方面潜在的影响以及感觉运动信息可能的整合过程,这可能为人类语言学习的研究和相关疾病的治疗提供相关的生物学研究资料或启发.
[1] 侯国强, 李东风. 听觉反馈与鸣禽鸣唱学习可塑性[J]. 生物化学与生物物理进展, 2009, 36(4): 403-409.
[2] SOBER S J, BRAINARD M S. Adult birdsong is actively maintained by error correction[J]. Nat Neurosci, 2009, 12, 927-931.
[3] 刘少艺, 冯理, 张萌,等. 鸣禽前脑听觉和鸣唱系统zenk基因的诱导表达[J]. 生命科学研究, 2012, 16(6): 551-556.
[4] JARVIS E, GUNTURKUN O, BRUCE L,et al. Avian brains and a new understanding of vertebrate brain evolution[J]. Nat Rev Neurosci, 2005, 6: 151-159.
[5] AKUTAGAWA E, KONISHI M. New brain pathways found in the vocal control system of a songbird[J]. J Comp Neurol, 2010, 518: 3086-3100.
[6] JIN H, CLAYTON D F. Localized Changes in Immediate-Early Gene Regulation during Sensory and Motor Learning in Zebra Finches[J]. Neuron, 1997, 19: 1049-1059.
[7] VOSS H U, SALGADO-COMMISSARIAT D, HELEKAR S A. Altered Auditory BOLD Response to Conspecific Birdsong in Zebra Finches with Stuttered Syllables[J]. PloS One, 2010, 5(12): e14415.
[8] BOLHUIS J J, GAHR M. Neural mechanisms of birdsong memory[J]. Nat Rev Neurosci, 2006, 7: 347-357.
[9] AVEY M T, PHILLMOR L S, MACDOUGALL-SHACKLETON S A. Immediate early gene expression following exposure to acoustic and visual components of courtship in zebra finches[J]. Behav Brain Res, 2005, 165: 247-253.
[10] ROBERTS T F, MOONEY R. Motor circuits help encode auditory memories of vocal models used to guide vocal learnin[J]. Hearing Res, 2013, 1-10.
[11] ROBERTS T F, TSCHIDA K A, MOONEY R, et al. Rapid spine stabilization and synaptic enhancement at the onset of behavioural learning[J]. Nature, 2010, 463(7283): 948-952.
[12] TSCHIDA K A, MOONEY R. Deafening drives Cell-Type-Specific changes to dendritic spines in a sensorimotor nucleus important to learned vocalizations[J]. Neuron, 2012, 73: 1028-1039.
[13] ROBERTS T F, GOBES S M H, MOONEY R, et al. Motor circuits are required to encode a sensory model for imitative learning[J]. Nat Neurosci, 2012, 15(10): 1454-1459.
[14] BOYDEN E S, ZHANG F, BAMBERG E, et al. Millisecond-timescale, genetically targeted optical control of neural activity[J]. Nat Neurosci, 2005, 8(9): 1263-1268.
[15] BERWICK R C, BECKERS G J, BOLHUIS J J, et al. A bird’s eye view of human language evolution[J]. Front Evol Neurosci, 2012, 4:5.
[16] VANDONGEN A M. Biology of NMDAR[J]. Boca Raton: CRC Press, 2009: 41-282.
[17] CASTELINO C B, SCHMIDT M F. What birdsong can teach us about the central noradrenergic system[J]. J Chem Neuroanat, 2010, 39: 96-111.
[18] CARDIN J A, SCHMIDT M F. Noradrenergic inputs mediate state dependence of auditory responses in the avian song system[J]. J Neurosci, 2004, 24: 7745-7753.
[19] CARDIN J A, SCHMIDT M F. Song system auditory responses are stable and highly tuned during sedation, rapidly modulated and unselective during wakefulness, and suppressed by arousal[J]. J Neurophysiol, 2003, 90: 2884-2899.
[20] CARDIN J A, SCHMIDT M F. Auditory responses in multiple sensorimotor song system nuclei are co-modulated by behavioral state[J]. J Neurophysiol, 2004, 91: 2148-2163.
[21] COLEMAN M J, MOONEY R. Synaptic transformations underlying highly selective auditory representations of learned birdsong[J]. J Neurosci, 2004, 24: 7251-7265.
[22] NAIE K, HAHNLOSER R H. Regulation of learned vocal behavior by an auditory motor cortical nucleus in juvenile zebra finches[J]. J Neurophysiol, 2011, 106: 291-300.
[23] LEWANDOWSKI B, VYSSOTSKI A, SCHMIDT M. At the interface of the auditory and vocal motor systems: NIf and its role in vocal processing, production and learning[J]. J Physiol-Paris, 2013, 107:178-192.
[24] SHEA S D, MARGOLIASH D. Basal forebrain cholineraic modulation of auditory activity in the zebra finch song system[J]. Neuron, 2003, 40: 1213-1226.
[25] HAHNLOSER R H R, WANG C Z H, NAGER A, et al. Spikes and bursts in two types of thalamic projection neurons differentially shape sleep patterns and auditory responses in a songbird[J]. J Neurosci, 2008, 28: 5040-5052.
[26] KELLER G B, HAHNLOSER R H. Neural processing of auditory feedback during vocal practice in a songbird[J]. Nature, 2009, 457: 187-190.
[27] ARONOV D, ANDALMAN A S, FEE M S. A specialized forebrain circuit for vocal babbling in the juvenile songbird[J]. Science, 2008, 320: 630-634.
[28] CARDIN J A, RAKSIN J N, SCHMIDT M F. Sensorimotor Nucleus NIf Is Necessary for Auditory Processing But Not Vocal Motor Output in the Avian Song System[J]. J Neurophysiol, 2005, 93: 2157-2166.
[29] ROY A, MOONEY R. Song Decrystallization in Adult Zebra Finches Does Not Require the Song Nucleus NIf[J]. J Neurophysiol, 2009, 102: 979-991.
[30] FEE M S, GOLDBERG J H. A hypothesis for basal ganglia-dependent reinforcement learning in the songbird[J]. Neuroscience, 2011, 198:152-172.
[31] Sanne Moorman, Sharon M. H. Gobes, Maaike Kuijpers et al. Human-like brain hemispheric dominance in birdsong learning[J]. PNAS, 2012,109(31): 12782-12787.
[32] 韩继生, 蒲慕明, 饶毅,等. 神经科学[M]. 北京: 北京大学医学出版社, 2009: 939-964.
[33] HICKOK G, HOUDE J, RONG F. Sensorimotor integration in speech processing: computational basis and neural organization[J]. Neuron, 2011, 69: 407-422.
[34] LIAO C S, LI D F. Effect of vocal nerve section on song and ZENK protein expression in area X in adult male Zebra Finches[J]. Neural Plast, 2012: 902510.
[35] PENG Z, ZENG S J, LIU Y, et al. Comparative study on song behavior, and ultra-structural electrophysiological and immunoreactive properties in RA among deafened, untutored and normal-hearing Bengalese finches[J]. Brain research, 2012, 1458: 40-55.
[36] PENG Z, ZHANG X B, XI C, et al. Changes in ultra-structures and electrophysiological properties in HVC of untutored and deafened Bengalese finches relation to normally reared birds: Implications for song learning[J]. Brain Research Bulletin, 2012, 89: 211-222.
Keywords: song learning; auditory feedback; NIf; HVC; auditory-vocal information integration
ConnectionsofNIf-HVCandVocalLearningandMaintenanceinSongbirds
LI Dongfeng*, FENG Li**, LIU Shaoyi, ZHANG Meng
(School of Life Science, South China Normal University, Guangzhou 510631, China)
Birdsong and human languages are both acquired by learning. During sensory period, templates are formed in the brain after juveniles heard tutor songs and stored in the related areas and in the motor-learning phase, juveniles compare their own songs to the templates and modify them to match the templates in their memories. When the songs are crystallized in the adult stage, auditory feedback is required to maintain the features and stability of their own songs. Hence, the sensory-motor integration of auditory and motor systems is vitally important to the formation of templates and the maintenance of crystallized songs. In the recent years, it is found that NIf-HVC synapses are related with the formation of templates memory and the maintenance of spatial features of plastic songs in the juveniles while this projection is crucial for the grammar structure of crystallized songs in the Bengalese finches. In songbirds, HVC if homologous to human Broca’s Area and NIf has many similarities with Area Spt in the human speech processing circuit. Therefore the research on the function of NIf-HVC synapses in the speech circuit is not only helpful for the study of Area Broca and Spt of human but also advantageous for exploring the mechanism concerning sense and motion information integration involved in vocal learning.
2013-03-20
国家自然科学基金项目(31172092)
*通讯作者:李东风,教授,Email:dfliswx@126.com.
**与第一作者同等贡献
1000-5463(2013)06-0140-08
Q957
A
10.6054/j.jscnun.2013.09.020
【中文责编:成文 英文责编:李海航】
