密度梯度法与羟乙基淀粉法培养脐血间充质干细胞比较
2013-10-27郎长会彭龙英束晓梅
郎长会,彭龙英,束晓梅
(遵义医学院附属医院 儿科,贵州 遵义 563099)
·技术与方法·
密度梯度法与羟乙基淀粉法培养脐血间充质干细胞比较
郎长会,彭龙英,束晓梅
(遵义医学院附属医院 儿科,贵州 遵义 563099)
目的比较密度梯度离心法与羟乙基淀粉法体外分离培养脐血间充质细胞(hUCB-MSCs)的成功率,为今后细胞移植和基因治疗提供重要的细胞来源。方法取44份足月儿顺产或剖宫产脐带血,分为两组,每组22份,分别用密度梯度离心法结合贴壁法与羟乙基淀粉法分离脐血中单个核细胞,专用培养基培养,观察两种方法培养所得细胞的形态变化并绘制生长曲线,用流式细胞术鉴定细胞表面标志物CD14,CD29,CD44,CD45, CD105的表达。结果羟乙基淀粉法培养hUCB-MSCs的成功率(36.36%)高于密度梯度离心法结合贴壁法的培养成功率(9.1%)(P<0.05)。两种方法所得细胞在形态、生长曲线和表面标志物CD14,CD29,CD44,CD45,CD105的表达无明显差异(P>0.05)。结论羟乙基淀粉法可以提高hUCB-MSCs培养成功率,为hUCB-MSCs在临床中应用奠定基础。
密度梯度离心;贴壁筛选法;羟乙基淀粉;脐血;间充质干细胞
间充质干细胞(mesenchymal stem cells MSCs)起源于中胚层,具有多向分化潜能[1]。MSCs是组织工程、细胞移植中发挥有效作用的理想种子细胞。近年来,文献报道[2]多种组织(脐血、骨髓、牙齿、骨骼肌、肝、肺、羊水、胎盘及外周血等)可以分离出MSCs,尤其是脐血和骨髓。目前对于骨髓间充质干细胞(Bone marrow mesenchymal stem cells BMMSCs)分离培养方法的研究较成熟,但由于其随着年龄增长分化能力及治疗作用逐渐下降,且采集量有限,使其应用受到限制[3-5],而人脐血间充质干细胞(human umbilical cord blood mesenchymal stem cells hUCB-MSCs)具有来源丰富,取材方便,具有多向分化能力;免疫原性较弱等优势,被广泛应用于干细胞治疗及基因治疗中[6-8]。目前,从脐血分离MSCs的方法较多,各种方法的优缺点众说纷纭,且分离培养较为困难,寻找一种高效快速的分离方法迫在眉睫。有学者认为羟乙基淀粉法可缩短实验时间,可提高所得hUCB-MSCs纯度。本实验通过比较密度梯度离心法结合贴壁法与羟乙基淀粉法的培养成功率,试图选择一种高效体外分离方法从脐血中分离培养hUCB-MSCs,为以后在细胞移植和基因治疗中提供重要的细胞来源。
1 材料与方法
1.1 材料 人淋巴细胞分离液(天津颢洋、LTS1077)、羟乙基淀粉550(hydroxyethyl starch HES天津颢洋,分子量550),红细胞裂解液(Ammonium chloride Stem cell公司),胎牛血清(Gibco),台盼兰、PBS(北京中杉),0.25%胰蛋白酶、hUCB-MSCs专用培养基(赛业生物科技有限公司),bFGF(碱性成纤维细胞生长因子 Sigma),兔抗人FITC-CD44、FITC-CD105、PE-CD14、PE-CD29、PE-CD45、同型对照FITC-IgG1及PE-IgG1(北京博奥森生物有限公司)。
1.2 脐血来源 经产妇及家属知情同意后,于遵义医学院附属医院产科采集,均来自正常足月顺产或剖宫产的健康产妇脐血44份(健康标准为无肝炎、艾滋病及梅毒等传染病),分为对照组和HES组两组,每组22份。每份脐血量约50~100 mL, 肝素钠(20U/mL)抗凝,所有标本均于采集后6h内进行分离。
1.3 方法
1.3.1 密度梯度分离 将抗凝的脐带血与PBS等体积稀释,缓慢叠加于淋巴细胞分离液上,2 000 rpm,20 min,吸取中间白膜层,1 000 rpm,6 min,弃上清,PBS清洗一次(1 000 rpm,6 min),弃上清。
1.3.2 HES分离 将脐血与6%羟乙基淀粉以4∶1比例混匀,常温下静置1h,取上清,将其缓慢叠加于淋巴细胞分离液上,2 000 rpm,离心20 min,弃上清,PBS洗涤2次。
以上均加入红细胞裂解液3 mL室温静置5~10 min,加入5 mL PBS,1 000 rpm,5 min,弃上清,以1×106个细胞/mL的密度接种于含有10%胎牛血清(fetal bovine serum FBS)、5 ng/mL碱性成纤维因子(basic fibroblast growth factor bFGF)的专用培养基中,置于37 ℃,5%CO2培养箱中培养。3 d后半量换液,去除未贴壁细胞,以后每三天全量换液一次,待细胞生长至80%~90%融合时(一般24 d至35 d),PBS洗2次,0.25%胰酶消化1 min左右,待细胞开始变圆时加入培养基终止消化,1 000 rpm,5 min,弃上清,以1∶2传代,在倒置显微镜下观察细胞的形态变化。
1.3.3 比较细胞形态和生长情况 每天在倒置显微镜下观察两组细胞形态变化并拍照,各取两组P3细胞每孔细胞以1×104接种于24孔板中,于37 ℃,5% CO2培养箱中培养,每天取3孔用0.4%台盼兰染色行细胞计数,连续检测7 d。
1.3.4 流式细胞分析 取对数生长期P3细胞,0.25%胰酶消化,PBS洗涤二次,制成密度为1×106/mL的细胞悬液,每个流式管加100 μL细胞悬液,分别加入20 μL FITC-CD44,FITC-CD105,PE -CD29,PE-CD14,PE-CD45,对照组分别加入同量的相应的FITC-IgG1,PE-IgG1,冰上避光孵育30 min,PBS洗涤二次,1 000 rpm,离心5 min,重新制成细胞悬液,流式细胞仪(BD FACSCalibur)检测和采用SPSS17.0软件分析。
2 结果
2.1 两种方法分离培养hUCB-MSCs及形态比较 两种方法所得细胞接种24 h后,于倒置显微镜下观察,大多数细胞为圆形,少部分细胞已贴壁。第5天可见多角形细胞和大量大而圆的破骨样细胞及杂细胞,12 d后可见大量梭形细胞呈集落样生长,平均约28d(一般在24~25 d)可以传代(图1A、1B)。传代后约12 h后细胞逐渐贴壁,细胞呈均一的梭形细胞,7~10 d可再次传代,P3细胞得到形态均一, 6~7 d细胞融合率达90% (图2A、2B,P3第2天),两种分离方法结合差速贴壁培养、纯化后,所得细胞形态无明显差别。
2.2 细胞生长曲线 两种分离方法所培养的P3细胞的生长曲线都近似“S”形,第1~3天生长缓慢,从4 d开始呈对数生长,5~6 d生长缓慢(见图3 ),且两组细胞生长速度无明显区别。
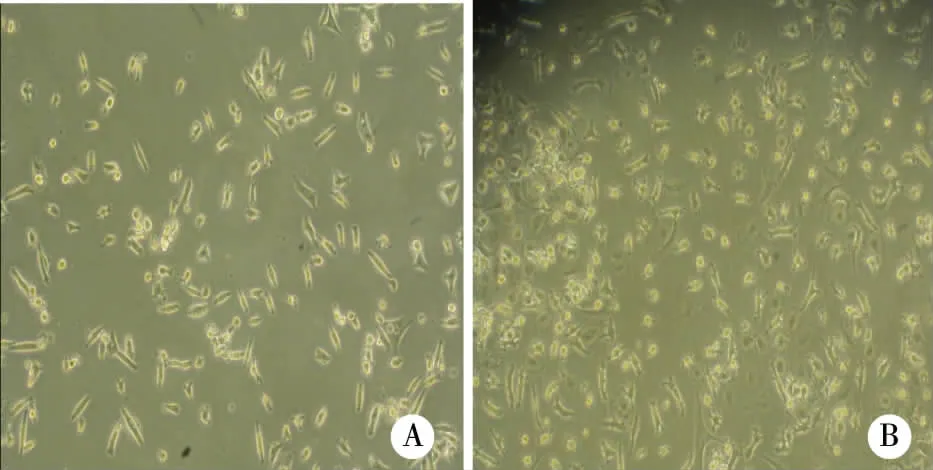
注:A:为密度梯度离心法原代培养12 d;B:为羟乙基淀粉法原代培养12 d,两组细胞均呈长梭形,大部分细胞有折光性,均有杂细胞(相差显微镜×40)。 图1 两种分离方法原代hUCB-MSCs细胞形态

注:A:为对照组P3第3天;B:为HES组P3第2天,细胞呈长梭形,胞体较粗;无杂细胞(相差显微镜×40)。 图2 两种分离方法P3 hUCB-MSCs细胞形态
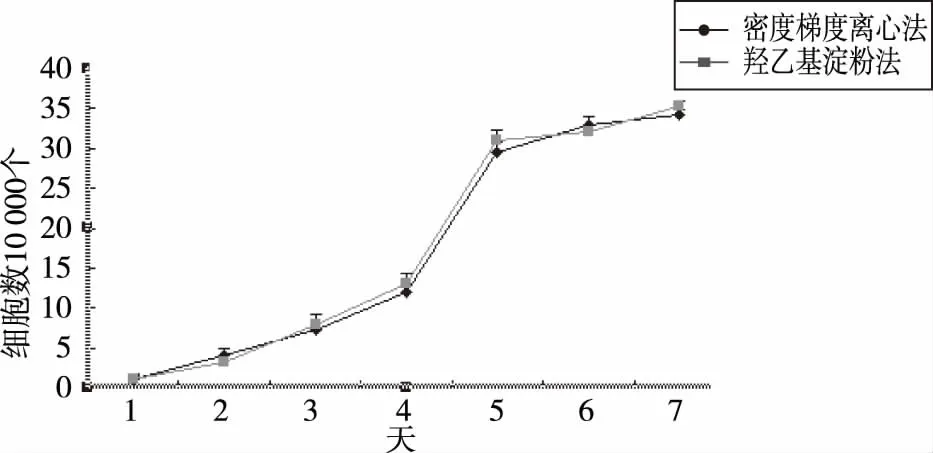
图3 两种方法第三代hUCB-MSCs生长曲线
2.3 hUCB-MSCs表型鉴定 用流式细胞仪对两种方法所得P3 hUCB-MSCs 表面标志物进行检测,两种分离方法采用相同培养方法,2组P3的 hUCB-MSCs 均表达CD29、CD44、CD105,不表达CD14、CD45,且上述表面分子表达百分率无明显差异(P>0.05,见表1)。
2.4 两种分离方法对hUCB-MSCs培养成功率的影响 两种脐血分离方法所获得的MNCs,采用相同的差速贴壁培养,均于10~12 d可形成hUCB-MSCs集落,并可传代。hUCB-MSCs培养成功率对照组为9.1%,HES组则为36.36%,HES组成功率明显高于对照组(P<0.05)。
表1两种分离方法的hUCB-MSCs表面标志物的比较

组别 CD14CD29CD44CD45CD105对照组0.08±0.698.97±0.998.7±0.850.78±0.796.04±1.1HES组0.12±0.597.65±0.899.1±1.00.70±0.695.3±1.3
表2两种不同脐带血分离对hUCB-MSCs培养成功率的影响

组别培养成功数未成功数合计成功率%对照组220229.1HES组8142236.36合计10344445.46
注:对照组和HES组比较,P<0.05有统计学意义(2=4.658)。
3 讨论
增殖能力强的hUCB-MSCs在特定诱导条件下可向各个胚层细胞分化,如内胚层的肠上皮细胞、中胚层的骨组织及外胚层的神经组织等,如在脑源性生长因子(BDNF)作用下将其植入大鼠脑中可诱导向神经样细胞分化,移植入脑的缺血部位可改善大鼠的脑功能恢复,移植入脊髓损伤小鼠可促进运动功能的恢复[9-11]。基于其分化能力强、免疫原性较弱及多向分化的特点,hUCB-MSCs成为细胞工程中极具应用前景的干细胞来源。hUCB-MSCs分离培养较困难是其临床应用受限的原因之一。目前,分离hUCB-MSCs方法种类繁多、效果欠佳,尚无有效、公认及稳定的方法,主要有密度梯度离心法,羟乙基淀粉沉淀法,流式细胞分选法,免疫磁珠分选法,单细胞克隆法等[12]。流式细胞分选法和免疫磁珠分选法对细胞活性均影响较大且MSCs缺乏特异性标志,单细胞克隆法实验条件要求比较高,脐血量大,不适用。Perutelip[13]认为羟乙基淀粉对红细胞有较强的凝集作用,可提高hUCB-MSCs的纯度及成功率,但尚存争议。故本实验通过比较密度梯度离心法结合贴壁法、羟乙基淀粉沉淀法分离培养hUCB-MSCs。
从本实验结果中可以看到,羟乙基淀粉沉淀法获得的MNCs,hUCB-MSCs培养成功率比密度梯度离心法要高。两种方法所得细胞均高表达MSCs表面抗原CD29、CD105、CD44,不表达造血干细胞表面抗原CD45 及CD14。原代培养时所得单个核细胞中存在有大量圆形破骨细胞影响MSCs的生长,随着逐渐换液传代、不断差速贴壁培养,破骨样细胞可被去除,细胞传至P3时已得到纯度较高的hUCB-MSCs,且生长速度较快。王颖超等[14]通过比较两种分离方法培养hUCB-MSCs,表明羟乙基淀粉沉淀法可以得到更多的MSCs,与本实验结果一致;Jaatinen1[15]和Fuss[16]表明密度梯度离心法的培养率较低,其原因可能为从脐血分离单个核细胞中混杂红细胞太多,在离心时并不是所有红细胞都会沉到底层,一些红细胞相反会介于血浆与淋巴分离液之间的单核细胞层,而且离心红细胞沉降时可能与某些单核细胞粘附,导致单个核细胞沉到底层,使得本来就很少的单核细胞更少,导致该方法培养hUCB-MSCs的成功率更低。所以本实验在脐血在经HES处理后用红细胞裂解液裂解红细胞,使其成功率提高[17]。
本实验发现hUCB-MSCs专用培养基适宜于hUCB-MSCs生长;血清浓度不宜过高,应选用10%FBS,因血清浓度过高使得杂细胞大量生长,不利于MSCs生长;首次换液时间3 d,过早不利于细胞贴壁,过晚大量破骨样细胞生长,表明经传代培养后可得到均一的MSCs。
从本实验中还发现:在将稀释的脐血叠加到淋巴分离液面上时,勿将脐血沉至淋巴分离液下,这样使得离心后白膜层不明显至失败;在吸取分离液与血清之间的白膜层时要缓慢小心仔细操作,若操作不当,吸取过多红细胞分离易失败;脐血量较多时羟乙基淀粉沉淀法更简便。
综上所述,羟乙基淀粉沉淀法的成功率比常规密度梯度离心法要高,脐血经过羟乙基淀粉沉淀后可使红细胞沉至管底,对MNC无影响,细胞污染较小,而密度梯度离心法所得细胞含有大量红细胞和破骨样细胞,分离效果不稳定,不利于MSCs生长。本实验为分离培养hUCB-MSCs提供有利的分离及培养方法,为以后诱导其向各种组织细胞分化及在细胞移植和基因治疗中提供重要的细胞来源。
[1] Park K S, Lee Y S, Kang K S.In vitro neuronal and osteogenic differentiation of mesenchymal stem cells from human umbilical cord blood[J]. Veterinary Science,2006,7(4):343-348.
[2] Erices A, Congrt P,Minguell P P.Mesenchymal progenitor cells in human umbilical cord blood[J]. Haematology,2000,109(1):235-242.
[3] Lim J Y, Jeun S S, Lee K J,et al. Multiple stem cells traits of expanded rat bone marrow stromal cells[J]. Experimental Neurology,2006,199(2):416-426.
[4] Kern S, Eichler H, Stoeve J, et al. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood,or adipose tissue[J]. Stem cells,2006,24(5):1294-1301.
[5] Malgieri A,Kantzari E, Patrizi M P,et al. Bone marrow and umbilical cord blood human mesenchymal stem cells :state of the art[J]?Int J Clin Exp Med,2010,3(4):248-269.
[6] Peters R,Wolf M J,Brock MVD,et al. Efficient generation of multipotent mesenchymal stem cells from umbilical cord blood in stroma-free liquid culture[J]. Plos one,2010,5(12):1-14.
[7] Bourin P, Gadelorge M,Pevrafitte J A,et al. Mesenchymal progenitor cells:Tissue origin,isolation and culture[J]. Transfus Med Hemother,2008,35(3):160-167.
[8] Bieback K,Kluter H. Mesenchymal stromal cells from umbilical cord blood[J]. Curr Stem Cell Res Ther,2007,2(4):310-323.
[9] Lim J Y, Jeong C H, Jun J A, et al. Therapeutic effects of human umbilical cord blood-derived mesenchymal stem cells after intrathecal administration by lumbar puncture in a rat model of cerebral ischemia[J]. Stem Cell Res Ther, 2011,2(5):38.
[10] Lim J Y, Park S I, Oh J H, et al. Brain-Derived Neurotrophic Factor Stimulates the Neural Differentiation of Human Umbilical Cord Blood-Derived Mesenchymal Stem Cells and Survival of Differentiated Cells Through MAPK/ERK and PI3K/Akt-Dependent Signaling Pathways[J]. Neurosci Res,2008,86(10):2168-2178.
[11] Kuh S U, Cho Y E, Yoon D H, et al. Functional recovery after human umbilical cord blood cells transplantation with brain-derived neutrophic factor into the spinal cord injured rat[J]. Acta Neurochir, 2005, 147(9):985-992.
[12] Musina R A,Bekchanova E S,Belyavskii AV,et al. Umbilical cord blood mesenchymal stem cells[J]. Exp Biology and Medicine,2007,143(1):16-20.
[13] Peruteli P,Catellani S,Scarsol,et al. Processing of human cord blood by three different procedures for red blood cell depletion and mononuclear cell recovery[J]. Vox Sanguinis,1999,76(4):237-240.
[14] 王颖超,殷楚云,冯磊,等.三种不同方法分离脐血造血干细胞的效果比较[J].实用儿科临床杂志,2012,27(10):766-768,794.
[15] Jaatinen T,Laine J.Isolation of Monenuclear Cells From human cord blood by Ficoll-Paque desity gradient[J]. Curr Protocol Stem Cell Bio,2007,Chapter 2:Unit 2A.
[16] Fuss I L,Kanof M E,Smith P D,et al. Isolation of whole mononuclear cells from peripheral blood and cord blood[J]. Curr protoc Immunol,2009,Chaptor 7:Unit7.1.
[17] Horn P,Bork S,Wagner W. Standardized isolation of human mesenchymal stromal cells with red blood cell lysis[J]. Methods Mol Biol,2011,698:23-25.
Comparisonoftwoseparationmethodsofculturinghumanumbilicalcordbloodmesenchymalstemcells
Langchanghui,Penglongying,Shuxiaomei
(Department of Pediatrics,The Affiliated Hospital of Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo explore an optimized isolation method of human umbilical cord blood mesenchymal stem cells (hUCB-MSCs).MethodsUmbilical cord blood cells were collected from full-term normal delivery or cesarean section delivery infants under aseptic condition. 44 samples of umbilical cord blood were collected, and divided into two groups. The density gradient centrifugation or hydroxyethyl starch sedimentation was used to isolate hUCB-MSCs with adherent culture, and compared. Mononuclear cells (MNCs) were harvested from human umbilical cord blood. The morphology of MNC and their growth characteristics were observed. The surface antigen phenotype was detected by flow cytometry.ResultsThe success rate of the hydroxyethyl starch sedimentation method was higher than that of density gradient centrifugation(P<0.05).The morphological changes and the surface markers CD14, CD29, CD44, CD45 and CD105 were not obviously different (P>0.05).ConclusionThe hydroxyethyl starch sedimentation culture could improve the success rate of hUCB-MSCs.
density gradient centrifugation; adherent culture; hydroxyethyl starch sedimentation; umbilical cord blood; mesenchymal stem cells
国家自然科学基金资助项目(NO: 31260286)
束晓梅,女,博士,教授,硕士生导师,研究方向:儿童神经系统疾病,E-mail:shuxiaomei@163.com。
R 329
A
1000-2715(2013)05-0477-04
[收稿2013-06-24;修回2013-07-28]
(编辑:王福军)
