贵州5种药用植物内生菌的分离及次级代谢产物研究
2013-10-27李园园彭廷文吕玉红保玉心邵美云罗显涛曾令荣岳昌武
李园园,彭廷文,吕玉红 ,保玉心,邵美云,罗显涛,曾令荣,岳昌武
(1. 遵义医学院医学与生物学研究中心暨贵州省特色微生物资源及药物开发重点实验室,贵州 遵义 563099; 2. 遵义医学院 药学院,贵州 遵义 563099; 3. 遵义医学院 基础医学院,贵州 遵义 563099)
贵州5种药用植物内生菌的分离及次级代谢产物研究
李园园1,2,彭廷文2,吕玉红3,保玉心1,邵美云1,罗显涛2,曾令荣2,岳昌武1
(1. 遵义医学院医学与生物学研究中心暨贵州省特色微生物资源及药物开发重点实验室,贵州 遵义 563099; 2. 遵义医学院 药学院,贵州 遵义 563099; 3. 遵义医学院 基础医学院,贵州 遵义 563099)
目的分离筛选具有抗菌活性及抗肿瘤活性的药用植物内生菌。方法采集贵州地道药用植物大黄、刺梨、杜仲、白芍和刺五加等5种组织材料,经表面消毒、无菌匀浆后,用改良的GYM培养基和TWYE培养基进行分离,利用耐药大肠杆菌、耐药金黄色葡萄球菌、藤黄微球菌及白色链球菌等测试菌和稻瘟霉模型对分离菌株的发酵产物进行筛选,并通过HPLC对活性菌株发酵产物做进一步分析。结果分离得到植物内生菌180株,其中46株有不同程度的抗菌活性,占分离菌株总数的25.6%,58株菌有不同程度的抗稻瘟霉活性,占分离菌株总数的32.2%。结论5种药用植物中内生菌种类极其丰富,且有活性的菌株所占比例较高,HPLC检测有新的紫外吸收峰,值得对其次级代谢产物进一步研究。可见贵州药用植物具有丰富的活性内生菌资源,有巨大的开发研究价值。
药用植物; 内生菌; 发酵产物;抗菌活性; 抗肿瘤活性
植物内生菌(endophyte)是指一生或部分时间植物体内寄生或共生,并且不会对宿主植物造成明显伤害的一类微生物,包括细菌、放线菌、真菌等。自1993年Stierle等[1-2]从短枝红豆杉中发现产紫杉醇内生真菌并证明内生菌可以合成与宿主植物相似或相同的活性物质以来,有关内生菌的研究引起了越来越多研究者的兴趣,Kumar等[3]从余干果中分离出5株放线菌,其中有两株具有抗菌活性,Vigay等[4]从印度苦楝树中分离出的55株菌中有60%表现出抗菌活性,S.Shweta 等[5]从 Miquelia dentata Bedd 中分离出能产生抗癌剂喜树碱的内生菌。很多的植物内生菌的次级代谢产物为生物碱、萜类化合物、黄酮类化合物、甾类化合物等化合物,其中多数为抗生素、抗癌剂、生物防治剂等,因此利用植物内生菌筛选抗生素意义重大[6-7]。
贵州拥有丰富的药用植物资源,据初步研究,平均每种药用植物有5种以上的内生菌[8],因此贵州的药用植物内生菌将是一个巨大的资源库,值得进一步开发。
1 材料与方法
1.1 材料
1.1.1 样品的采集 干大黄和杜仲采自务川县境内,白芍、刺五加根采自凤岗县,生大黄根采自仁怀市茅台镇,刺梨根和茎采自贞丰县。
1.1.2 培养基及试剂 改良自来水酵母琼脂(TWYE):酵母浸汁0.25 g,K2HPO40.5 g,琼脂18 g,植物汁50 mL,自来水补足到1000 mL[9];改良GYM:葡萄糖4 g,酵母抽提物4 g,麦芽抽提物10 g,CaCO32 g,琼脂粉15 g,植物汁50 mL,纯水补足到1 000 mL。植物汁:饱浆嫩玉米1 000 g、胡萝卜200 g和桔子200 g,弃去玉米核和桔子皮,加200 mL自来水全部打匀成浆液后用双层纱布过滤,滤液加水定容至1 000 mL。用0.22 μm的滤膜过滤除菌后4 ℃保存。麦芽抽提物和琼脂粉均购自Solarbio公司,葡萄糖购自天津市科密欧试剂有限公司,无水乙醇、甲醇、丙三醇、碳酸钙等购自成都科龙化工试剂厂。
1.1.3 抑制剂 重铬酸钾50 mg/L,制霉菌素20 mg/L,萘啶酮酸20 mg/L,放线菌酮50 mg/L。
1.1.4 测活菌株 耐药金黄葡萄球菌(Staphylococcusaureussubsp.aureusDSM 1104)、白色链球菌(Streptococcus)、耐药大肠杆菌(E.coliDSM 1103)、藤黄微球菌(MicrococcusluteusCGMCC 1.215 6 ),菌株均来自本实验室保藏。
1.2 内生菌的分离及纯化
1.2.1 植物表面消毒 植物组织用自来水冲洗30 min,95%乙醇浸泡5 min,无菌水漂洗后用活性氯含量为1.1%的次氯酸钠浸泡5 min,无菌水漂洗两次,每次5分钟,最后用无菌水冲洗5次,取100 μL最后一次冲洗样品的水涂布于分离培养基作对照以确证表面消毒彻底。
1.2.2 菌株分离 无菌操作下匀浆或粉碎植物组织后称取2 g浆液或粉末,加无菌水至10 mL混匀,依次利用无菌水进行10、100、1 000倍稀释。分别取上述稀释液200 μL涂布于加入抑制剂的分离培养基上28 ℃培养,挑取单菌株进行纯化,纯化后的菌株接种GYM培养基上。
1.3 活性测定
1.3.1 抗菌活性测定 将测试菌接种于LB液体培养基,37 ℃摇床200 rpm培养6~8 h,取10 mL菌液与200 mL将凝固(约40 ℃)固体LB培养基混合均匀后迅速倒板,凝固后用无菌打孔器挖取直径4 mm带有分离菌株菌体的培养基块放置在测活培养基上,37 ℃正置培养8 h后根据抑菌圈的有无和直径大小为依据判断抑菌效果。
1.3.2 抗肿瘤活性测定 本实验中用稻瘟霉模型对菌株进行抗肿瘤活性初步筛选[10]。将稻瘟霉接种于PDA斜面培养基上,28 ℃培养12~14 d,无菌棉签收集孢子并计数,沙氏液体培养基稀释孢子至终浓度为7000个/mL,于96孔细胞培养板的A1~A12孔中分别加入孢子悬浮液20 μL、沙氏培养基20 μL和无菌水10μL,剩余各孔分别加入孢子悬浮液10 μL、沙氏培养基10 μL及无菌水至30 μL。在A1~A11孔中分别加入50 μL菌株发酵抽提物,A12孔中加入50 μL无菌水为空白对照。自B1~B12以后每行的菌株发酵抽提物的浓度依次为前1行的50%进行等比稀释,28 ℃培养20 h,显微镜下观察发酵产物对孢子萌发和菌丝体发育影响。
1.4 产物制备
1.4.1 菌株发酵 将活性菌株接种于含GYM固体培养基表面,28 ℃培养7 d后,无菌操作下将培养基捣碎,28 ℃继续培养7 d。
1.4.2 发酵产物抽提:发酵三角瓶中分别加入50 mL乙酸乙酯, 150 rpm,振荡抽提30 min,双层滤纸过滤除去菌丝体及固体培养基,滤液在旋转蒸发仪上蒸干,1 mL甲醇溶解产物,抽提物12000 rpm离心10 min备用。
1.5 发酵产物的HPLC检测 色谱条件:色谱条件:C18反相色谱柱,进样量20 μL,流速1 mL/min,甲醇:水(80∶20)梯度洗脱。
2 结果与分析
2.1 菌株分离结果 5种植物中,分离得到菌株最多的是刺梨(72株),最少的是石斛(5株)。不同的培养基总体分离结果比较,GYM培养基出菌率高于TWYE培养基,结果(见表1)。
表1菌株分离结果
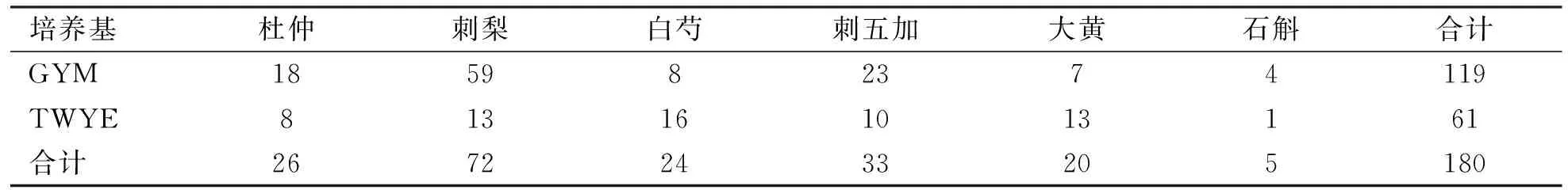
培养基杜仲刺梨白芍刺五加大黄石斛合计GYM185982374119TWYE813161013161合计26722433205180
2.2 抗菌活性测试结果 分离的134株菌的抗菌活性测定结果(见表2),共46株分别对不同测活菌表现出不同程度的抑制作用,占34.33%。其中38株对耐药大肠杆菌有不同程度的杀灭作用(见图1),45株对藤黄微球菌有不同程度的杀灭作用,1株对耐药金黄色葡萄球菌有杀灭作用,1株对白色念球菌有杀灭作用,分别占活性菌株总数的82.61%、97.83%、2.17%和2.17%。
表2分离菌株抗菌活性测定结果
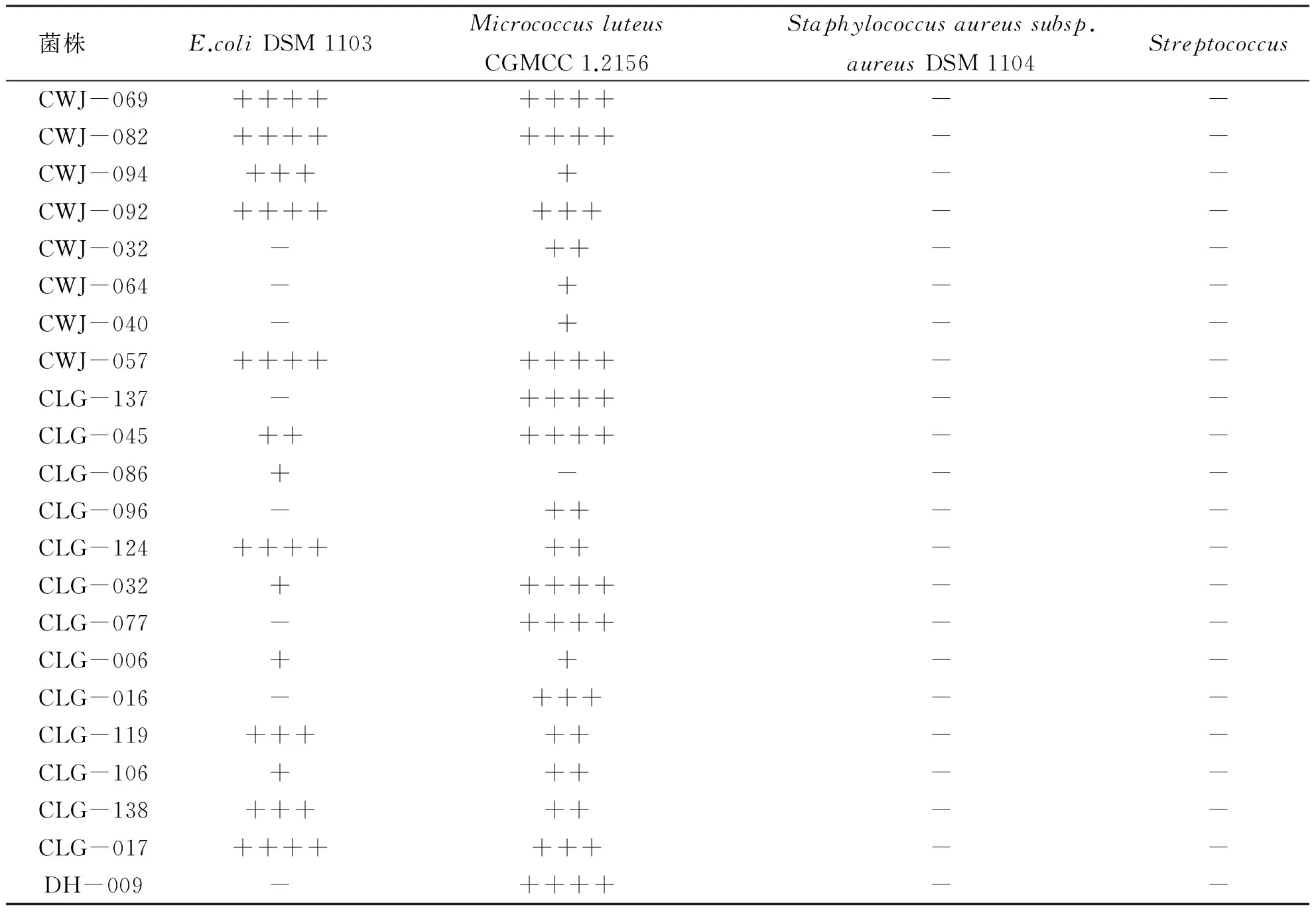
菌株 E.coliDSM1103MicrococcusluteusCGMCC1.2156Staphylococcusaureussubsp.aureusDSM1104StreptococcusCWJ-069++++++++--CWJ-082++++++++--CWJ-094++++--CWJ-092+++++++--CWJ-032-++--CWJ-064-+--CWJ-040-+--CWJ-057++++++++--CLG-137-++++--CLG-045++++++--CLG-086+---CLG-096-++--CLG-124++++++--CLG-032+++++--CLG-077-++++--CLG-006++--CLG-016-+++--CLG-119+++++--CLG-106+++--CLG-138+++++--CLG-017+++++++--DH-009-++++--

(续表)
注:CLJ:刺梨茎;CLG:刺梨根;CWJ:刺五加;BS:白芍;DZ:杜仲;DH:大黄。

注:1:CWJ-069; 2:DH-009;3: DH-005;4:DH-019;5: DH-014;6:DH-018;7:DH-028;8: DH-007;9:DH-034;10:CLG-045;11:CLJ-017;12:BS-014;13:CLG-124;14:CLJ-011;15:CLJ-034;16:WJ-082;17:CWJ-094;18:CWJ-092;19:BS-024;20:BS-036;21:BS-038;22:BS-005;23:CWJ-057;24:CLG-119;25:CLG-138;26:CLG-017;27:DZ-014;28:DZ-028; 29:DZ-018;30:DZ-029;31:DZ-035。 图1 菌株对耐药大肠杆菌活性
2.3 抗肿瘤活性测试结果 抗肿瘤活性稻瘟霉模型初步筛选的180株菌株中(见表1),有58株能抑制孢子萌发,占32.22%。其中46株能高度抑制孢子萌发,12株轻微抑制孢子萌发。

注:1:CWJ-069;2:CLG-137; 3:DH-009;4:DH-005;5:DH-019;6:DH-014;7:DH-018;8:DH-028;9: DH-007;10: DH-034;11:CLG-045;12:CLJ-017;13:CLG-096;14:CLG-124;15:CLG-032;16:CLG-077;17:CLJ-011;18:CLJ-034;19:CWJ-082;20:CWJ-094; 21:CWJ-092;22:DZ-005;23:BS-024;24:BS-025; 25:BS-036; 26:BS-038;27:BS-005;28:CWJ-032;29:CWJ-064;30:CWJ-057;31:CLG-016;32:CLG-119;33:CLG-106;34:CLG-138;35:CLG-017;36:DZ-014;37:DZ-028;38:DZ-024;39:DZ-018;40:DZ-029;41:DZ-035 图2 菌株对藤黄微球菌活性
表3抗肿瘤活性测定结果
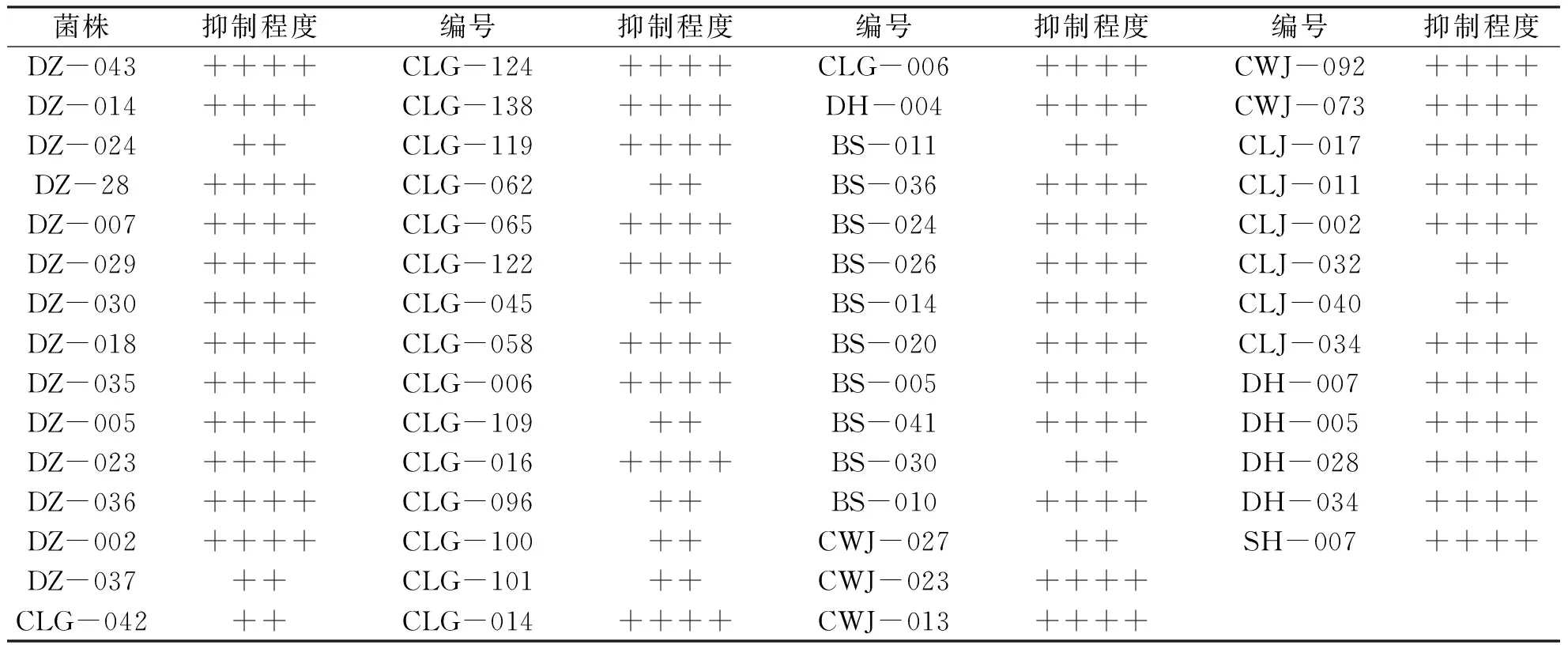
菌株抑制程度编号抑制程度编号抑制程度编号抑制程度DZ-043++++CLG-124++++CLG-006++++CWJ-092++++DZ-014++++CLG-138++++DH-004++++CWJ-073++++DZ-024++CLG-119++++BS-011++CLJ-017++++DZ-28++++CLG-062++BS-036++++CLJ-011++++DZ-007++++CLG-065++++BS-024++++CLJ-002++++DZ-029++++CLG-122++++BS-026++++CLJ-032++DZ-030++++CLG-045++BS-014++++CLJ-040++DZ-018++++CLG-058++++BS-020++++CLJ-034++++DZ-035++++CLG-006++++BS-005++++DH-007++++DZ-005++++CLG-109++BS-041++++DH-005++++DZ-023++++CLG-016++++BS-030++DH-028++++DZ-036++++CLG-096++BS-010++++DH-034++++DZ-002++++CLG-100++CWJ-027++SH-007++++DZ-037++CLG-101++CWJ-023++++CLG-042++CLG-014++++CWJ-013++++
注:CLJ:刺梨茎;CLG:刺梨根;CWJ:刺五加;BS:白芍;DZ:杜仲; SH:石斛。
2.4 活性菌株发酵产物HPLC分析 菌株的发酵产物大多有较多新的紫外吸收峰,取波长为220 nm、254 nm和300 nm的峰进行初步分析,选取菌株活性较好且有较多新的紫外吸收峰的菌株BS-005、CLG-017和CLG-106做进一步研究。
3 讨论
贵州省药用植物生物多样性极其丰富,但是对于其的开发力度还远远不够,药用植物内生菌能够产生多种生物活性物质,甚至能产生与宿主植物成分类似的代谢产物,从而为筛选和开发新的天然产物提供了丰富的资源。本研究所分离的菌株中,大部分均具有抗菌或抗肿瘤活性,具有潜在的应用价值,在抗稻瘟霉模型中,32.22%对孢子萌发具有不同程度的抑制作用,并且部分HPLC检测中有新的紫外吸收峰,可能为新的化合物。其中白芍和刺梨分离得到的菌株BS-005、CLG-017和CLG-106的活性较好且发酵产物有较多新的吸收峰,后续将对其结构和生物活性做进一步研究,并对其与宿主次级代谢产物之间的活性的关系做进一步研究,对于所分离得到菌株的类型也有待通过提取基因组DNA进行16 s鉴定。在分离得到的180株菌株中,刺梨分离得到的菌株最多,其次是刺五加,金钗石斛分离得到的菌株仅为5株;在总体结果看来,本研究设计的两种分离培养基中,GYM培养基的分离效果明显高于自来水酵母琼脂。抗肿瘤活性稻瘟霉模型筛选中,仅发现抑制稻瘟霉孢子萌发,未发现使稻瘟霉孢子发育的菌丝致畸作用,没有达到预期目的,故菌株的抗肿瘤活性筛选有待进一步改进实验流程后继续研究。
[1] Stierle A, Strobel G,Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew[J].Science, 1993, 260:214-216.
[2]Strobel G S, Daisy B, Castillo, et al. Natural Products from Endophytic Microorganisms. Journal of Natural Products[J]. J Nat Prod, 2004, 67(2):257-268.
[3]Kumar U, Singh A, Siva Kumar T.Isolation and screening of endophytic aetinomycetes from different part of Emblica officinalis [J].Annals of Biological Research, 2011, 2(4): 423-434.
[4]Vijay C,Verma,Surendra K,et al.Endophytic actinomycetes from Azadirachta indica A Juss: Isolation, diversity, and anti-microbial activity [J]. Microb Ecol,2009,57:749-756.
[5]S. Shweta,J.Hima Bindu.Isolation of endophytic bacteria producing the anti-cancer alkaloid camptothecine from Miquelia dentate Bedd[J].Phytomedicine, 2013,20(10):913-917.
[6]阮继生, 黄英.放线菌快速鉴定与系统分类 [M]. 北京:科学出版社,2011:17-21.
[7]Baby Joseph, R.Mini Priya. Bioactive compound from Endophytes and their Potential in Pharmaceutical Effect: A Review [J]. American Journal of Biochemstry and Molecular Biology, 2011, 1(3):291-309.
[8]杨颖,陈红华,徐丽华.植物内生放线菌多样性研究 [J]. 云南大学学报:自然科学学报,2008, 30(1):403-405.
[9]Qin S, Li J, Chen H H, et al. Isolation, Diversity, and Antimicrobial Activity of Rare Actinobacteria from Medicinal Plants of Tropical Rain Forests in Xishuangbanna [J]. China Appl Environ Microbiol, 2009, 75:6176-6186.
[10]张袆, 王涛, 裴月湖,等. 利用生物模型-稻瘟霉筛选活性菌株 [J]. 沈阳药科大学学报, 2002, 19(6):448-450.
IsolationoftheEndophyticbacteriaofseveralmedcinalplantsfromGuizhouprovinceandthestudyoftheirantibacterialandantineoplasticactivity
Liyuanyuan1,2,Pengtingwen2,Lvyuhong3,Baoyuxin1,Shaomeiyun1,Luoxiantao2,Zenglingrong2,Yuechangwu1
( 1.Research Center for Medicine Biology, Zunyi Medical University, Guizhou Key Laboratory of Characteristic Microbial Resources & Drug Development, Guizhou Zunyi 563099, China; 2. Pharmacy School of Zunyi Medical University, Guizhou Zunyi 563099, China; 3. Department of Basic Chemistry, Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo isolate and screen Endophytic bacteria those manifest antibacterial activity and antineoplastic activity.MethodsThe tissues of medicinal plants including Radix et Rhizoma Rhei,Roxburgh Rose, Eucommia ulmoides,Oliver, Radix Paeoniae Alba, Radix et Caulis Acanthopanacis Santicosi were collected from Guizhou Province. Endophytic bacteria were isolated by GYM medium and TWYE medium after sterilized and homogenized. The antibacterial activity of fermentation products of all Endophytic bacteria isolated were screened by the test strains ofE.coliDSM 1103,Streptococcus,StaphylococcusaureussubspaureusDSM 1104 andMicrococcusluteusCGMCC 1.2156 and antineoplastic activity were screened by the model of Pyricularia oryzae. Further study about the fermentation products were did by HPLC.Results134 strains were isolated. 46 of them (34.33%) manifest different antibacterial activity,and 58 strains (32.22%) manifest different antineopolastic activities.ConclusionThe Endophytic bacteria of the 5 medicinal plants are very rich and have good antibacterial activity and antineoplastic activity. They are candidates of the study to develop new antibacterial and antineoplastic drugs.
madicinal plants;endophytic actinomycetes;fermentation products;antibacterial activity;antineoplastic activity
国家自然科学基金项目(NO:31160004);贵州省教育厅特色重点实验室建设项目(NO:黔教合KY字[2012]011);贵州省科技学技术基金项目(NO:黔科合J字[2010]2156);(NO:黔科合J字[2012]2348);(NO:黔科合SY字[2013]3013)。
岳昌武,男,博士,副研究员,硕士生导师,研究方向:微生物天然产物生物合成,E-mail:changwuyue@126.com。
Q93
A
1000-2715(2013)05-0432-05
[收稿2013-06-08;修回2013-08-24]
(编辑:谭秀荣)
