非霍奇金淋巴瘤中p16基因突变与MSI的关系
2013-10-27李龙萍匡小燕
李龙萍, 匡小燕,邓 飞
(1.贵阳市第五人民医院 病理科,贵州 贵阳 550004,2.遵义医药高等专科学校附属医院 病理科,贵州 遵义 563002,3.遵义医学院附属医院,贵州 遵义 563099)
非霍奇金淋巴瘤中p16基因突变与MSI的关系
李龙萍1, 匡小燕2,邓 飞3
(1.贵阳市第五人民医院 病理科,贵州 贵阳 550004,2.遵义医药高等专科学校附属医院 病理科,贵州 遵义 563002,3.遵义医学院附属医院,贵州 遵义 563099)
目的研究p16基因突变与微卫星不稳定性(Microsatellite instability MSI) 在非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma NHL)发生发展中的作用,探讨p16基因内外显子1、2(exon1、exon2)的分子遗传学改变与非霍奇金淋巴瘤的关系。方法采用PCR-SSCP法对40例已确诊NHL进行p16基因外显子1、2的突变研究;选取p16基因内部微卫星位点D9S265,D9S259,D9S161,D9S169对MSI进行检测。结果40例NHL中,P16基因总突变率为35.0%(14/40),位点D9S161、D9S259的MSI组的P16的突变率明显高于MSI阴性组,而D9S265和D9S169则与之相反(P>0.05),D9S259、D9S161、D9S265外显子2的突变和缺失率均高于外显子1。结论①NHL中存在较高p16基因突变率和MSI,提示其突变和MSI可能参与NHL的发生、发展;②通过统计分析,微卫星位点的MSI主要影响p16基因外显子2的突变和缺失;③微卫星位点D9S161和D9S169与p16基因的关系较紧密。
非霍奇金淋巴瘤;p16基因;微卫星不稳定性
非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma NHL)是淋巴造血系统中一种常见的恶性肿瘤,占所有淋巴瘤的80%~90%[1]。我国NHL发病率和死亡率约占全部恶性肿瘤的3%~5%,为恶性肿瘤第八位[2]。其发病率近20多年来在世界各国明显上升, 但是近年来,淋巴瘤肿瘤细胞微卫星的表达逐渐引起了人们的注意。研究证实,某些染色体的单纯易位并不能导致恶性表型,可能有其他因素的协同作用,微卫星不稳定性(Microsatellite instability MSI)可能是其中因素之一。抑癌基因位点附近常频发微卫星DNA不稳定性的改变[3]。在非霍奇金淋巴瘤中,有关p16基因外显子1、2及其附近/内部微卫星位点MSI的研究与两者相关性研究国内外尚无报道。
1 材料与方法
1.1 资料来源 来自遵义医学院附属医院病理科2004年4月至2007年12月的各型NHL挡案材料40例, 按2001年WHO分类[4]淋巴造血组织肿瘤分类,所有病例经病理组织学及免疫组织化学检查确诊。按细胞来源分:T和NK细胞肿瘤13例,B细胞肿瘤27例;按生物学分:惰性组4例,侵袭性组32例,高侵袭性组4例,所有标本均为4%福尔马林固定,石蜡包埋的组织。
1.2 石蜡组织DNA 提取 提取DNA主要试剂购于上海生工生物技术有限公司。组织块大且坏死少者常规脱蜡后采用常规蛋白酶K消化,酚—氯仿—异戊醇抽提,盐沉淀法提取石蜡组织DNA ,反之用粗提法:常规脱蜡后加入裂解液和蛋白酶K55 ℃过夜,待组织溶解后灭活蛋白酶K,吸上清液做PCR模板。核酸测定仪上测定DNA浓度及比值A260/ A280 ,比值<1.6者弃用重提。
1.3 p16基因突变分析
1.3.1 p16 exon1、exon2DNA引物序列及扩增DNA的长度(见表1)。
选取p基因内部微卫星位点多态标记4个。引物序列、扩增片段长度(见表2)。
表1 p16 exon1、exon2DNA引物序列及所扩增的DNA的长度
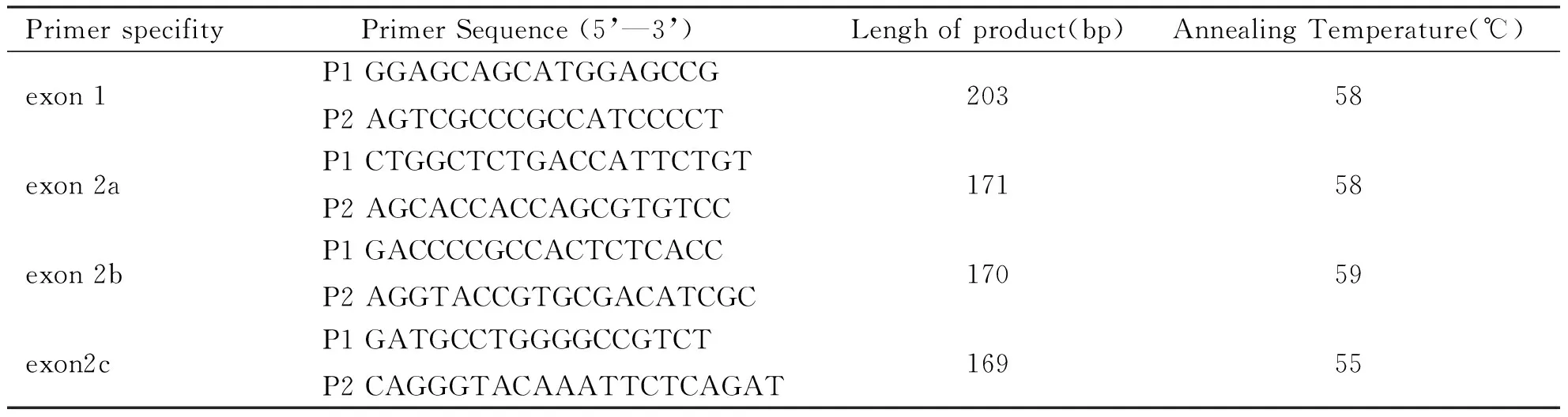
PrimerspecifityPrimerSequence(5’—3’) Lenghofproduct(bp)AnnealingTemperature(℃)exon1P1GGAGCAGCATGGAGCCGP2AGTCGCCCGCCATCCCCT20358exon2aP1CTGGCTCTGACCATTCTGTP2AGCACCACCAGCGTGTCC17158exon2bP1GACCCCGCCACTCTCACCP2AGGTACCGTGCGACATCGC17059exon2cP1GATGCCTGGGGCCGTCTP2CAGGGTACAAATTCTCAGAT16955
注:P1:indicates forward; P2:indicates reverse。
表2 p16基因内部微卫星位点序列及扩增片段长度
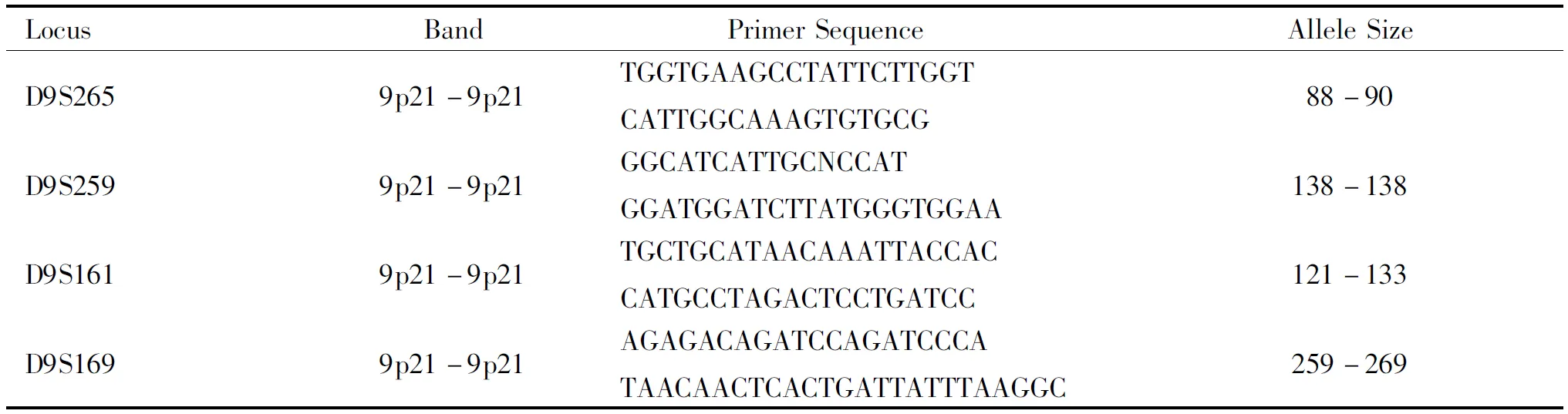
LocusBandPrimerSequence AlleleSizeD9S2659p21-9p21TGGTGAAGCCTATTCTTGGTCATTGGCAAAGTGTGCG88-90D9S2599p21-9p21GGCATCATTGCNCCATGGATGGATCTTATGGGTGGAA138-138D9S1619p21-9p21TGCTGCATAACAAATTACCACCATGCCTAGACTCCTGATCC121-133D9S1699p21-9p21AGAGACAGATCCAGATCCCATAACAACTCACTGATTATTTAAG-GC259-269
注:P1:indicates forward; P2:indicates reverse。
p16基因外显子1、2(exon1、exon2)扩增条件:
PCR 反应体系为50μL,其中10×Buffer 5μL,MgCl2(25 mmol/L)1.8~2.5 μL,0.5 μM上游及下游引物,dNTP(dATP,dCTP,dGTP,dTTP,10 mM each)1 μL,基因组DNA 3 μL,Taq酶2U,不足50 μL的加超纯水补足。反应条件:95 ℃预变性5 min,于4 min时加Taq酶;94 ℃变性45 s;退火 1min;72 ℃延伸1 min,72 ℃后延伸5 min,4 ℃保存备用。以双蒸水代替模板做空白对照。
D9S265、D9S259、D9S161、D9S169扩增条件:
反应体系共50 μL,加入10×Buffer5 μL, MgCl2(25 mmol/L) 4 μL,0.5 μM上游及下游引物,dNTP(dATP,dCTP,dGTP,dTTP,10 mM each) 1 μL,基因组DNA 3 μL,Taq酶2U,不足50 μL的加超纯水补足。反应条件:95 ℃预变性5 min,于4 min时加Taq酶,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,72 ℃延伸5 min,4 ℃保存。(PTC-100TM)。每组PCR扩增设置无模板对照(空白对照),以超纯水代替模板组DNA。引物、10×PCR buffer、dNTP、MgCl2及扩增条件等均与研究组相同,以排除基因组DNA污染的可能。
2 结果
2. 1 p16 基因突变情况 40例NHL中有14例标本的p16基因组DNA存在异常迁移率带(以exon2b为例,见图1、2) ,表明这些肿瘤可能存在p16基因突变。
2. 2 不同分型NHL中p16突变率 总突变率为35.0%(14/40),T和NK细胞组和B细胞组突变率无统计学意义(P>0.05),按惰性组、侵袭性组、高侵袭性组进行统计分析组间差异无统计学意义(P>0.05)(见表1、表2)。分析p16外显子1、2在40例淋巴瘤组织中的突变率(见表4)。
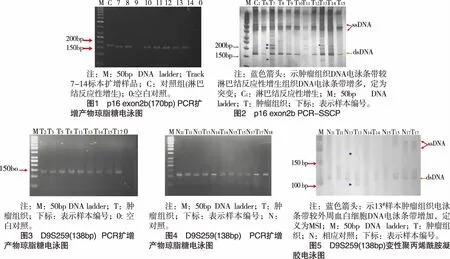
2. 3 四个位点 MSI的总阳性率为50.0%(20/40),(见图3~5),从表6可知,各位点MSI、频率介于12.5%~27.5%,其中D9S259位点MSI频率最高为27.5%,D9S161位点MSI频率最低为12.5%。
表3 p16基因突变与细胞来源的关系

细胞来源P16基因突变+-合计T和NK细胞4913B细胞101727合计142640
注:Fisher’s exact test in 2×2table,P=0.972。
表4 p16基因突变与生物学行为的关系

生物学行为P16基因突变+-合计惰性134侵袭性102232高侵袭性224合计142640
注:Fisher’s exact test in 2×2table,P=1.000。
2. 4 不同微卫星位点 MSI与p16突变的相关性,从表7可知:D9S259位点的MSI阳性组p16突变率最高为57.1%。D9S169位点MSI阳性组p16突变率最低为27.3%。D9S161和D9S259位点MSI阳性组的p16突变率均高于MSI阴性组,而D9S265和D9S169则与之相反(P>0.05)。
表5 p16基因各外显子在40例非霍奇金淋巴瘤组织中的突变情况
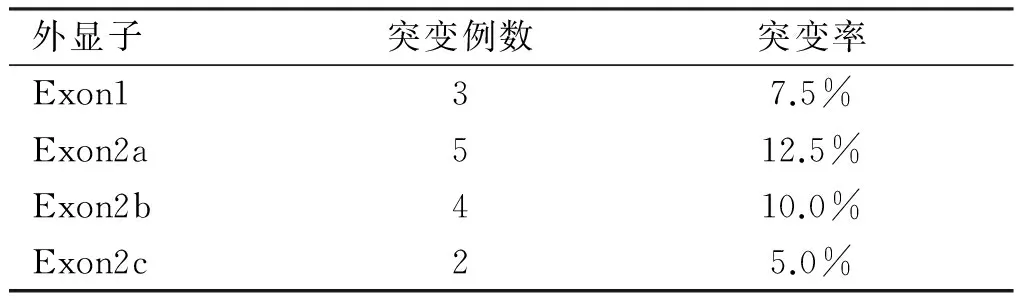
外显子突变例数突变率Exon137.5%Exon2a512.5%Exon2b410.0%Exon2c25.0%
表6微卫星DNA多态性标记的MSI发生率

Locusinformationnumberofnon-HodgkinlymphomaMSIcase(percent)D9S265409(22..5%)D9S2594011(27.5%)D9S161405(12.5%)D9S169407(17.5%)
表7 NHL微卫星位点MSI与p16总突变的比较
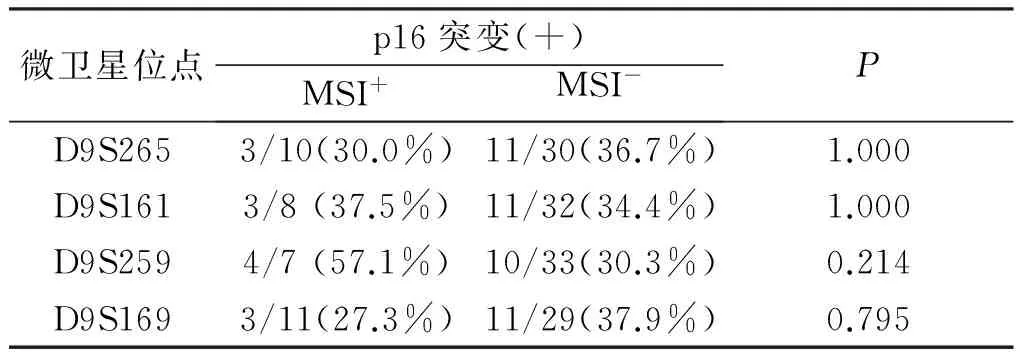
微卫星位点p16突变(+)MSI+MSI-PD9S2653/10(30.0%)11/30(36.7%)1.000D9S1613/8(37.5%)11/32(34.4%)1.000D9S2594/7(57.1%)10/33(30.3%)0.214D9S1693/11(27.3%)11/29(37.9%)0.795
注:分子表示p16突变(+)例数,分母表示MSI+或MSI-例数,括号内数字表示突变率(%),P值采用确切概率法计算。
2.5 各微卫星位点MSI+/MSI-分别对p16外显子1和2的影响,由表8可知:在D9S259位点上的MSI阳性组中,p16基因exon1与exon2突变和缺失率均为最高,分别为28.6%和57.1%,在D9S259与D9S161位点上外显子2的突变和缺失率均高于外显子1。各位点MSI阳性组的p16外显子1、2突变和缺失率与阴性组间比较无显著性差异(P>0.05)。
表8 NHL各微卫星位点MSI与p16exon1-2改变(突变和缺失)的比较
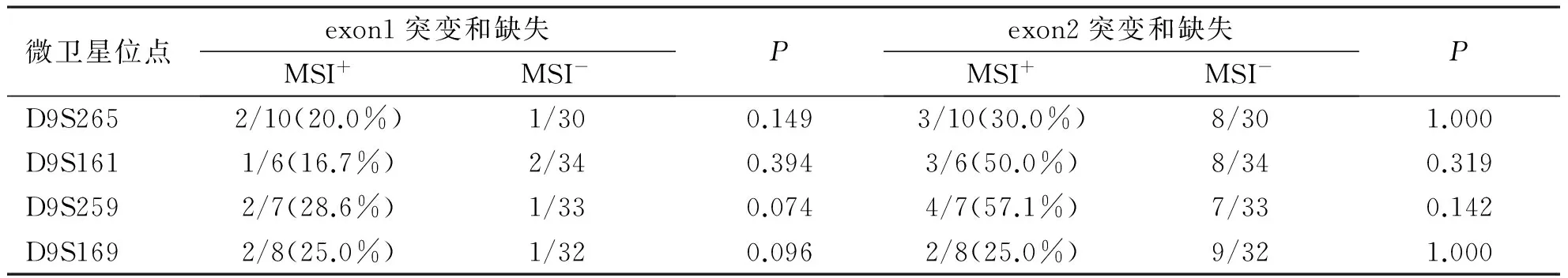
微卫星位点exon1突变和缺失MSI+MSI-Pexon2突变和缺失MSI+MSI-PD9S2652/10(20.0%)1/300.1493/10(30.0%)8/301.000D9S1611/6(16.7%)2/340.3943/6(50.0%)8/340.319D9S2592/7(28.6%)1/330.0744/7(57.1%)7/330.142D9S1692/8(25.0%)1/320.0962/8(25.0%)9/321.000
注:分子表示p16突变和缺失例数,分母表示MSI+或MSI-例数,括号内数字表示突变和缺失率(%),P值采用确切概率法计算。
3 讨论
p16基因是近年发现的直接参与细胞生长增殖负调控的抑癌基因,位居染色体9p21,编码一个相对分子量16 000的多肽[5],可以在多种肿瘤中发生失活,在多数细胞系中,p16基因等位缺失是其主要的失活机制[6],造血系统恶性肿瘤p16基因失活状态也受到了人们的关注,但有关p16基因失活方式及发生率的报道结果较不一致[7-8]。基因组不稳定是肿瘤细胞的基本特征。基因组不稳定有两种形式,一种是由肿瘤抑制基因(tumor-suppressing gene, TSG)失活引起的肿瘤抑制途径[9-10],另一种是由DNA错配修复系统功能缺陷引起复制错误型(RER+)[11],表现为MSI。
目前国内外有关MSI在非霍奇金淋巴瘤中的研究报道不多,有报道表明近83%的粘膜相关淋巴组织淋巴瘤(mucous-associated lymphoid tissue Lymphoma, MATL)和100%的胃大淋巴细胞性淋巴瘤中有一个或多个位点出现MSI,在CD30阳性的皮下淋巴组织增生的过程中及淋巴母细胞淋巴瘤中也检出MSI,并发现MSI在肿瘤的转化过程中及某些类型的肿瘤的早期诊断方面有重要作用。
本课题对40例非霍奇金淋巴瘤进行研究,探讨肿瘤发生发展过程的肿瘤抑制基因途径和微卫星不稳定途径及其两者之间的关系,观察到了:①非霍奇金淋巴瘤中存在p16基因突变和缺失;p16基因的异常可能参与了非霍奇金淋巴瘤的发生与进展;②非霍奇金淋巴瘤中存在微卫星DNA的不稳定性,MSI可能参与了非霍奇金淋巴瘤的发生与进展;③微卫星位点D9S169与D9S161可能是p16基因附近与p16基因关系较密切的微卫星位点,即p16基因可能是D9S169与D9S161微卫星不稳定性的靶基因。证实了抑癌基因位点附近常频发微卫星DNA不稳定性的改变。通过检测MSI不仅有助早期发现某些恶性肿瘤和高危人群,而且有助于进行早期防治。
[1] 李甘地. 病理学[M] . 北京:人民卫生出版社,2001:275.
[2]Hodges K B, Vnencak-Jones,C L , Larson R S , et al. Rari-ty of genomic instability in pathogenesis of systemic anaplastic large cell lymphoma (ALCL) in immunocompetent patients[J ]. Hum Pathol,1999,30(2):173-177.
[3]Yamamoto H, Aawei H, Perucho M. Frameshift somatic mutations in gastrointestinal cancer of the microsatellite mutator phenotype[J].Cancer Res,1997,57(19):4420-4426.
[4]Jaffe E S, Harris N L, Stein H, et al.Patholory and genetics of tumours of haematopoietic and lymphoid tissues. WHO classification of tumours[J].Lyon,2001:11-25.
[5]Fischer C A, Kampmannn M,Zlobec I.p16 expression in oropharngeal Cancer: its impact on staging and prognosis compared with the conven- tional clinical staging parameters [J].Ann Oncol,2010,21(10):1961-1966.
[6]许良中,邓 飞.现代恶性淋巴瘤病理学[M].上海:上海科学技术文献出版社,2002:127.
[7]Galm O, Wilop S,Luders C,et al.Clinicl limplications of aberrant DNA methylation pattems in acute myelogenous leukemia[J].AnnHematol,2005,84(1):39-46.
[8]Hsiao P C,LiuM C,ChenL M,et al.Promoter methylation of p16 and EDNRB genein leukemia Patients in Taiwan[J]. J Chin Physiol,2008,51(1):27-31.
[9]Otsuki T, Clark H M, Wellman A, et al. Involvement of CDKN2 (p16INK4A/MTS1) and p15INK4B/MTS2 in human leukemias and lymphomas[J].Cancer Res, 1995,55: 1436.
[10]Gombart A F, Morosetti R, Miller C W, et al.Deletions of the cyclin-dependent kinase inhibitor genes p16INK4A and p15INK4B in non-Hodgkin’s lymphomas[J].Blood,1994,86:1534.
[11]Dreyling M H, Bohlander S K, Le Beau M M,et al.Refined mapping of genomic rearrangements involving the short arm of chromosome 9 in acute lymphoblastic leukemias and other hematologic malignancies[J].Blood,1995, 86: 1931-1934.
Astudyofp16genemutationsandmicrosatelliteinstabilityinNon-Hodgkin’slymphomas
Lilongping1,Kuangxiaoyan2,Dengfei3
(1.Department of Pathology,The Fifth People’s Hospital of Guiyang City, Guizhou Guiyang 550004,China;2.Department of Pathology,The Affiliated Hospital of Zunyi City Pharmaceutical College, Guizhou Zunyi 563002,China;3.Department of Pathology,The Affiliated Hospital of Zunyi Medical University,Guizhou Zunyi 563099,China)
ObjectiveTo evaluate the role of p16 gene mutation and microsatellite instability(MSI) in pathogenesis of non-Hodgkins lymphomas (NHL),Discussion within the p16 gene exon-l, exon 2 changes in molecular genetics and non-Hodgkin’s Lymphoma relations.Methods40 cases of Non-Hodgkin’s lymphoma have been confirmed for frequency of p16 gene mutation in exon 1 to 2 with PCR-SSCP method; four microsatellite locus (D9S265、D9S259、D9S161、D9S169) whithin the p16 gene were used for analyzing MSI in all cases.ResultsIn 40 cases of Non-HodgKin’s lymphoma, the frequency of p16 genic mutation was 35%(14/40). Compared with the negative group, both D9S161 and D9S259 positive of MSI had a higher point mutation in p16 gene, while the other two loci were on the contrary (P>0.05).Mutation and deletion of D9S259、D9S161、D9S265 exon 2 were higher than the exon-1.Conclusion① High mutation rate of P16 gene and MSI existed in non-HodgKin Lymphomas, it was shown that mutation in p16 gene and MSI might play a key role in the non-Hodgkin LLymphomas.②Through statistical analysis, MSI in the four loci were mainly influenced by mutation and deletion of p16 gene exon 2.③ It could be concluded that the relationship between p16 gene and D9S161, D9S169 were closely related.
non-Hodgkin’s lymphoma;p16 gene;microsatellite instability
国家自然科学基金资助项目( NO:30160030)。
邓飞,男,博士,教授,研究方向:霍奇金淋巴瘤的致病机理及冶疗,E-mail:2323853378@qq.con。
R735.2
A
1000-2715(2013)05-0417-05
[收稿2013-05-17;修回2013-08-12]
(编辑:谭秀荣)
