成年小鼠心脏干细胞的体外分离及表型鉴定
2013-10-27邓文文赵然尊龙仙萍
邓文文,赵然尊,龙仙萍,石 蓓
(遵义医学院附属医院 心血管内科, 贵州 遵义 563099)
成年小鼠心脏干细胞的体外分离及表型鉴定
邓文文,赵然尊,龙仙萍,石 蓓
(遵义医学院附属医院 心血管内科, 贵州 遵义 563099)
目的建立稳定的小鼠心脏干细胞(cardiac stem cells,CSCs)分离方法,并对体外培养的CSCs进行生物学特性鉴定。方法选用健康成年CD1小鼠,在无菌条件下取心脏并剪碎,并用II型胶原酶和胰蛋白酶反复消化,采用差速离心法去除混合细胞悬液中的心肌细胞,结合免疫磁珠分选法纯化c-kit+CSCs后,进行流式细胞仪表面标记鉴定。结果酶消化法和磁珠分选法结合成功分离并纯化了成年小鼠c-kit+CSCs。磁珠分选前,流式细胞仪表面标记鉴定c-kit+CD34-CSCs为4.62%;经磁珠分选后c-kit+CD34-CSCs可达70.23%。结论酶消化法结合磁珠分选法能成功分离纯化成年小鼠c-kit+CSCs,且能用于后续体外培养。体外培养时c-kit+CSCs相对于其它表型标记的心脏干细胞更加稳定,具有较强的扩增能力。相对于心脏组织块培养法,酶消化法可在短期内获得高纯度的c-kit+CSCs,更有助于心脏干细胞相关信号通道的体外实验研究。
心脏干细胞;细胞分离;酶消化法;磁珠分选法;小鼠
在成年哺乳动物的心脏组织内,心脏干细胞数量较少,分离较为困难[1]。而临床治疗需要大量的CSCs,这就使得CSCs的临床应用受到极大的限制。迄今为止,CSCs的分离方法甚至不能完全满足CSCs的相关研究。目前主要有两种方法用于分离鼠和人CSCs,一种是酶消化法[2],另一种是原代组织贴壁培养法[3]。最近,S.H.choi及其同事首次证实了,尽管上述两种方法最终所得到的c-kit+CSCs细胞数量大致相同,然而,酶消化法所获得的CSCs具有更高的增殖潜能,更能满足临床治疗对干细胞数量的需求,且酶消化法所获得的CSCs表面的c-kit表达量更高[4]。本课题组经过探索已形成较为稳定的酶消化法分离CSCs,可为CSCs修复受损心脏的临床治疗策略提供可靠的实践依据。
1 材料与方法
1.1 实验动物 随机选择清洁级成年CD1小鼠,体重60~100 g,雌雄不限,购自第三军医大学实验动物中心。
1.2 实验试剂和药品 II型胶原酶(Sigma-Aldrich)、0.25%胰蛋白酶(不含EDTA,Hyclone)、DMEM高糖培养基(GBICO)、优质胎牛血清(Fetal bovine serum, FBS, Hyclone)、青链霉素双抗(索莱宝)、包被羊抗兔二抗的磁珠(Dynal Biotech,M-280),兔抗小鼠c-kit抗体(Santa Cruz),PE标记的大鼠抗小鼠c-kit抗体及其同型对照(eBioscience),FITC标记的大鼠抗小鼠CD34抗体及其同型对照(eBioscience),小鼠白血病抑制因子(Leukemia inhibitory factor, LIF, Sigma-Aldrich),小鼠碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF, Sigma-Aldrich),小鼠表皮生长因子(epidermal growth factor, EGF, Sigma-Aldrich),无钙镁的PBS缓冲液(Cambrex)。
1.3 主要实验仪器 超净台(苏州苏洁净化),数显恒温水浴箱(上海乔跃),离心机(Thermo ),垂直混合仪(宁波新芝),磁力架(Dynal Biotech),CO2孵育箱(Thermo ),倒置相差显微镜(Olympus),流式分选仪(BD)。
1.4 细胞分离 采用酶消化法结合磁珠分选法分离c-kit+ CSCs。方法如下:首先,小鼠全身肝素化后行颈椎脱臼处死,用75%酒精进行浸泡消毒,在超净台中迅速取出心脏。用不含钙镁离子的PBS反复冲洗心脏,去除心腔内的余血。在无血清高糖DMEM培养基中迅速充分剪碎心脏。其次,将剪碎的心脏组织碎块置于玻璃摇瓶中,加入含0.05%Ⅱ型胶原酶和 0.05% 胰蛋白酶的PBS 10 mL,恒温37 ℃不断摇晃消化。待瓶中的心脏组织块呈白色纤维状时停止消化。在超净台内用吸管轻轻吹打消化后的细胞悬液,用细胞筛过滤悬液以去除未被消化的心肌组织及部分心肌细胞,收集过滤后的细胞悬液,以500 rpm 离心3 min,轻柔取上清以1 500 rpm离心10 min,弃上清,利用细胞不同的沉降系数,进一步去除细胞悬液中的心肌细胞。加入含1%FBS的DMEM高糖培养基重悬细胞沉淀物,并进行细胞计数。随后,在细胞悬液中加入兔抗大鼠c-kit抗体(根据细胞计数决定所加抗体的量,1∶250),并置于垂直混合仪上4 ℃旋转孵育1 h,离心,弃上清并重悬,随后用羊抗兔二抗包被的2.8 μm 磁珠(1∶150)孵育细胞悬液,置于垂直混合仪上4 ℃旋转孵育30 min。随后直接把装有细胞悬液的离心管置于DYNAL 磁力架中,2~3 min后可见靠近磁力架的管壁有一排棕褐色颗粒,用1mL注射器轻轻快速吸去管中的液体,重悬管壁上的棕褐色颗粒(磁珠为棕褐色),再将离心管置于磁力架上,重复上一步骤。磁力分选完成后,进行细胞计数,并用含15%FBS、10 ng/mL LIF、20 ng/mL bFGF、10 ng/mL EGF 和1%青-链霉素的高糖DMEM培养基(mNSCM,即改良神经干细胞培养基)进行培养。
1.5 流式细胞鉴定 分别取未经磁珠分选和经磁珠分选但未经完全培养基培养的CSCs进行流式细胞鉴定。取约2×106个细胞用无血清的DMEM高糖培养基制成200 μL细胞悬液,分装成两管,各100 μL。在一管中加入2 μL PE标记的大鼠抗小鼠c-kit IgG2a抗体和2 μL FITC标记的大鼠抗小鼠CD34 IgG2b抗体,在另一管中加入2 μL PE标记的大鼠抗小鼠同型对照IgG2a抗体和2 μL FITC标记的大鼠抗小鼠同型对照 IgG2b抗体,混匀后置于4 ℃避光孵育90 min,随后用2 mL PBS洗涤细胞,以1 500 rpm 离心10 min,弃上清,重复洗涤一次。每管中分别加入1%多聚甲醛100μL,吹打混匀,避光后行流式细胞仪检测。
2 结果
2.1 细胞形态 在倒置相差显微镜下观察免疫磁珠分选所得的细胞为圆形、体积小而明亮,直径为4~10 μm(见图1A)。
2.2 流式细胞仪鉴定 所采用的鉴定CSCs的方法是通过流式细胞仪检测其表面标记物。流式细胞分析结果显示,未经磁珠分选的细胞中表型为c-kit+CD34-的细胞达4.62%(见图1B);经免疫磁珠分选但未经mNSCM培养基培养的细胞中表型为c-kit+CD34-的细胞达70.23%(见图1C)。
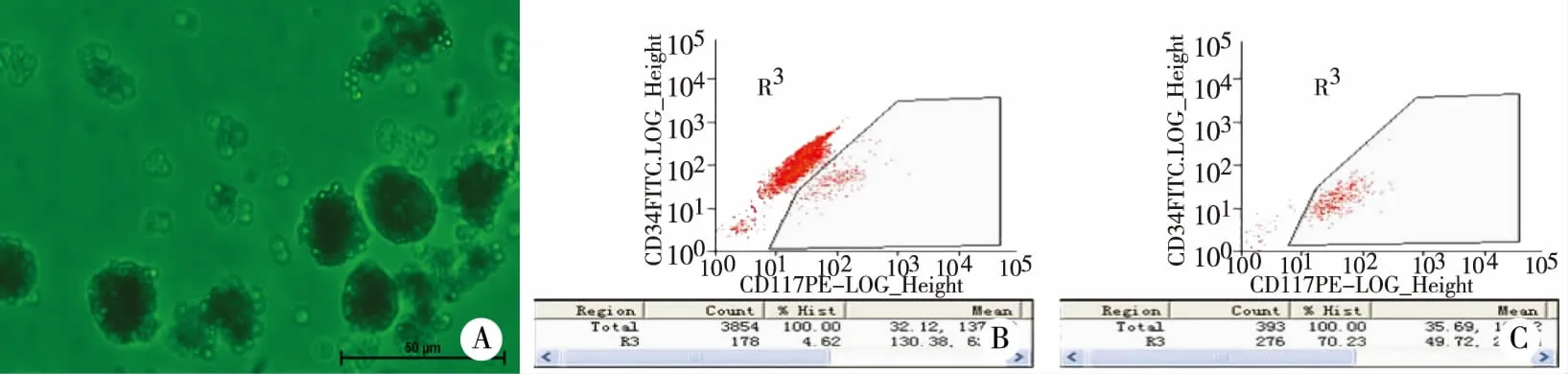
注:A:免疫磁珠分选法分选的心脏干细胞,小而亮,呈圆形,心脏干细胞表面附有数个小磁珠(×400); B :流式细胞仪分析结果显示采用酶消化法获得的细胞在免疫磁珠分选前表型为c-kit+CD34-CSCs达4.62%; C: 流式细胞仪分析结果显示采用酶消化法获得的细胞经免疫磁珠分选但未经mNSCM培养表型为c-kit+CD34-CSCs达70.23%。 图1 c-kit+心脏干细胞及其流式细胞鉴定图
3 讨论
急性冠脉综合征是当今老龄化社会心血管事件的主要死因。缺血性心脏病可引起心肌梗死并减少心肌细胞的数量。慢性高血压也可使心肌细胞过度丢失[5]。最新研究表明,年轻人的心肌细胞可再生。心肌细胞再生速率在婴儿期最高,之后开始下降,在青少年发育急速期再次升高并持续到20岁左右[6]。但事实上,冠心病的发病人群年龄多在40岁左右,其心肌细胞的细胞周期停留在G0期,并不能继续增殖[7]。目前,大量研究证实心脏小生境中存在心脏干细胞,其能分化为心肌细胞、内皮细胞和平滑肌细胞[8-9]。体外移植CSCs (cardiac stem cells)可显著改善恶化的心功能,这主要依赖于CSCs分化形成的新生血管和心肌细胞对受损的心脏具有修复功能[10-11]。最近研究显示,将外源性心脏干细胞移植至心梗后30 d的大鼠心脏内,可激活内源性心脏干细胞,从而改善左室功能失调[12]。此外,心肌梗死小鼠心脏内注射心脏球形干细胞后,心脏球形干细胞通过分泌生长因子发挥旁分泌作用对存活的心肌细胞具有抗凋亡作用[13]。近期的1期临床试验结果也表明,移植自体CSCs可显著改善缺血性心肌病患者的心功能[14]。总之,CSCs具有直接再生和旁分泌作用,因而被认为是心脏再生治疗的最佳干细胞源之一。
心脏干细胞的出现为心肌再生和心肌梗死的治疗提供了新的希望。但是,包括CSCs在内的成年动物来源的干细胞在体外扩增方面具有局限性,若进行心血管疾病的干细胞治疗,必须克服这一问题。目前用于分离心脏CSCs的方法主要有酶消化法和组织块贴壁培养法。综合本课题组及其他实验室报道[2-4],酶消化法获得CSCs实验周期短;而组织块培养法获得CSCs周期长,至少2~3周后方可传代,且所获得的心脏球形干细胞大多为Sca-1+CSCs。总之,CSCs的分离方法中,酶消化法较组织块贴壁培养法具有更佳的临床应用前景。
在酶消化法中,酶的选择和消化条件的控制至关重要。本课题组选用的是0.05% II型胶原酶和0.05% 胰蛋白酶。尽管有研究表明,0.1%胶原酶可使心脏组织中的心肌细胞致死。将心脏组织块置于37 ℃、0.1%胶原酶作用30min以上,绝大多数心肌细胞都会死亡[10]。但本实验台盼蓝染色计数显示高浓度的II型胶原酶在强力去除心肌细胞的同时,也使心脏干细胞活力下降甚至死亡。0.05%的低浓度胰蛋白酶消化液对细胞作用适中,且对干细胞表明标记物损伤较小。酶消化温度需控制在37 ℃,温度过低消化不充分,过高则会增加胰蛋白酶的毒性从而影响细胞的活力。同时,需不断地轻轻摇晃,使混合酶液与心脏组织碎块表面充分接触,促进消化。酶消化法结合免疫磁珠分选法可以从细胞混合物中分离出高纯度的细胞,具有分离纯度高、细胞处理量大及分选速度快的优点。在本试验中,将结合免疫磁珠的细胞悬液置于Dynal磁力架中2~3 min即可分选出阳性细胞,该磁力架无需附加磁力柱,可在一定程度上缩短分选时间。
本实验采用流式细胞仪对所获得的心脏干细胞的细胞表面标记物进行鉴定。但是,目前看来,关于心肌干细胞表面标志物,尤其是较为特异的标志物,意见并不统一。Messina研究发现,在心肌干细胞培养的早期,它可以表达KDR/flk-1、CD31、c-kit和Sca-1等,随着细胞的成熟,许多表面标记逐渐消失,c-kit是唯一的不随细胞成熟而消失的表面标记[3]。c-kit,又称为CD117或干细胞生长因子受体,表达于CSCs及其它类型干细胞(如骨髓造血干细胞)的胞膜表面。C-kit是一种II型酪氨酸激酶受体,其与干细胞生长因子(SCF)结合后可促进干细胞的生存、动员和增殖[15]。Anversa比较分析发现在心肌梗死或缺血/再灌注损伤中与Sca-1+CSCs相比,C-kit+CSCs的心脏修复能力较强[16]。因此,本课题组选取c-kit为心脏干细胞鉴定的主要标记。CD34是骨髓干细胞系分子标记物。我们推测从心脏分离出来的干细胞,亦不能够排除来源于血液和骨髓细胞迁移的可能。这些细胞刚刚定居于心脏内,处于未分化状态,尚未失去骨髓源干细胞标记物,而且骨髓干细胞也表达c-kit。因此,我们用流式细胞仪鉴定了c-kit+CD34-CSCs的细胞比例。
我们用免疫磁珠分选未经完全培养基培养的细胞进行流式细胞鉴定,有70.23%的心脏细胞为c-kit阳性CD34阴性,这意味着该方法所得到的细胞中,有70.23%的细胞属于心脏干细胞。这一结果充分说明,改良后的此方法可获得较纯的心脏干细。对其余不足30%的细胞来说,存在有以下可能:①暂时未表达c-kit,因为心脏干细胞中c-kit的表达存在着时限性。Messina等人研究表明,心脏干细胞表面c-kit的表达由培养第1天的10%至培养第6天上升至30%以上[4]。因此,我们推测,鉴于本实验将所得的心脏细胞在免疫磁珠分选后即刻便行流式细胞仪鉴定其c-kit表达,有可能部分心脏干细胞细胞表面尚未表达c-kit。②未用mNSCM培养基进行培养。mNSCM培养基中含有LIF和bFGF,适宜浓度的LIF和bFGF可在心脏干细胞增殖过程中维持心脏干细胞的多分化潜能状态。同时,由于酶消化法分离培养的内源性心脏干细胞中常带有成纤维细胞等杂细胞,在培养过程中,心脏干细胞为悬浮细胞,利用差速贴壁分离法,可以去除这些易于贴壁的杂细胞,进一步提高了c-kit+CSCs的纯度。③c-kit阴性的心脏干细胞。不是所有心脏干细胞都表达c-kit,c-kit也并不是心脏干细胞的唯一鉴定标记。只是随着心脏干细胞细胞的成熟,许多干细胞表面标记逐渐消失,c-kit是唯一的不随心脏干细胞细胞成熟而消失的表面标记[3]。采用其他的心脏干细胞表面标记如Sca-1等予以鉴定也许可以得到不同成熟程度的心脏干细胞。
鉴于冠心病的发病人群是40岁以上中老年人群,因此,本课题从成年鼠心脏中分离心脏干细胞将在一定程度上缩短实验研究结果与临床应用的距离。尽管Beltrami及其同事在10年前发现了心脏干细胞的存在,目前仍需开展大量实验研究进一步探索CSCs的生物学特性,并在此基础上进行相应的临床研究,尽早地将心脏干细胞治疗心血管疾病这一治疗策略,安全有效地应用于临床治疗,早日攻破人类心脏再生修复这一难题。
[1] Antonio P.Beltrami, Laura Barlucchi, Daniele Torella, et al. Adult cardiac stem cells are multipotent and support myocardial regeneration [J].Cell, 2003, 114(6):763-776.
[2]Bearzi C, Rota M, Hosoda T, et al. Human cardiac stem cells [J]. Proc Natl Acad Sci, 2007, 104(35):14068 -14073.
[3]Messina E, De Angelis L, Frati G, et al. Isolation and expansion of adult cardiac stem cells from human and murine heart [J]. Circ Res, 2004, 95(9): 911-921.
[4]S.H.Choi, S.Y.Jung, W.Suh, et al. Establishment of isolation and expansion protocols for human cardiac c-kit-positive progenitor cells for stem cell therapy [J]. Elsevier Inc, 2013, 45(1):420-426.
[5]Dorn GW 2nd. Apoptotic and non-apoptotic programmed cardiomyocyte death in ventricular remodelling [J]. Cardiovasc Res, 2009, 81(3): 465-473.
[6]Mollova M, Bersell K, Walsh S, et al. Cardiomyocyte proliferation contributes to heart growth in young human [J]. Pro Natl Acad Sci USA, 2013, 110(4): 1446-1451.
[7]Kastrup J. Stem cells therapy for cardiovascular repair in ischemic heart disease: how to predict and secure optimal outcome [J]. EPMA J, 2011, 2(1): 107-117.
[8]Bu L, Jiang X, Martin-Puig S, et al. Human isl1 heart progenitors generate diverse multipotent cardiovascular cell lineages [J]. Nature, 2009, 460(7251): 113-117.
[9]Urbanek K, Cesselli D, Rota M, et al. Stem cell niches in the adult mouse heart [J].Proc Natl Acad Sci USA, 2006, 103: 9226-9231.
[10]Frati C, Savi M, Graiani G, et al. Resident cardiac stem cells [J]. Curr Pharm Des, 2011, 17(30): 3252-3257.
[11] Choi S H,Jung S Y,Kwon S M, et al. Perspectives on stem cell therapy for cardiac regeneration: advances and challenges [J]. Circ J, 2012, 76(6):1307-1312.
[12]Tang X L, Rokosh G, Sanganalmath S K,et al.Intracoronary administration of cardiac progenitor cells alleviates left ventricular dysfunction in rats with a 30-day-old infarction [J]. Circulation, 2010, 121(2): 293-305.
[13]Chimenti I, Smith R R, Li T-S,et al.Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice [J]. Circ Res, 2010, 106(5): 971-980.
[14]Bolli R, Chugh A R,D’Amario D, et al. Cardiac stem cells in patients with ischemic cardiomyopathy (SCIPIO): initial results of a randomized phase 1 trial [J]. Lancet, 2011, 378(26): 1847-1857.
[15]Smith A L, Ellison F M, McCoy J P Jr, et al. C-kit expression and stem cell factor-induced hematopoietic cell proliferation are up-regulated in aged b6d2f1 mice [J]. J Gerontol A Biol Sci Med Sci, 2005, 60(4): 448-456.
[16]Anversa P, Kajstura J, Leri A, et al. Life and death of cardiac stem cells: a paradigm shift in cardiac biology [J] .Circulation, 2006, 113(11): 1451-1463.
Isolationandidentificationofcardiacstemcellsfromadultmice
Dengwenwen,Zhaoranzun,Longxianping,Shibei
(Department of Cardiology, The Affiliated Hospital of Zunyi Medical University, Guizhou Zunyi 563099, China)
ObjectiveTo establish a stable method for the isolation of cardiac stem cells (CSCs) and identify the biological characteristics of CSCs.MethodsHearts from adult CD1 mice were cut into pieces and digested with collagenase II and trypsin repeatedly. Differential centrifugation was employed to remove ventricular cardiomyocytes. CSCs purity was achieved by using magnetic activated cell sorting (MACS) to purify c-kitposCSCs and the outcome of the c-kitposCSCs was verified with flow cytometry (FCM).ResultsC-kitposCSCs were successfully separated and purified from adult CD1 mouse hearts using enzymatic digestion combined with MACS. Using FCM, we demonstrated that after MACS, the proportion of c-kitposCD34negCSCs increased from 4.62% to 70.23%.ConclusionCSCs in adult mouse can be isolated and culturedinvitroby collagenase II and trypsin digestion and MACS, which is more efficient to isolate c-kitposcardiac stem cells compared with the tissue expansion method, and more useful to investigate CSC-related signaling pathwaysinvitro. The c-kitposCSCs proliferate more stably and fasterinvitrothan the other cell types,which may lead to significant in vitro experiments to elucidate the related signal pathways.
cardiac stem cells; cell isolation; enzymatic digest; magnetic activated cell sorting
石蓓,女,教授,硕士生导师,研究方向:冠心病干细胞移植治疗,E-mail:shibei2147@163.com 。
R541
A
1000-2715(2013)05-0406-04
[收稿2013-07-12;修回2013-09-13]
(编辑:谭秀荣)
