双侧黑质注射脂多糖引起大鼠迷走神经背核胆碱能标志物降低和便秘
2013-10-25郑丽飞樊瑞芳陈长亮朱进霞
张 悦 郑丽飞 宋 瑾 樊瑞芳 陈长亮 朱进霞
(首都医科大学基础医学院生理与病理生理学系,北京100069)
帕金森病(Parkinson disease,PD)是一种好发于中老年人中枢神经系统的退行性疾病,常伴有消化系统方面的功能异常,如便秘等[1],其主要病理特征为中脑黑质部位多巴胺能神经元缺失。近年来研究[2]表明脑内炎性反应可能是PD的一个主要致病因素,小胶质细胞介导的慢性炎性反应是PD病变过程的重要组成部分。脂多糖(lipopolysaccharide,LPS)是一种以氨基苷为组成单位的磷脂,构成革兰阴性菌细胞壁成分[3],是一种很强的小胶质细胞激活剂,可诱导小胶质细胞激活,释放致炎因子和细胞毒性因子导致多巴胺(dopamine,DA)能神经元变性[4]。Herrera 等[5]认为LPS注入黑质可以作为研究炎性反应对DA系统影响的最佳动物模型。
DA是一种抑制性神经递质,主要由中脑黑质产生,沿黑质—纹状体投射系统分布,储存于纹状体。临床研究[6]发现PD患者黑质中DA能神经元缺失伴有内源性DA含量的改变,而胃肠动力会随之发生变化。DA对胃肠功能具有调节作用,如可以调节钠的吸收[7],刺激消化道上皮离子转运[7-8],抑制胃肠蠕动[9-11]以及黏膜血流量[12]。
DA除了在黑质—纹状体系统有大量分布外,在中枢其他核团也有DA能神经元的存在,如下丘脑[13]、孤束核、迷走运动背核(dorsal motor nucleus of the vagus,DMV)[14-15]等,支配上消化道的迷走神经副交感节前纤维大部分来源于DMV。支配胃肠运动的DMV内含有胆碱能神经元和 DA 能神经元[16-17],并且研究[18-19]发现PD患者DMV部位的神经元也有退行性表现。
本研究通过制作LPS诱导的PD大鼠模型,观察模型组和对照组大鼠DMV中酪氨酸羟化酶(tyrosine hydroxylase,TH)和胆碱乙酰转移酶(choline acetyltransferase,ChAT)的分布情况,并检测该模型大鼠排便情况,以期为PD患者便秘的发病机制提供一些实验依据。
1 材料和方法
1.1 LPS处理PD模型大鼠的制备
选取20只雄性SD大鼠(首都医科大学实验动物部提供),实验动物许可证号:SCXK(京)2012-0001。体质量为250~300 g,经实验动物福利委员会许可,动物在室温条件,正常更替光照,24h食水供应,采用数字表法将其随机分为实验组和对照组,LPS处理组大鼠12只、对照组8只。
模型制备:LPS处理组大鼠12只,用水合氯醛进行麻醉(0.4 g/kg)后,将大鼠头部固定于立体定位仪,颅骨暴露出2点(黑质坐标:前囟后5.6 mm,旁开±2.0 mm,深度7.5 mm),从这2点注入脂多糖(lipoplysaccharide,LPS,购自美国 Sigma公司),每点注入2 μL,浓度为2 g/L。饲养3周后成模。
1.2 行为学观察
实验动物成模后进行行为学观察记录,每天从15点到16点对大鼠的摄食量、饮水量、体质量及粪便进行观测,连续观察1周并进行统计。
1.3 HE 染色
将黑质部位的切片晾干后用蒸馏水洗净,苏木精染色3~10 min,自来水洗去多余的苏木精。盐酸乙醇分色10 s,自来水漂洗20 min,使苏木精蓝化细胞核呈蓝色。蒸馏水清洗后,以1%伊红染色3 min,蒸馏水洗去多余伊红。上行梯度乙醇脱水,组织依次通过70%、80%、90%、95%乙醇各1 min,然后2次进入100%乙醇脱水各5 min。用二甲苯透明2次各5 min,封片照相。
1.4 免疫组织化学
取材:成模大鼠及对照组大鼠用4%多聚甲醛进行灌流固定,完成后取脑,将脑组织浸泡于4%多聚甲醛溶液中,次日将组织浸泡于15%蔗糖溶液中,第3日换至30%蔗糖溶液中,梯度脱水。
待脑组织完全脱水后,按黑质和DMV所在部位切块包埋,冰冻切片机切厚度为20 μm脑片,漂片于多聚赖氨酸处理的载玻片上,过夜晾干。
DMV区域的切片,经柠檬酸盐缓冲液中微波抗原修复后,自然降至室温。先后经PBST缓冲液、甘氨酸、PBST洗片。用5%驴血清封闭50 min,选用一抗分别为酪氨酸羟化酶(TH,小鼠抗大鼠,1∶5 000稀释,购自美国Sigma公司)、胆碱乙酰转移酶(ChAT,山羊抗大鼠,1∶100稀释,购自Abcam公司),4℃过夜孵育。15~16 h后取出组织切片室温放置1 h,PBST洗3次。滴加二抗(驴抗山羊、驴抗小鼠,购自Invitrogen公司),孵育 2 h后滴加 DAPI,5 min后PBST洗片,甘油封片。荧光显微镜下观察、照相。
黑质区域的切片则只选用酪氨酸羟化酶(TH,小鼠抗大鼠,1∶5 000稀释,购自美国Sigma公司)一抗进行单标染色,其他步骤不变。
1.5 统计学方法
应用GraphPad Prism 5.0进行统计学处理。数据以均数±标准误(ˉx±SE)表示,结果来自3批独立的实验。结果中的“n”代表动物只数。组间比较行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠黑质部位注射LPS的帕金森动物模型鉴定
TH是DA合成的限速酶,可以作为DA能神经元的标志物。从HE染色结果(图1A和B)可以看出,LPS大鼠黑质部位的神经元数量明显减少,并伴有胶质细胞的增多。免疫组织化学的结果显示LPS大鼠黑质部位的TH免疫阳性神经元的数量和荧光强度明显低于对照组(图1C和D)。以上结果表明LPS大鼠黑质部位的DA能神经元减少,由此可见,LPS处理的PD大鼠模型造模成功。
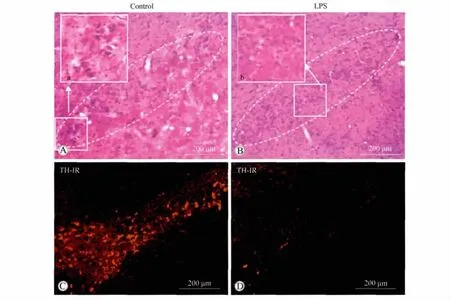
图1 HE染色及TH免疫阳性神经元在LPS组和对照组大鼠黑质的分布Fig.1 HE staining and tyrosine hydroxylase(TH)immunoreactivity in the substantia nigra(SN)of LPS and control rats
2.2 LPS组与对照组大鼠行为学比较
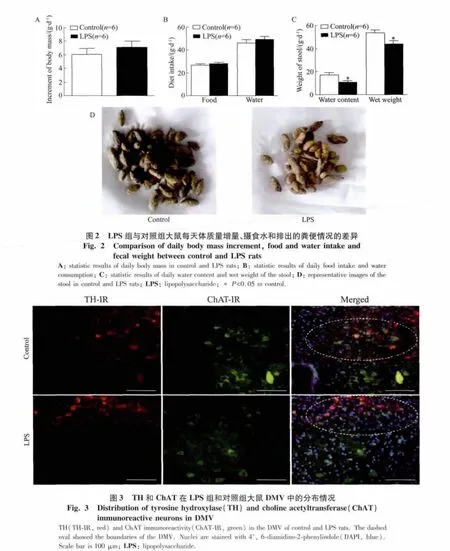
LPS大鼠在成模后检测了其每天的体质量变化,结果发现差异无统计学意义〔图2A,对照组:(6.02±0.84)g,LPS 组:(7.12 ±0.80)g,n=6,P=0.36)〕。每天食物的摄入量〔对照组:(26.70±1.02)g,LPS组:(27.98±0.84)g,n=6,P=0.36〕和摄水量〔对照组:(46.13±2.78)g,LPS组:(49.23 ±2.40)g,n=6,P=0.42〕2组之间差异无统计学意义(图2B)。但其粪便湿质量〔对照组:(53.80±2.45)g,n=8,LPS组:(43.95±2.98)g,n=9,P <0.05〕和含水量〔对照组:(17.31 ±1.59)g,n=8,LPS 组:(10.68 ±1.72)g,n=9,P<0.05〕,LPS组明显低于对照组(图2C)。此外,从大鼠排出的粪便情况也可以看出LPS组大鼠排出的粪便量明显少于对照组,且比较干燥(图2D)。以上结果提示LPS大鼠出现便秘症状。
2.3 TH、ChAT在LPS组和对照组大鼠DMV中的分布差异
众所周知,DMV在调节胃肠动力方面发挥着重要的作用。本研究用免疫组织化学的方法观察了TH和ChAT(胆碱能神经元的标志物)在大鼠DMV中的分布。TH(红色)免疫阳性神经元和纤维主要分布在DMV及孤束核,ChAT(绿色)免疫阳性神经元和纤维主要分布在DMV及舌下神经核(图3)。从图3中可以看出对照组和LPS模型组TH和ChAT在背侧延髓的分布情况一致。但是DMV中的TH免疫阳性神经元和纤维的荧光强度及数量在LPS组明显高于对照组;而ChAT免疫阳性神经元的荧光强度及数量则低于对照组。
3 讨论
本实验通过用LPS损毁黑质部位DA能神经元制备的PD大鼠模型,观察到LPS大鼠出现便秘情况、DMV部位的TH免疫荧光强度增强而ChAT荧光强度明显减弱。
DMV在调节胃肠功能方面发挥着重要的作用,如胃肠的运动功能。DMV中含有多种神经元,其中大多数是胆碱能神经元,也含有其他神经元如DA能神经元。TH是合成DA的限速酶,存在于DA能细胞内,可用于标记DA能细胞;DA能神经元释放的DA是一种抑制性神经递质,具有强烈的舒张平滑肌和舒血管的作用,可抑制胃肠道的紧张性。ChAT是胆碱能神经元的标志物,可标记胆碱能神经元。胆碱能神经元释放的乙酰胆碱(acetylcholine,ACh)则是一种常见的兴奋性神经递质,具有刺激胃肠平滑肌收缩和促进胃肠蠕动的作用[20];从本研究的实验结果也可以看出在大鼠DMV有TH和ChAT免疫阳性神经元的存在,而它们在分布和功能上存在的差异性提示可能对胃肠功能调节发挥着不同的作用。
本实验中,用LPS损毁黑质炎性反应模型大鼠的黑质部位DA能神经元较对照组明显减少并伴有胶质细胞的增生,标志着LPS已通过激活小胶质细胞使DA能神经元退化,动物模型造模成功。LPS大鼠出现排出的粪便量明显减少且粪便较干燥,提示LPS大鼠出现了类似于PD患者的便秘的表现。便秘可以是2种主要因素引起,一是运动障碍;二是结肠对水分的重吸收增多。为了探索LPS大鼠便秘的原因,笔者研究了支配胃肠运动的DMV部位DA的标志物TH和胆碱能神经元的标志物ChAT的免疫反应性变化,发现该部位TH免疫荧光强度显著增高而ChAT则明显降低。抑制性神经递质DA在DMV部位的增多,一方面可通过与胆碱能神经元突触前膜上的D2受体结合[21],进而抑制该神经元释放ACh到消化道部位,另一方面由DMV直接释放到胃肠部位,引起胃肠部位的DA增多,这两条通路都可抑制胃肠动力。相反,兴奋性神经元递质ACh在LPS大鼠DMV部位的减少,从而使直接释放到胃肠的ACh也可能减少,引起胃肠动力兴奋的作用减弱。胃肠动力兴奋作用的减弱和抑制作用的增强,这2种情况都使消化道整个转运时间延长,从而导致大鼠排出的粪便量减少。由于消化道动力的减弱,使粪便在结肠部位停留的时间延长,粪便中的水分可能被结肠黏膜吸收增多,出现大便干燥硬结的情况,最终LPS大鼠表现出类似于PD患者的便秘情况。关于LPS大鼠结肠黏膜对水吸收功能的变化还有待进行进一步的研究。上述结果的产生可能是由于黑质部位DA能神经元损伤之后通过直接或间接地神经纤维的联系使DMV部位的神经元发生可塑性改变,进而导致胃肠运动功能紊乱,即胃肠动力减弱。该结果与笔者之前在6-OHDA大鼠观察到的结果[16,22]一致。
综上所述,LPS破坏大鼠黑质DA能神经元后,经一系列神经可塑性变化,导致DMV处的DA含量增多、ACh含量减少。从而使DMV通过神经纤维传递到胃肠的DA增多及ACh减少,进而引起大鼠出现便秘。但由SN神经元损伤引起DMV部位神经递质发生变化的机制尚不明确,还有待于进行进一步的研究。
[1]Ziemssen T,Reichmann H.Non-motor dysfunction in Parkinson’s disease[J].Parkinsonism Relat Disord,2007,13(6):323-332.
[2]Qian L,Flood P M,Hong J S.Neuroinflammation is a key player in Parkinson disease and a prime target for therapy[J].J Neural Transm,2010,117(8):971-979.
[3]Shiratsuch H,Basson M D.Differential regulation of monocyte/macrophage cytokine production by pressure[J].Am J Surg,2005,190(5):757-762.
[4]Liu B,Du L,Hong J S.Naloxone protects rat dopaminergic neurons against inflammatory damage through inhibition of microglia activation and superoxide generation[J].J Pharmacol Exp Ther,2000,293(2):607-617.
[5]Herrera A J,Castaño A,Venero J L,et al.The single intranigral injection of LPS as a new model for studying the selective effects of inflammatory reactions on dopaminergic system[J].Neurobiol Dis,2000,7(4):429-447.
[6]Fumagalli F,Gainetdinov R R,Valenzano K J,et al.Role of dopamine transporter in methamphetamine-induced neurotoxicity:evidence from mice lacking the transporter[J].J Neurosci,1998,18(13):4861-4869.
[7]Finkel Y,Eklof A C,Granquist L,et al.Endogenous dopamine modulates jejunal sodium absorption during high-salt diet in young but not in adult rats[J].Gastroenterolo,1994,107(3):675-679.
[8]Zhang X H,Zhang X F,Zhang J Q,et al. β-adrenoceptors,but not dopamine receptors,mediate dopamine-induced ion transport in late distal colon of rats[J].Cell Tissue Res,2008,334(1):25-35.
[9]Zhang X H,Guo H,Xu J D,et al.Dopamine receptor D1 mediates the inhibition of dopamine on the distal colonic motility[J].Transl Res,2012,159(5):407-414.
[10]Haskel Y,Hanani M.Inhibition of gastrointestinal motility by MPTP via adrenergic and dopaminergic mechanisms[J].Dig Dis Sci,1994,39(11):2364-2367.
[11]米新亮,李蕴,郭华,等.5-HT3/4受体在内源性多巴胺调节胃动力中的作用[J].首都医科大学学报,2010,31(2):217-221.
[12]Szabo S.Dopamine disorder in duodenal ulceration[J].Lancet,1979,2(8148):880-882.
[13]Vucetic Z,Reyes T M.Central dopaminergic circuitry controlling food intake and reward:implications for the regulation of obesity[J].Wiley Interdiscip Rev Syst Biol Med,2010,2(5):577-593.
[14]Hayakawa T,Takanaga A,Tanaka K,et al.Distribution and ultrastructure of dopaminergic neurons in the dorsal motor nucleus of the vagus projecting to the stomach of the rat[J].Brain Res,2004,1006(1):66-73.
[15]Zheng Z,Travagli R A.Dopamine effects on identified rat vagal motoneurons[J].Am J Physiol Gastrointest Liver Physiol,2007,292(4):G1002-G1008.
[16]Zheng L F,Wang Z Y,Li X F,et al.Reduced expression of choline acetyltransferase in vagal motoneurons and gastric motor dysfunction in a 6-OHDA rat model of Parkinson’s disease[J].Brain Res,2011,1420:59-67.
[17]Cai Q Q,Zheng L F,Fan R F,et al.Distribution of dopamine receptors D1- and D2-inmunoreactive neurons in the dorsal motor nucleus of vagus in rats[J].Auton Neurosci,2013,176(1-2):48-53.
[18]Phillips R J,Walter G C,Wilder S L,et al.Alpha-synuclein-immunopositive myenteric neurons and vagal preganglionic terminals:autonomic pathway implicated in Parkinson’s disease?[J].Neuroscience,2008,153(3):733-750.
[19]Braak H,Del Tredici K,Rüb U,et al.Staging of brain pathology related to sporadic Parkinson’s disease[J].Neurobiol Aging,2003,24(2):197-211.
[20]李林,茹立强.大鼠肠道内ACh能、SP、VIP-肽能和NO能神经的分布模式及相互关系[J].华中科技大学学报:医学版,2009,38(5):575-580.
[21]Takahashi T,Kurosawa S,Wiley J W,et al.Mechanism for the gastrokinetic action of domperidone In vitro studies in guinea pigs[J].Gastroenterology,1991,101(3):703-710.
[22]Tian Y M,Chen X,Luo D Z,et al.Alteration of dopaminergic markers in gastrointestinal tract of different rodent models of Parkinson’s disease[J].Neuroscience,2008,153(3):634-644.
