人卵巢组织程序化冷冻及体外培养对卵泡活性和雌二醇分泌的影响
2013-10-25田玄玄阮祥燕MontagMarkusLiebenthronJanaAlfredMueck
田玄玄 阮祥燕* Montag Markus Liebenthron Jana Alfred O.Mueck
(1.首都医科大学附属北京妇产医院内分泌科,北京100026;2.海德堡大学妇产医院生殖医学研究中心,海德堡69115;3.波恩大学妇产医院卵巢组织冻存中心,波恩53012;4.德国图宾根大学妇产医院内分泌与绝经研究中心,图宾根D-72076)
随着癌症治疗学的进步,年轻女性放化疗后卵巢功能减退及丧失成为妇产学界面临的重大问题。卵巢组织冷冻保存是继胚胎冷冻和卵母细胞冻存之后的又一极具潜力的保存女性生殖功能的新技术[1],然而,目前对于卵巢组织冻存方法及其质量评估尚不确定。卵泡活性和卵巢组织内分泌功能的保存是冻存技术应用于临床的前提和基础。本研究使用程序冷冻法冻存人卵巢组织,并在解冻后行组织体外培养,通过比较冷冻前后卵泡的活性,及培养上清液中的雌二醇(estradiol,E2)水平,探讨程序冷冻法对卵泡活性和卵巢内分泌功能的影响。
1 材料与方法
1.1 标本
人卵巢组织来自于德国波恩大学卵巢组织冻存中心用于研究的人卵巢组织,所有组织来源者已签署知情同意书。乳腺癌1例,宫颈癌2例,系统性红斑狼疮1例,肾母细胞瘤1例,患者年龄8~39岁,平均年龄(27.2 ±19.2)岁。
1.2 试剂
二甲基亚砜(dimethyl sulfoxide,DMSO)(纯度 >99.9%),德国WAK-Chemie公司生产;L-15基础培养液,德国Gibco公司生产;血清替代液(serum substitute supplement,SSS),美国Irvine Scientific 公司生产;庆大霉素,美国Sigma公司生产;AIM-V无血清培养液,德国Gibco公司生产;荧光染色剂Calcein AM,美国Sigma公司生产;胶原酶IA,美国Sigma公司;蔗糖,美国Sigma公司生产;Gamete Buffer,COOK®公司生产;杜氏磷酸缓冲液(dulbecco's phosphate buffered saline,DPBS),德国PAA公司生产。(1)组织准备液:L-15基础培养液+10%SSS+1%庆大霉素;(2)冷冻液:L-15基础培养液+10%SSS+1%庆大霉素+10%DMSO;(3)消化染色液:DPBS+0.2%Calcein AM+6 mg/mL胶原酶IA;(4)梯度解冻溶液(100 mL):DPBS+10%SSS+1%庆大霉素 +0.75 mol/L/0.625 mol/L/0.5 mol/L/0.375 mol/L/0.25 mol/L/0.125 mol/L蔗糖;(5)体外培养液:AIM-V培养液+10%SSS+1%庆大霉素+100mIU/mL rFSH。
1.3 方法
1.3.1 卵巢组织收集及处理
卵巢组织离体后置于4℃组织准备液中,快速转移至实验室。组织准备液冲洗2次,22号刀片去除肉眼所见的坏死组织、血管和髓质组织[2],使卵巢皮质厚度约1 mm,取边角组织用于研究。在体视显微镜下用眼科剪和眼科镊将卵巢组织剪成1 mm×1 mm×1 mm的组织块。操作过程中组织必须浸在组织准备液中,以上操作在4℃条件下40 min内完成。将处理好的组织块采用抽签法随机分为新鲜组、程序冷冻组、新鲜培养组、冻融后培养组4组,每组10块。(1)新鲜组:直接进行消化染色卵泡计数;(2)程序冷冻组:程序冷冻14 d后解冻,染色卵泡计数;(3)新鲜培养组:新鲜组织块体外培养,检测上清液中E2浓度,14 d后组织块染色卵泡计数;(4)冻融后培养组:程序冷冻14 d后解冻,组织体外培养,检测上清液中E2浓度,14 d后组织块染色卵泡计数。
1.3.2 组织消化、荧光染色、卵泡计数
组织置于平衡过夜的AIM-V培养液中(4孔板,200 μL/孔),37 ℃、5%CO2条件下培养 2 ~3 h 后转移至37℃预温的消化染色液中(DPBS/CalceinAM/胶原酶 IA),37 ℃、5%CO2条件下培养1.5 ~2 h,待组织消化呈絮状,吹打混匀,荧光显微镜下各级卵泡计数。Calcein AM是一种只对活细胞进行荧光标记的细胞染色剂,能够轻易穿透活细胞膜,有活性的卵泡被染色以后发出强绿色荧光。卵泡分级参照Gougeon分级[3]标准:始基卵泡—卵母细胞周围包绕一层扁平的前颗粒细胞;初级卵泡—卵母细胞周围包绕一层立方形的颗粒细胞;次级卵泡—卵母细胞周围包绕两层或两层以上立方形的颗粒细胞。窦状卵泡—两层以上的颗粒细胞,卵泡内有窦腔形成。
1.3.3 程序冷冻[4-5]
处理好的组织块置于预冷的冷冻液中,4℃(冰面上)摇匀20 min,200 r/min,后转移置冻存管内,冻存液500 μL/管,计时25 min。程序降温:4℃开始,以1℃/min的速度降至-2℃,以0.5℃/min的速度降至-4℃,以0.3℃/min的速度降至-7.5℃,平衡11 min,人工植冰,平衡10 min,以0.3 ℃/min的速度降至-42℃,以10℃/min的速度降至-140℃,投入液氮保存。
1.3.4 快速解冻[5]
将冻存管从液氮中取出,室温静置30 s后置于37℃水浴1~1.5 min,观察待冻存管内冰呈2~3 mm长时将冻存管取出,室温下摇匀,转移组织块置梯度解冻溶液:0.75 mol/L-0.625 mol/L-0.5 mol/L-0.375 mol/L-0.25 mol/L-0.125 mol/L,各摇匀 8 min,室温,200 r/min;37℃预温的Gamete Buffer液冲洗2次×15 s,将组织转移置AIM-V液中培养过夜,消化染色、卵泡计数。
1.3.5 卵巢组织体外培养
将新鲜和解冻复苏后的卵巢组织置入4孔板(美国Falcon公司)中进行体外培养,每孔置1块卵巢组织,置300 mL体外培养液,37℃、体积分数6%CO2培养箱中培养14 d,隔日半量换液,将收集的培养液分别保存于-20℃冰箱中待测E2。
1.3.6 雌二醇测定
采用电化学发光免疫分析法测定培养液中的E2水平。E2试剂盒购自德国Roche公司,操作按试剂盒说明书进行。
1.4 统计学方法
采用SPSS 17.0统计学软件对实验数据进行分析。计量资料以均数±标准差(ˉ±s)表示,数据分析采用方差分析和t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 程序冷冻法对卵泡活性的影响
采用胶原酶对人卵巢组织进行消化,Calcein AM荧光染色评估各级卵泡的活性。图1显示了荧光显微镜下荧光染色的窦前卵泡的形态。人卵巢组织冷冻前后各级卵泡的数量和构成比。冷冻前后的卵泡总数和始基卵泡数比较,差异无统计学意义(P>0.05)。与新鲜组相比较,程序冷冻组内初级卵泡和次级卵泡的数量及其构成比下降,差异无统计学意义(P>0.05),冷冻前后均未观察到窦状卵泡,详见表1。
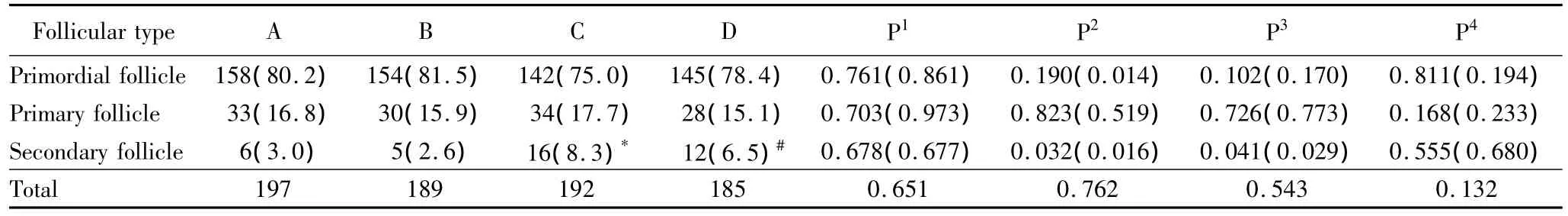
表1 人卵巢组织中各级卵泡数量及其构成比Tab.1 The number of follicles and their proportions of human ovarian tissues n(%)
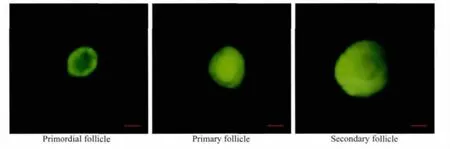
图1 荧光显微镜下Calcein AM染色的窦前卵泡Fig.1 Preantral follicles stained with calcein AM under fluorescence microscopy(Bar:50 μm)
2.2 体外培养的人卵巢组织的生长发育和E2分泌
卵巢组织在体外培养至第4~6天开始出现贴壁生长现象,组织逐渐黏附于培养板底面,新鲜培养组贴壁时间(4.5 ±1.0)d,冻融后培养组(4.8 ±0.9)d,2组组织的贴壁时间比较,差异无统计学意义(P>0.05)。
体外培养的新鲜卵巢组织和程序冻融后卵巢组织的E2分泌水平详见表2。结果显示,新鲜培养组和程序冻融后培养组的组织都具有分泌E2的功能。图2显示了2组的E2水平增长趋势,2组E2水平增长趋势一致,随培养时间延长,E2水平增加,培养开始的6 d内E2水平增加缓慢,从第6天至第8天,E2水平增加较迅速,从第8天开始,E2水平增加缓慢,有上下波动。培养第2天,与新鲜培养组相比,冻融后培养组的E2水平较低,差异有统计学意义(P<0.05)。培养第4~6天,冻融后培养组的E2水平偏低,差异无统计学意义(P>0.05)。培养第8~14天,2组的E2水平差异无统计学意义(P>0.05)。
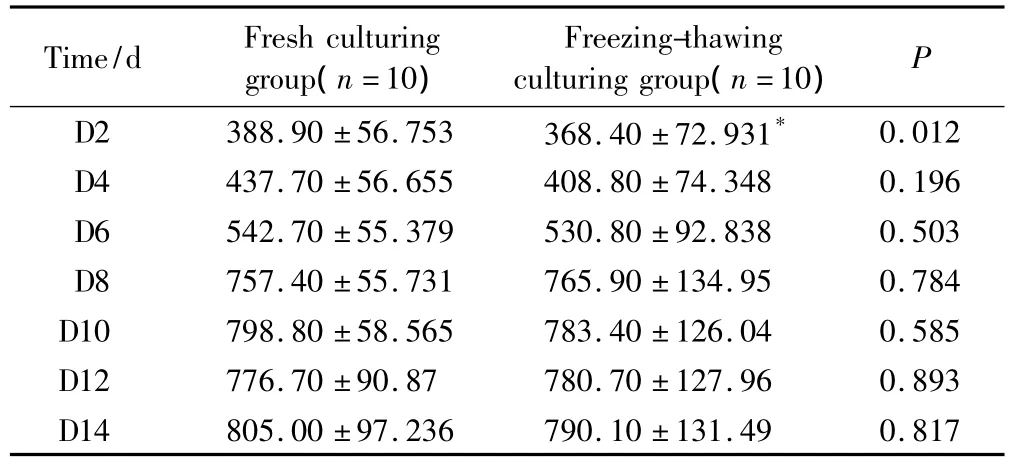
表2 体外培养的卵巢组织培养液中的雌二醇浓度Tab.2 The level of estradiol in the medium of ovarian tissue cultured in vitro (pg/mL)
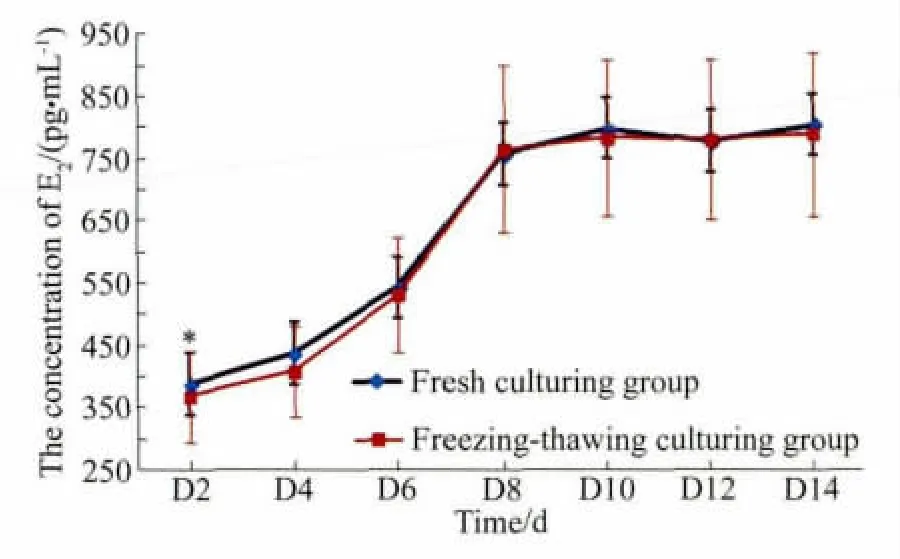
图2 体外培养的卵巢组织培养液中的雌二醇浓度Fig.2 The level of estradiol in the medium of ovarian tissue cultured in vitro
2.3 卵巢组织体外培养对卵泡活性的影响
新鲜卵巢组织和程序冻融后卵巢组织体外培养14 d后,消化染色,各级卵泡的数量和构成比见表1。结果显示,与培养前相对应组(新鲜组-新鲜培养组,程序冷冻组-冻融后培养组)比较,体外培养后卵泡总数、始基卵泡和初级卵泡构成比差异无统计学意义(P>0.05)。体外培养后次级卵泡数量及构成比增加,差异有统计学意义(P<0.05)。新鲜培养组与冻融后培养组组间卵泡总数和各级卵泡构成比,差异无统计学意义(P >0.05)。
3 讨论
卵巢组织冻存可以同时保存大量卵泡,组织冻存和移植是一种保存女性生殖和内分泌功能的新技术。国外已有卵巢组织冷冻后移植卵巢功能成功恢复的报道[5-6],但是,目前对于卵巢组织冻存方法尚有众多的不确定性因素,这都可能会影响到卵巢组织的活性。国内学者也在此领域做了大量研究[7-8],然而,国内目前尚无成功病例报道,关键问题是冻存技术不成熟。冷冻前后准确的卵巢组织质量评估也是评价冻存技术成败的关键,之前国内研究多数是对卵巢进行组织学检测,评估冷冻对卵泡的影响,然而组织学检测对于卵泡的活性评估有一定限制。本研究使用活细胞染色剂Calcein AM,直接对有活性的卵泡进行荧光染色,分析卵巢组织冷冻对卵泡活性的影响。另外,激素分泌是卵巢组织活性评估的另一方面,并且与卵泡活性相对应,两者相互印证。本研究从卵泡活性和E2分泌两个方面评估卵巢组织的活性,探讨程序化冷冻和体外培养对卵巢组织活性的影响。
冷冻前后卵泡总数和始基卵泡数无明显变化,初级卵泡和次级卵泡的构成比差别不显著,但程序冷冻组的初级卵泡和次级卵泡的构成比有下降趋势。这表明,不同类型的卵泡对程序化冷冻的耐受性可能存在差异。有研究[9-10]发现,程序化冷冻法对颗粒细胞影响较大,体积小、代谢率低、缺乏细胞器的始基卵泡程序冷冻的效果比较好。Choi等[11]研究发现,与新鲜组相比,冻融卵巢组织中的颗粒细胞的分化较低,分离出颗粒细胞进行体外培养发现,冻融后的颗粒细胞的细胞周期调节蛋白D、E,细胞周期蛋白依赖激酶4等的表达也有所降低。这说明冷冻过程中,颗粒细胞受到了损伤。不同细胞对冷冻保护剂的渗透性不一致,在冷冻过程中遭受的损伤也不同。这可能与颗粒细胞位于卵泡的外层,最早接触冷冻保护剂以及感受外界环境的变化有关。
初级卵泡和次级卵泡的体积较始基卵泡增大、代谢增强,颗粒细胞的数量增多,所以在冷冻过程中,初级卵泡和次级卵泡更易发生损伤。但是由于用于研究的卵巢组织有限,卵巢组织中次级卵泡的数量比较少,本研究未发现冷冻后次级卵泡数量和构成比有显著下降,尚不能给出次级卵泡比初级卵泡更易发生损伤的结论。以上研究结果表明,始基卵泡对程序冷冻法的耐受性较好,冷冻以后存活率较高且数量多,对始基卵泡的生长发育进行研究具有广阔的前景。
E2是卵巢组织分泌的最主要的性激素,其水平可以反映卵巢组织的内分泌功能和卵泡的活性。本研究收集体外培养卵巢组织的培养液检测E2水平,判断程序化冷冻对卵巢组织内分泌功能的影响。研究结果显示,新鲜培养组和冻融后培养组均有E2分泌,并且随着培养时间的延长,E2水平逐渐增加,这提示卵巢组织在体外培养环境中能继续生长,并保持一定的内分泌功能,这为体外培养卵巢组织的临床应用提供了实验基础。在体外培养的第4~6天开始观察到卵巢组织的贴壁生长现象,这与Li等[12]的研究观察到的贴壁现象相似。冻融卵巢组织需要相对较长的时间贴壁,但是组间贴壁时间比较,差异无统计学意义,提示程序冷冻对卵巢组织体外生长的影响不大。
从折线图可以观察到,2组的E2水平增长趋势一致,随培养时间延长,E2水平增加,提示卵巢组织在体外培养条件下生长发育良好。培养的开始阶段,冻融组织分泌的E2水平较低,之后逐渐与新鲜培养组接近,培养第8~14天,2组间的E2水平比较,差异无统计学意义(P>0.05)。这提示,程序化冷冻对体外培养的卵巢组织的E2分泌无明显影响,卵巢组织在体外培养初期可能存在一个适应阶段,特别是对于冻融卵巢组织,可能需要逐渐复苏其活性。这也进一步说明,程序化冷冻可以较好的保存卵泡的活性,因为是卵巢组织内的活性卵泡分泌了E2。
体外培养第6天以后大部分组织已经贴壁生长,E2水平增加较迅速。之后在稳定的FSH作用下,E2水平增加缓慢,有上下波动,这可能是由于卵巢组织内各期卵泡的发育和闭锁同时存在,环境和激素刺激导致了一批卵泡同时闭锁或凋亡的原因。
本研究中,卵巢组织体外培养14 d以后,卵泡总数及始基卵泡和初级卵泡构成比,差异无统计学意义(P>0.05),次级卵泡数量及构成比增加,差异有统计学意义(P<0.05)。这提示,程序冷冻对卵泡的体外生长发育能力无显著影响。卵巢组织体外培养情况下,次级卵泡的生长优于始基卵泡和初级卵泡的生长。这与之前Bishonga等[13]的卵泡体外培养研究结果一致,即大卵泡的发育潜能优于小卵泡。在卵泡生长过程中存在卵泡选择和优势化现象,即大卵泡抑制其他小卵泡生长发育而使自己优先发充育成熟的现象,机制可能是正在成熟的大卵泡分泌E2和抑制素等非激素因子,抑制了较小卵泡的生长。另外,直径较小的卵泡周围只有单层颗粒细胞,而直径较大的卵泡卵母细胞周围围绕2~4层颗粒细胞,可较快的实现细胞贴壁生长,卵泡膜细胞就可以更早开始增生。
研究[14-15]发现,体外培养体系中卵泡刺激素(follicle-stimulating hormone,FSH)对窦前卵泡的生长发育至关重要,FSH促进颗粒细胞DNA合成。本研究体外培养基中添加了rFSH,次级卵泡卵泡膜细胞上已经有FSH受体,可以接受FSH的刺激作用继续发育,而始基卵泡和初级卵泡缺乏FSH受体,尚不能接受FSH的作用,从而导致不同类型的卵泡在同一生长条件下的生长发育出现差异。培养至第14天时仍未观察到有窦状卵泡,可能由于本研究培养条件和培养时间的限制,本研究培养基中仅有外源性FSH的支持,窦前卵泡的发育尚受多种其他激素和细胞因子的影响[16-17],因此以后对卵泡发育的影响因素还需继续进行深入研究。
综上所述,程序冷冻法可以较好的保存人卵巢皮质组织内的窦前卵泡,不影响体外培养的卵巢组织的雌二醇分泌。不同类型的卵泡对程序化冷冻的耐受性不同。卵巢组织体外培养情况下,次级卵泡的生长优于始基卵泡和初级卵泡的生长。因此,卵巢组织程序化冷冻和体外培养,对女性生殖力保存具有重要意义。
[1]Smitz J,Dolmans M M,Donnez,J,et al.Current achievements and future culture,in vitro follicle development and transplantation:implications for fertility preservation[J].Human Reproduction Update,2010,16(4):395-414.
[2]Bedaiwy M A,Falcone T.Harvesting and autotransplantation of vascularized ovarian grafts:approaches and techniques[J].Reprod Biomed Online,2007,14(3):360-371.
[3]Gougeon A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[4]Gosden R G,Baird D T,Wade J C,et al.Restoration of fertility to oophorectomized sheep by ovarian autografts stored at-96 degrees C[J].Hum Reprod,1994,9(4):597-603.
[5]Michael V W,Jacques D,Outi H,et al.Cryopreservation and autotransplantation of human ovarian tissue prior to cytotoxic therapy-A technique in its infancy but already successful in fertility preservation[J].European Journal of Cancer,2009,45(9):1547-1553.
[6]Silber S J.Ovary cryopreservation and transplantation for fertility preservation[J].Molecular Human Reproduction,2012,18(2):59-67.
[7]曹金燕,史小林,诸定寿.大鼠胚胎卵巢异体异位移植的探讨[J].首都医科大学学报,2000,21(1):9-11.
[8]李云秀,马艳萍,李永刚,等.不同冷冻方案对人类卵巢组织形态学的影响[J].中国优生与遗传杂志,2011,19(6):101-103.
[9]Dahl S L,Chen Z,Solan A K,et al.Feasibility of vitrification as a storage method for tissue-engineered blood vessels[J].Tissue Eng,2006,12(2):291-300.
[10]Fabbri R,Pasquinelli G,Bracone G.Cryopreservation of human ovarian tissue[J].Cell Tissue Bank,2006,7(2):123-133.
[11]Choi J,Lee B,Lee E,et al.Cryopreservation of ovarian tissues temporarily suppresses the proliferation of granulosa cells in mouse preantral follicles[J].Cryobiology,2008,56(1):36-42.
[12]Li Y B,Zhou C Q,Yang G F,et al.Modified vitrification method for cryopreservation of human ovarian tissues[J].Chin Med,2007,120(2):110-114.
[13]Bishonga C,Takahashi Y,Katagiri S,et al.In vitro growth of mouse ovarian preantral follicles and the capacity of their oocytes to develop to the blastocyst stage[J].J Vet Med Sci,2001,63(6):619-624.
[14]Yu Y,Li W,Han Z,et al.The effect of follicle-stimulating hotmone on follicular development granulosa cell apoptosis and stemidogenesis and its mediation by insulin-like growth factor-I in the goat ovary[J].Theriogenology,2003,60(9):1691-1704.
[15]Yang P,Roy S K.A novel mechanism of FSH regulation of DNA synthesis in the granulesa cell of hamster preantral follicles:involvement of a protein kinase C-mediated MAP kinase 3/1 selfactivation loop[J].Biol Reprod,2006,75(1):149-157.
[16]Brito A B,Santos R R,R.van den Hurk,et al.Shortterm culture of ovarian cortical strips from capuchin monkeys:a morphological,viability,and molecular study of preantral follicular development in vitro[J].Reproductive Sciences Published Online,11 January 2013.
[17]Seema P,Deepa B,Dhananjay D M,et al.Stimulation of ovarian stem cells by follicle timulating hormone and basic fibroblast growth factor during cortical tissue culture[J].J Ovarian Res,2013,6:20.
