纺织用嗜热内切-1,4-β-葡聚糖酶在大肠杆菌中的重组表达、纯化与酶学性质
2013-10-25郑春阳魏国祥
郑春阳,王 磊,魏国祥,王 巍
纺织用嗜热内切-1,4-β-葡聚糖酶在大肠杆菌中的重组表达、纯化与酶学性质
郑春阳,王 磊,魏国祥,王 巍
(天津强微特生物科技有限公司, 天津 300384)
首先从Pyrococcus horikoshii中克隆出编码热稳定性的内切纤维素酶基因,以载体pet21a为表达质粒,构建重组质粒pet21a-1171,并转化至大肠杆菌BL21(DE3)plys中进行表达,目的基因得到明显的可溶性表达,通过加热变性处理和离心后,重组酶纯度达到80%以上,随后对加热处理后的粗酶液进行简单酶活测定,结果表明,最适反应温度为95℃,与国外文献报道相一致,嗜热内切-1,4-β-葡聚糖酶成功得到重组可溶性表达。
内切葡聚糖酶;超嗜热古菌;重组表达
0 引言
当前,极端微生物以丰富的代谢类型和生活环境的多样性,引起了科学界和企业界的极大兴趣,由于目前应用的酶经常在高温、强碱等极端环境下易失活,使酶的应用受到一定的局限,而极端酶的优势正好弥补了传统酶的缺陷,因此从嗜极菌中开发新酶源成为近几年研究的热点[1]。
目前,在现有的纺织应用领域(例如织物处理、洗涤、柔化、人造丝加工)中,使用传统的混合型纤维素酶制剂,会对纤维主体结构造成不必要的损伤,较优选择是使用只有内切纤维素酶活性的单一组分纤维素酶。而目前市场上所用的只有内切纤维素酶活的中性纤维素酶产品主要来源于国外公司,如诺维信、杰能科,由于国外知识产权的保护及菌种构建的难度,到目前为止,国内仍没有一家企业能够生产该类产品。而由于织物处理及生物抛光是一个高温处理过程,如能开发出嗜热只有单一内切纤维素酶活性的极端酶制剂,将能更适合用于纺织行业降解天然结晶纤维素过程。因此,本研究通过引物设计对来自于中已知具有水解结晶纤维素[2]的能力的内切-1,4-β-葡聚糖酶进行了基因克隆、重组表达、提取纯化等方面的研究,以实现极端耐热酶制剂国产化的目的。
1 材料与方法
1.1 菌种与质粒
大肠杆菌BL21(DE3) plys宿主购自于Promega公司,基因组DNA购自美国菌种保藏中心,编号为ATCC700860;质粒pET-21a购于Novagen公司。
1.2 酶和试剂
Vent DNA聚合酶和限制性内切酶购自NEB公司;T4 DNA连接酶和DNA标准分子量等购于TAKARA公司;胶回收试剂盒和质粒抽提试剂盒购自QIAGEN公司;氨苄青霉素和IPTG购自SIGMA公司。
1.3 引物设计
引物由生工生物工程(上海)有限公司合成(见表1)。

表1 引物设计
1.4 PCR扩增及重组质粒构建
的PH1171基因片段(第85-1248位碱基)ph1171-sgc的获得:
以基因组DNA为模板进行PCR的体系如下表2所示:

表2 PCR体系
PCR循环的条件为表3所示:
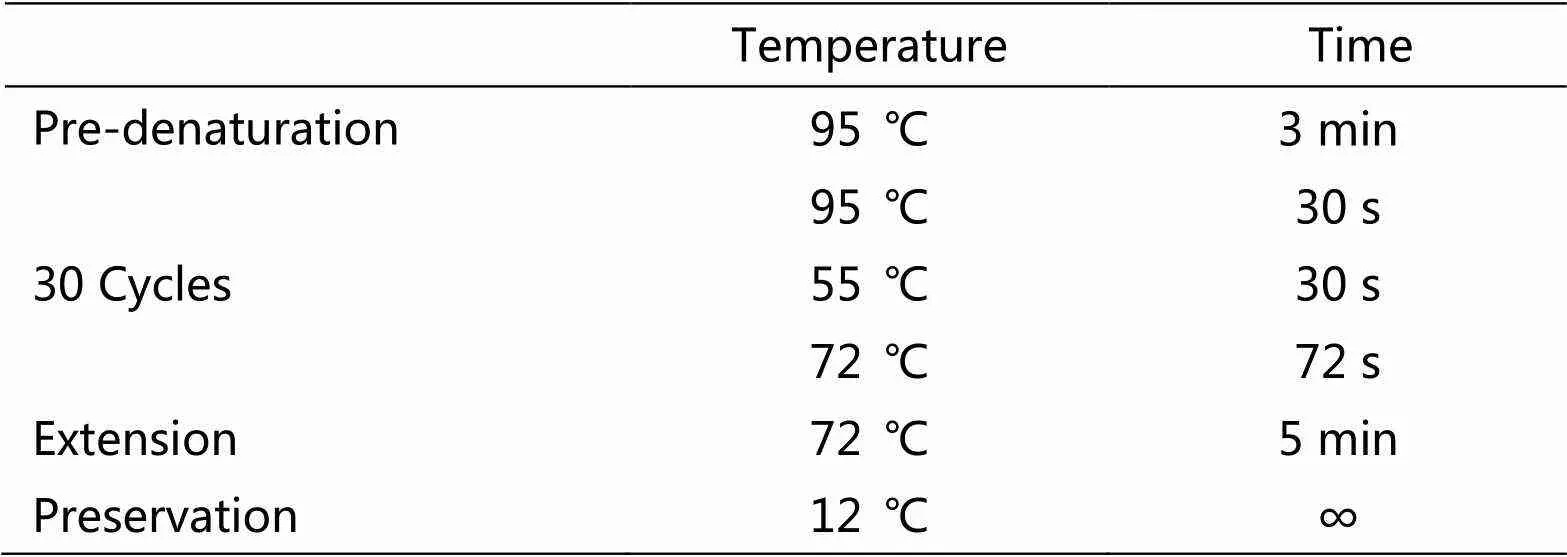
表3 PCR循环的条件
去除类SD序列的ph1171-sgc的获得和重组质粒的构建:
首先以ph1171-sgc为模板,分别采用phEG-SG-C-F、Mut-SD-R和Mut-SD-F、phEG-SG-C-R获得不包含类SD序列的ph1171-sgc的两个部分,之后采用拼接PCR,获得了不包含SD序列的ph1171-sgc-mut-sd,该片段经Nde I和Not I双酶切后连入pET21a,获得表达质粒pET21-ph1171-sgc-mut-sd。
1.5 phEG-sgc的诱导表达
phEG-sgc的表达菌株经由pET21-ph1171-sgc-mut-sd转化大肠杆菌BL21(DE3)获得,表达条件为37 ℃,200 r/min,LB培养基培养,接种时加入终浓度为100 µg/mL的氨苄青霉素,培养至OD= 0.6,再加入IPTG至终浓度0.1 mmol/L诱导表达3 h。中间分别于诱导后1.5 h及3 h取样。4167 r/min离心收集菌体,超声波破碎(条件:总时间2 min,开2 s,关2 s,功率50%,冰浴),取样80 µL作为全蛋白样品,余样再于12000 r/min,4 ℃条件离心10 min,再取80 µL上清作为破菌上清,分别加入20 µL 5×SDS PAGE 上样缓冲液后加热处理,12% SDS-PAGE电泳分析得出结果。
1.6 phEG-sgc的简单纯化及酶学性质研究
上述菌体经超声破碎后直接置于75 ℃加热30 min,并于12000 r/min,4 ℃条件下离心30 min后,分别取其上清及沉淀制备电泳样,采取12%SDS-PAGE电泳分析。然后,再采用加热离心后的上清作为粗酶液,蛋白含量经Bradford法测定标准化后,以0.5%羧甲基纤维素钠(CMC-Na)作为水解底物,采用pH5.6,100 mM醋酸缓冲液,分别于75 ℃,80 ℃,85 ℃,90℃,95 ℃,100 ℃条件下反应30 min,分别检测酶活力及其最适反应温度。酶活力单位定义:1 mg酶蛋白,在pH﹦5.6条件下,每分钟水解羧甲基纤维素钠,产生1.0 µg的葡萄糖,即为1个酶活单位,以U/mg表示。其中,葡萄糖浓度采用DNS法[4]检测。
2 实验结果
2.1 PCR扩增结果
的PH1171基因(NCBI基因编号: 1443490)全长1377个碱基,编码的内切葡聚糖酶蛋白全长459个氨基酸,其中第1-84位碱基编码一个包含28个氨基酸的信号肽。移除1249-1377位碱基编码的C末端部分残基不影响内切葡聚糖酶的活性,同时能够显著提高其在大肠杆菌中的表达量[1],所以我们设计引物phEG-SG-C-F和phEG-SG-C-R,以基因组DNA为模板,通过PCR方法获得了PH1171基因第85-1248位碱基片段ph1171-sgc(图1),经过1%琼脂糖凝胶电泳后,在1200 bp处得到单一且清晰的DNA条带,与理论大小相吻合。
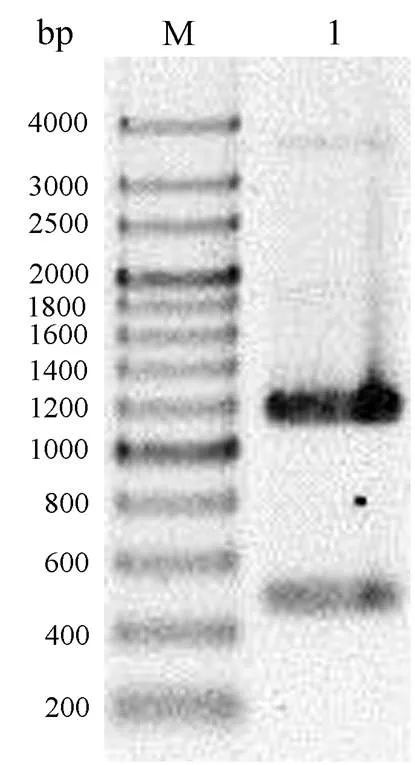
图1 h1171-sgc 基因片段的PCR结果
LANE M: protein molecular marker; LANE 1: the ph1171-sgc gene fragment
2.2 phEG-sgc的诱导表达
由图2我们可以得知,在分子量44 kDa附近有一条蛋白在经诱导后得到明显表达。且在诱导后0-3 h内随着时间的延长,目的蛋白的表达量有明显增加。
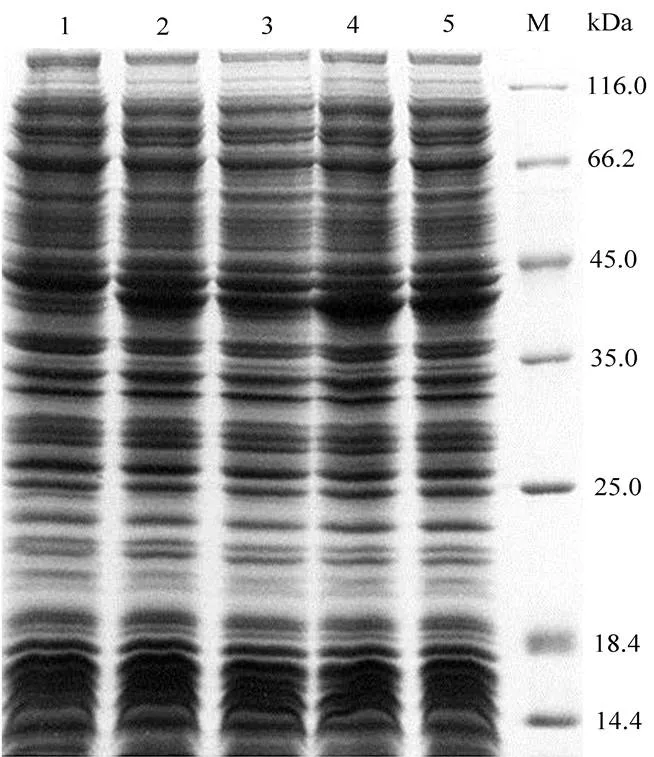
图2 重组phEG-sgc蛋白的诱导表达电泳图片
LANE M:protein molecular marker; LANE 1:Control of the total protein before induction; LANE 2:total protein after 1.5 h induction; LANE 3: supernatant of the broken cells after 1.5 h induction; LANE 4: total protein after 3 h induction; LANE 5: supernatant of the broken cells after 3h induction
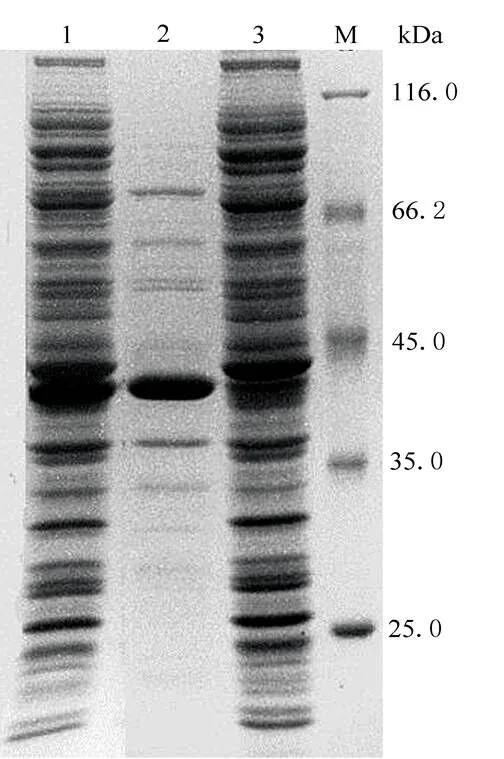
图3 经过热处理后重组phEG-sgc蛋白的诱导表达电泳图片
LANE M:protein molecular marker; LANE 1: total protein after induction; LANE 2:supernantant protein after 75℃ heat treatment; LANE 3:precipitant after 75℃ heat treatment.
2.3 蛋白纯化与酶学性质研究
诱导表达的嗜热内切-1,4-β-葡聚糖酶经过简单75 ℃加热处理后,同样由图3可知,溶液中的杂蛋白大多数均变性沉淀除去,试验证明只要采用简单的离心或膜过滤就可以得到纯度高达80%以上的酶蛋白。随后,经过75 ℃、80 ℃、85 ℃、90 ℃、95 ℃、100 ℃下简单酶活性测定试验,得知该酶在95 ℃具有最大酶解反应速度(见图4),与国外文献报道[1]相一致。
3 讨论
极端嗜热菌是一类嗜极端高温的厌氧真细菌,虽然产生的酶普遍具有很好的热稳定性及最适反应温度比较高的特点,但也存在着菌体生长条件苛刻,细胞密度低,不适合工业化生产的问题。可喜的事是,目前人们已经利用基因克隆及外源重组表达技术实现了外源酶在常温菌中的表达,彻底解决了极端酶不易大规模表达生产的问题。在本研究中采用同样技术成功地实现了嗜热内切-1,4-β-葡聚糖酶在大肠杆菌表达系统中可溶性表达,并进行了部分纯化及酶学性质研究,但对于pH、金属离子、染料及表面活性剂等对酶活性的影响,以及Km的测定,由于客观因素的原因,还没来得及做更为深入的研究。而且,更为重要的是,关于极端酶的进一步改造开发及应用,必须进行高温生物酶抛光等相关试验,如采取小型规模条件下模拟纺织处理工艺,采用织物手感、纹路、光泽、色光变化、强力损失、重量损失及成本等指标[3]来综合评价嗜热酶用于纺织处理工艺的可行性以及存在的问题,避免盲目开发及无谓的浪费。而且相关文章表明[1],今后很有必要在保证酶的催化中心和底物结合中心不变的情况下,尽可能缩短极端酶的分子量,体积小的改造酶将更容易进入长链纤维间的缝隙来降解葡聚糖,提高其酶活力及表达量,使其更加高效地应用于工业生产实践。
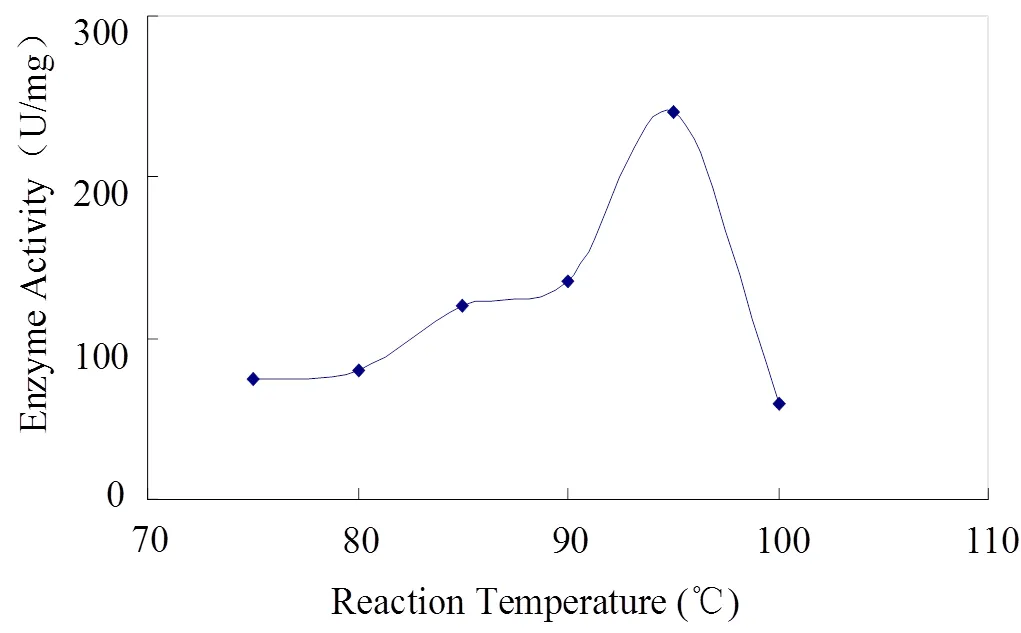
图4 重组嗜热内切-1,4-β-葡聚糖酶的最适反应温度
[1] Kashima Y, Mori K, Fukada H, et al. Analysis of the function of a hyperthermophilic endoglucanase from Pyrococcus horikoshii that hydrolyzes crystalline cellulose[J]. Extremophiles, 2005, 9: 37-43.
[2] Ando S, Ishida H, Kosugi Y, et al. Hyperthermostable endoglucanase from Pyrococcus horikoshii[J]. Appl Environ Microbiol, 2002,68: 430-433.
[3] 范学兰,牛乐珍. 酸性纤维素酶对棉针织品的整理[J]. 针织工业,1996,(2):16-22.
[4] 李相前,邵蔚蓝. 极耐热内切葡聚糖酶Cel12B的基因克隆、表达和酶学性质的研究[J]. 南京师大学报(自然科学版),2006,29(3):71-75.
Recombinant Expression, Purification and Enzymatic Properties of the Thermophilic Endo-1, 4-Beta-Glucanase In
ZHENG Chun-yang, WANG Lei, WEI Guo-xiang, WANG Wei
(Tianjin Robustnique Corporation Ltd., Tianjin 300084, China)
Firstly,the endo-1, 4-beta-glucanase genes fromwascloned followed by the construction of the recombinant plasmidpet21a-1171. Then the recombinant plasmid was transformed intoBL21 (DE3) plys, which showed the obvioussoluble expression. Thepurityoftherecombinant enzymehasreachedmore than 80% byheatdenaturation treatmentand centrifugation. A simpleenzymatic assaysshowed that the optimalreaction temperature is 95℃. The expression of recombinant soluble thermophilic endo-1, 4-beta-glucanase has been successfully established.
Endoglucanase; Hyperthermophilic Archaeon; Recombinant Expression
Q939.97
A
2095-414X(2013)03-0031-04
郑春阳(1976-),男,博士,副高级工程师,研究方向:极端工业酶制剂.
天津市滨海新区科技小巨人成长计划-科技型企业创新发展(科技创业)项目(2010-BK130070),科技型中小企业技术创新基金项目(11C26211203970),天津市滨海新区重大科技项目(2011-BK120014),天津市科技计划项目(12ZCZDSY01800).
