甜叶菊渣中总黄酮的纯化工艺研究
2013-10-25史高峰王红玉陈学福王国英宫建辉
史高峰,王红玉,陈学福,王国英,宫建辉
兰州理工大学石油化工学院,兰州 730050
甜叶菊(Stevia rebaudiana Bertoni)属菊科多年生草本植物,原产于南美巴拉圭和巴西[1],是目前已知甜度较高的糖料植物之一。甜叶菊性味甘、平,不仅富含甜菊糖苷,还含有甾醇类和黄酮类成分[2]。黄酮类化合物具有抗菌、抗病毒、抗肌瘤、抗氧化、抗自由基、抗炎、镇痛和保肝等活性[3]。甜叶菊中的黄酮类化合物具有良好的降糖降压降脂的生物活性[4]。目前关于甜叶菊黄酮类化合物的研究尚不充分,尤其是在甜叶菊黄酮的分离纯化方面,报道很少,而大孔吸附树脂是近十几年发展起来的一类有机高分子聚合物吸附剂,近年来已广泛用于植物有效成分的分离纯化,如分离纯化皂苷、黄酮、生物碱等[5-7]。因此,本研究对大孔吸附树脂及溶剂萃取法分离纯化甜叶菊总黄酮进行初步的研究,探索适宜的纯化条件,为甜叶菊叶活性成分的研究提供新的实验依据,为合理开发甜叶菊资源提供必要的科学依据。
1 材料与仪器
1.1 材料与试剂
甜叶菊(甘肃酒泉)经兰州大学药学系马志忠教授鉴定;芦丁标准品(纯度≥92.5%),中国药品生物制品检定所;D101、NKA-9、AB-8型大孔吸附树脂(安徽三星树脂科技有限公司);实验室自制蒸馏水、甲醇(分析纯,天津市凯通化学试剂有限公司)。
1.2 仪器与设备
U-2001紫外可见分光光度计(Hitachi,Ltd.,日本东京);AL204电子分析天平[梅特勒-托利多仪器(上海)有限公司];SHZ-D(III)型循环水真空泵(天津华鑫仪器厂);RE-3000旋转蒸发器(上海亚荣生化仪器厂);DHG-9053A型电热恒温鼓风干燥箱(扬州鸿都电子有限公司);EQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);HH-2数显恒温水浴锅(国华电器有限公司)。
2 实验方法
2.1 芦丁标准曲线的绘制
准确称取5 mg芦丁标准品,甲醇超声溶解于25 mL容量瓶中,定容至刻度,摇匀,即得到浓度为0.2 mg/mL芦丁标准溶液。准确吸取芦丁标准溶液0.2、0.6、1.0、1.4、2.2、3.0 mL 分别置于 10 mL 的容量瓶中,依次加入5%NaNO2溶液0.3 mL,摇匀,放置6 min,再加入10%Al(NO3)3溶液0.3 mL,摇匀,放置6 min,最后加入4%NaOH溶液4.0 mL,用无水甲醇定容,摇匀,此时溶液颜色变为橙红色,放置15 min,以甲醇作空白,在510 nm波长处测定吸光度,以吸光度为纵坐标,芦丁标准溶液的浓度(mg/mL)为横坐标绘制标准曲线。其线性回归方程为:A=8.8051C-0.0042,R2=0.9997 [A 为吸光度,C为总黄酮质量浓度/(mg/mL)]。结果表明,在芦丁质量浓度为0.004~0.060 mg/mL范围内线性关系良好。
2.2 甜叶菊总黄酮粗提物的制备
称取甜叶菊渣100 g,在乙醇体积浓度80%、提取时间2.5 h、料液比1∶20(g/mL)、温度80℃的条件下回流提取3次,合并提取液真空浓缩至无醇味,干燥得粗黄酮浸膏,纯度为20.56%,蒸馏水超声溶解配制1.2 mg/mL的总黄酮样液,4℃冷藏备用。
2.3 大孔树脂的预处理
分别称取适量的AB-8、D101、NKA-9三种树脂,用体积分数为95%的乙醇浸泡24 h,使其充分溶胀和初步除杂,用湿法装柱,继续用95%的乙醇以适当流速通过柱子,用乙醇洗涤至流出液加适量蒸馏水无白色浑浊现象后,再用蒸馏水洗净乙醇。然后用5%HCl溶液浸泡3 h后蒸馏水洗至中性,再用4%NaOH溶液浸泡3 h后蒸馏水洗至中性,用蒸馏水浸泡备用[8]。
2.4 大孔吸附树脂类型的筛选
2.4.1 大孔树脂吸附率和解吸率的测定
本实验选取AB-8、D101、NKA-9三种不同型号的大孔吸附树脂对甜叶菊黄酮粗提液进行处理,探讨适合甜叶菊黄酮的最优树脂。分别取预处理好三种大孔吸附树脂各5.0 g,分别置于250 mL锥形瓶中,各加入总黄酮溶液(浓度1.2 mg/mL)50 mL,塞上塞子,120 rpm、30℃恒温振荡24 h,充分吸附后抽滤,测定滤液中黄酮质量浓度,计算各树脂吸附率。将吸附饱和的大孔树脂加蒸馏水洗至糖的Molish反应为阴性,再用70%乙醇50 mL,120 rpm、30℃恒温振荡24 h,抽滤,收集滤液测定滤液中的黄酮质量浓度,计算各树脂的解吸率。
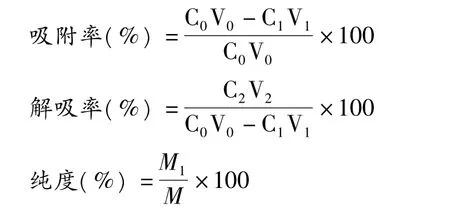
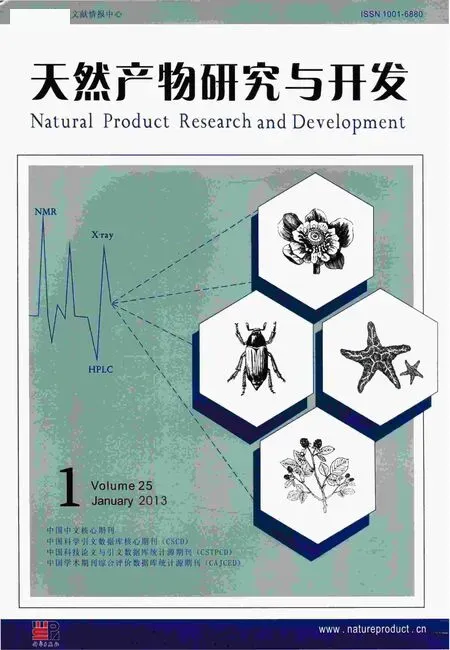
C0:吸附前样品液中总黄酮质量浓度mg/mL;V0:吸附前样液体积mL;
C1:吸附后残液中总黄酮质量浓度mg/mL;V1:吸附后残液体积mL;
C2:解吸液中总黄酮质量浓度mg/mL;V2:解吸液体积mL;
M1:黄酮质量;M:浸膏质量;
2.4.2 大孔吸附树脂的静态吸附动力学特性测定
进行静态吸附动力学测定,进一步筛选最佳树脂。准确称取处理好的树脂5.0 g,用滤纸吸干表面水分,装入250 mL锥形瓶中,加入质量浓度为1.2 mg/mL黄酮提取液50 mL,120 rpm、30℃恒温振荡吸附,每隔1 h取样1 mL,测定其黄酮质量浓度,绘制静态吸附动力学曲线[9]。
2.4.3 大孔树脂的动态吸附实验
由筛选实验筛选出一种理想大孔吸附树脂,称取15 g已经预处理的最佳树脂,湿法装入1.5×25 cm层析柱中,考察上样流速、上样液质量浓度、上样液pH值、上样量、解吸液体积浓度、用量以及流速等进行动态吸附及解吸实验,确定最佳工艺条件。
2.5 溶剂萃取法纯化总黄酮
通过研究溶剂种类、萃取温度、萃取次数3个单因素对大孔树脂纯化后总黄酮纯度的影响,筛选出溶剂萃取法的最佳工艺条件。
3 结果与分析
3.1 大孔树脂的筛选
3.1.1 3种大孔树脂吸附量与解吸率
如表1所示,虽然AB-8和D101大孔树脂的解吸率差不多,却明显高于NKA-9,而且AB-8的吸附率高于D101和 NKA-9,实验中选择AB-8和 D101这2种树脂通过静态吸附动力学曲线进行进一步筛选。

表1 3种大孔树脂的静态吸附和解吸Table 1 Static adsorption rates and desorption rates of three types of macroporous resins
3.1.2 大孔树脂静态吸附动力学曲线
在树脂静态吸附过程中,吸附动力学曲线反映了吸附量与吸附时间之间的关系。流出液中黄酮的浓度越大就说明吸附量越小,从图1看出,大孔吸附树脂AB-8、D101在4 h以内流出液黄酮浓度波动较大,呈下降趋势,即吸附量波动较大,呈上升趋势;5 h后趋势变缓,2种树脂对甜叶菊总黄酮的吸附饱和时间都在5 h左右,但从总体上来看AB-8吸附量始终优于D101,故选取AB-8进行产品纯化。
3.2 大孔树脂对黄酮的动态吸附与解吸
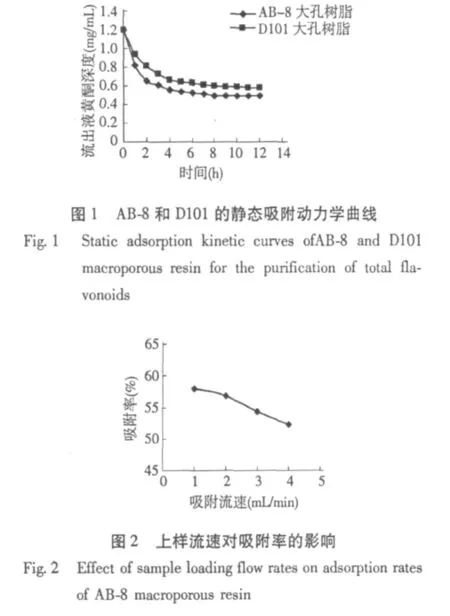
3.2.1 上样流速对AB-8吸附的影响
取甜叶菊黄酮提取液50 mL(1.2 mg/mL),以不同的流速上样,测定吸附后溶液中总黄酮浓度,计算吸附率。结果如图2所示,吸附率随上样流速增大而降低,流速在1 mL/min~2 mL/min时,下降趋势小;在2 mL/min~4 mL/min时下降趋势明显较大。其原因可能是流速较慢时提取液与树脂接触的时间较长,有利于黄酮类物质从液相扩散到树脂内部,从而提高了吸附率[10]。因此,为了节省时间,选择上样流速为2 mL/min。
3.2.2 上样液质量浓度对AB-8吸附的影响
将甜叶菊黄酮溶液稀释成0.38、0.75、1.20、1.50、1.93、2.50 mg/mL 等不同浓度的上样液,各50 mL,以2 mL/min的流速上样,测定吸附后溶液中总黄酮浓度,计算吸附率。结果如图3所示,当样液浓度小于1.5 mg/mL时,随着样液浓度的增大,吸附率增大;当样液浓度为1.5 mg/mL时,吸附率达到最大值;随后,随着样液浓度的增大,吸附率减小。所以,并不是浓度越大吸附效果越好,药液的澄清度也会影响树脂的吸附效果,且如果样品溶液浓度超过了树脂吸附极限,黄酮类物质就会过早流出,导致吸附率降低。因此,选择上样液质量浓度为1.5 mg/mL。

3.2.3 上样液pH值对AB-8吸附的影响
将浓度为1.5 mg/mL的甜叶菊总黄酮提取液分别调成 pH 2.5、3.5、4.5、5.5,以 2 mL/min 流速上样,测定吸附后溶液中总黄酮浓度,计算吸附率。由图4可知,样液的pH值对吸附率的影响较大。在pH 3.5时吸附率达到最大值,之后,随着pH的增大,吸附率反而减小。这是由于黄酮类化合物具有多羟基酚结构,呈弱酸性,在酸性条件下呈分子状态,以氢键方式被吸附,因而树脂吸附量大,但若酸性过强,黄酮类化合物易生成烊盐,使吸附效果变差。碱性增大则H质子易于被强碱俘获,使酚羟基上的氢解离形成酸根离子,与树脂的结合减弱从而使吸附量降低[11]。因而AB-8在弱酸性或酸性条件下对甜叶菊总黄酮吸附的效果较好。因此,上样液pH值控制在3.5左右。
3.2.4 上样量对AB-8吸附的影响
取甜叶菊黄酮提取液,浓度为1.5 mg/mL,pH为3.5,以2 mL/min的流速上样,收集每1 BV的流出液,测定流出液中总黄酮浓度。结果如图5所示,随着上样量的增大,流出液中总黄酮的浓度呈上趋势。当上样量达到4 BV时,黄酮浓度达到0.17 mg/mL,超过上样浓度的10%,已达到泄漏点,因此,选择上样量为4 BV。

3.2.5 解吸液体积浓度对AB-8吸附及黄酮纯度的影响
取甜叶菊黄酮提取液,浓度为1.5 mg/mL,pH为3.5,以2 mL/min的流速上样4 BV,分别用水、10%、30%、50%、70%、90%等不同体积分数的乙醇进行洗脱,解吸液为4 BV。测定解吸液中总黄酮浓度,计算解吸率及纯度。结果如图6所示,当乙醇浓度小于50%时,解吸率和黄酮纯度都随乙醇体积分数的增加而增大,50%乙醇解吸率最大,当乙醇体积分数大于50%时,解吸率及纯度都呈下降趋势。可能是由于乙醇体积分数增大,醇溶性的杂质增多,降低了解吸率和总黄酮纯度。因此,选择乙醇体积分数为50%。
3.2.6 解吸流速对AB-8吸附的影响
取甜叶菊黄酮提取液,浓度为1.5 mg/mL,pH 3.5,以2 mL/min的流速上样4 BV,分别用50%的乙醇溶液以1、1.5、2、2.5 mL/min的流速解吸。测定解吸液中总黄酮浓度,计算解吸率。结果如图7所示,当解吸流速小于1.5 mL/min时,解吸率随着解吸流速的增大而增大;解吸流速为1.5 mL/min时,解吸率达到最大值;解吸流速大于1.5 mL/min时,解吸率反而随着解吸流速的增大而减小。这是由于解吸流速太慢时,解吸时间长、解吸的杂质多;流速太快时,解吸液与大孔树脂接触时间太短,导致解吸不完全。因此,选择解吸流速为1.5 mL/min。

3.2.7 解吸液量对AB-8吸附的影响
取甜叶菊黄酮提取液,浓度为1.5 mg/mL,pH为3.5,以2 mL/min的流速上样4 BV,用50%的乙醇溶液以1.5 mL/min的流速解吸。收集每1 BV的解吸液,测定解吸液中黄酮浓度,计算解吸率。结果如图8所示,在解吸量小于5 BV时,随着解吸量的增大,解吸率急剧上升;解吸量大于5 BV时,解吸率变化不大,说明总黄酮已基本洗脱完全。考虑到溶剂的消耗,因此,选择解吸液量为5 BV。
3.2.8 动态吸附解吸验证
准确称取120 g经预处理好的AB-8型大孔树脂2份,装入3 cm ×50 cm层析柱,在最佳工艺条件下初步分离纯化甜叶菊渣中总黄酮。最佳工艺条件:上样液质量浓度为1.5 mg/mL,上样液pH 3.5,吸附流速为2 mL/min,上样量为4 BV进行动态吸附。树脂经饱和吸附后,以蒸馏水洗脱至无色,除去水溶性的杂质。然后用50%的乙醇进行解吸,解吸流速为1.5 mL/min,收集5 BV的解吸液,真空浓缩,干燥得棕黄色的总黄酮粉末。用紫外分光光度法测得纯化后的总黄酮纯度为50.11%,约为纯化前的2.5倍。
3.3 溶剂萃取法纯化总黄酮
3.3.1 溶剂种类对甜叶菊总黄酮的影响
取AB-8大孔树脂纯化后的总黄酮0.1 g三份,蒸馏水超声溶解于20 mL烧杯中,常温下,分别用等体积的乙醚、乙酸乙酯、氯仿萃取总黄酮,萃取3次,合并有机相,回收溶剂,干燥得淡黄色的总黄酮粉末,测黄酮的得率及纯度。结果如图9所示,乙酸乙酯萃取总黄酮得率和纯度均最高,乙醚萃取效果次之,氯仿萃取效果最差。原因可能是由于乙醚萃取的脂溶性成分较多,使活性物质黄酮溶出减少,降低了得率和纯度,而氯仿由于极性太小,萃取出的黄酮少。故选择乙酸乙酯为萃取溶剂。

图9 溶剂种类的影响Fig.9 Effect of types of solvent
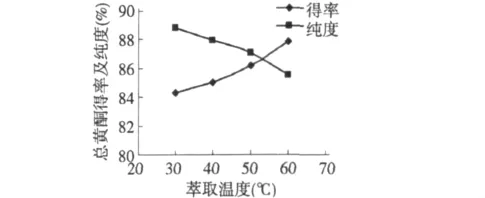
图10 萃取温度的影响Fig.10 Effect of extraction temperature
3.3.2 萃取温度对甜叶菊总黄酮的影响
如3.3.1方法制备总黄酮样液,用等体积的乙酸乙酯分别在30、40、50、60℃下萃取总黄酮,萃取3次,测黄酮的得率及纯度。结果如图10所示,随着萃取温度的升高,总黄酮得率升高,而纯度却降低了。原因是由于随着温度的升高,黄酮的溶解度增大,得率就高,但杂质的溶解度也增大了,所以就导致纯度下降了。考虑到升高温度会增大溶剂的蒸发,浪费溶剂,还增加热能的消耗,故选择30℃,也就是常温下萃取。
3.3.3 萃取次数对甜叶菊总黄酮的影响
如3.3.1方法制备总黄酮样液,在常温下,用等体积的乙酸乙酯萃取总黄酮,测每次萃取的总黄酮的得率及纯度。结果如图11所示,随着萃取次数的增加,总黄酮得率呈上升趋势,但当萃取次数达到5次时,总黄酮得率趋势平缓,考虑到溶剂的浪费,故选择萃取5次。

图11 萃取次数的影响Fig.11 Effect of extraction times
3.3.4 溶剂萃取验证
取三份初步纯化的总黄酮,用乙酸乙酯在常温条件下萃取5次,纯度由50.11%上升到91.8%。
4 结论
AB-8型树脂对甜叶菊总黄酮的吸附量大、吸附率高、易解吸,产品纯度较高,是一种良好的黄酮吸附剂,适用于甜叶菊总黄酮的纯化。最佳纯化条件为:吸附流速2 mL/min、上样液质量浓度1.5 mg/mL、上样液pH 3.5、上样量4 BV、解吸液为体积分数50%乙醇溶液,解吸流速1.5 mL/min、解吸量5 BV,经处理后总黄酮纯度为50.11%,约为纯化前的2.5倍。后用乙酸乙酯在常温条件下萃取5次,得到甜叶菊渣中总黄酮纯度为91.8%。结果表明:通过AB-8大孔树脂吸附和乙酸乙酯萃取相结合的方法,能很好的纯化甜叶菊渣中总黄酮。
1 Hanson JR,Deoliveira BH.Stevioside and related sweet diterpenoid glycosides.Nat Prod Rep,1993,10:301-309.
2 Shi RB(石任兵).Active fraction of Stevia Rebaudinna and its activity and its application.CN200710163453.6,2008-04-09.
3 Ouassila T,Zahia K,Ignacio B,et al.Flavonoids of Campanula alata and their antioxidant activity.Chem Nat Comp,2011,46:968-970.
4 Shi RB(石任兵).A method of simultaneous preparation of stevia glycosides and total flavonoids of Stevia rebaudiana Bertoni.CN2007101 11313.4,20 07-06-18.
5 Wang Z(王梓),Li W(李伟),Li YR(李月茹),et al.Purification of platycodins from Platycodonis Radix by macroporous resin.Chin Tradit Herb Drugs(中草药),2011,42:1743-1746.
6 Tian H(田徽),Ruan QP(阮期平),Lai EY(赖恩阳),et al.Studies on adsorption characteristics and purification process of flavonoids from Kalimeris indica(L.)Sch.Bip by macroreticular resin.Food Ferment Ind(食品与发酵工业),2012,38:224-229.
7 Liu S(刘韶),Zhang W(章伟),Lei P(雷鹏),et al.Separation and purification of alkaloids from radix of Zanthoxylum nitidum by macroporous adsorption resin.China J Chin Mater Med(中国中药杂志),2008,33:377-379.
8 Luan YF(栾云峰),Wang F(王菲),Liang S(梁爽),et al.Macroporous resin adsorption for purification of total flavonoids from Actinidia arguta fruits.Food Sci(食品科学),2011,32:145-149.
9 Ma YM(马彦梅),He YX(何艳熙),Tong DJ(童得军),et al.Sorption and desorption of Elaeagnus angustifolia flavonoids with macroporous resins.Modern Food Sci Technol(现代食品科技),2009,25:144-145,175.
10 Lin YR(林燕如),Cao QY(曹迁永).Study on the purification of flavonoid from the leaves of Cibotium barometz(L.)J.Sm.by macroporous resin.Hubei Agric Sci(湖北农业科学),2011,50:583-586.
11 Liu ZX(刘志祥),Zeng CZ(曾超珍),Zhang Y(张玥).U-sing AB-8 macroporous resin for the separation and purification of total flavonoids from Folium Ilicis Cornutae.Food Sci(食品科学),2010,31(12):76-79.