海洋沉积环境来源真菌次生代谢产物的研究
2013-10-25王发左
黄 智,王发左,张 偲*
中国科学院南海海洋研究所中国科学院海洋生物资源可持续利用重点实验室中国科学院海洋微生物研究中心广东省海洋药物重点实验室,广州 510301;2中国科学院研究生院,北京 100049
特殊的生态环境造就了特殊的生物,特殊的生物往往孕育着特殊的化学结构和特异的生物活性。目前从陆地微生物资源中寻找具有良好生物活性和结构新颖代谢产物的概率越来越低,海洋微生物作为新兴的生物资源,具有极大的吸引力[1]。作为海洋微生物中的重要类群,海洋真菌具有代谢产物结构与活性丰富多样、“创新指数”高、产量大等特点,已经成为海洋微生物次生代谢产物研究的热点[1,2]。据 Rateb 等统计,仅 2006-2010 年来自海洋真菌新化合物的数量就达到690个,但其中海洋沉积环境来源的仅占16%[3]。作为地球上最大面积的覆盖层,海洋沉积环境是富含化学物质和微生物的特殊生态环境,从海岸带、近海至深海蕴育着高度多样的微生物物种、基因、生理生化和生态功能物质[4,5]。海岸带是陆地向海洋过渡的生态系,如海滩和红树林沉积物,受周期行潮水侵淹,光照良好,氧气充足,适合微生物生长;近海作为大陆架的水下延伸,由于大量的外部径流搬运和海蚀作用,沉积物来源丰富,微生物的种类繁多;在低于1000 m的深海区域,覆盖了50%以上的地球表层,是一个永久高压、低温、寡营养和无光照的环境,生活在这种极端环境下的深海微生物必然有其特殊的代谢机制和独特的代谢产物[6,7]。
目前,海洋沉积环境来源的真菌次生代谢产物的研究多集中于海岸带和近海,深海研究相对较少。海洋沉积环境来源真菌的化学结构出新率高,抗菌、抗肿瘤等生物活性显著,具有潜在应用价值,是开发新抗菌、抗肿瘤等药物的新兴资源[2,3,8,9]。本文收集了1995~2011年间200个海洋沉积环境来源真菌的次生代谢产物,包括物碱类(86个)、萜类(42个)、聚酮类(42个)、肽类(15个)、甾体类(5个)、脑苷脂类(4个)和其他类(6个),分布于真菌的16个属中。
1 海洋沉积环境来源真菌次生代射产物
1.1 Penicillium属
1.1.1 生物碱类
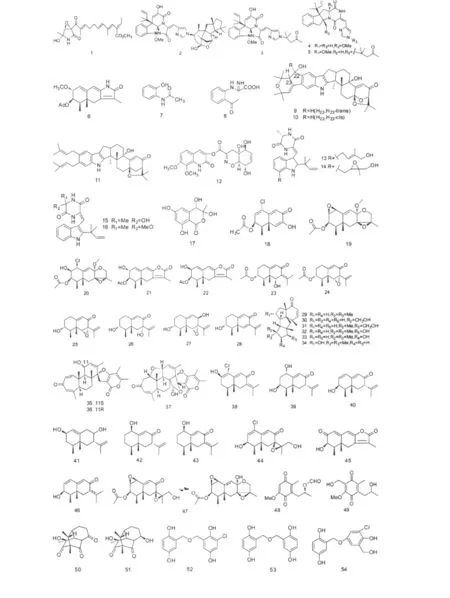
1995年,KAKEYA从日本内浦湾海底沉积物来源真菌Penicillium sp.中分离到能促进神经细胞神经突生长作用的化合物Epolactaene(1),这是首次从微生物中得到对人类成神经细胞瘤细胞的轴突生长有效的化合物的报道。最近研究显示它还能有效抑制哺乳动物DNA聚合酶和DNA拓扑异构酶Ⅱ[10-12]。Du等从5080 m深海沉积物中分离到真菌Penicillium sp.,经培养后得到四个生物碱类化合物Meleagrins B、C(2、3)和 Roquefortines F、G(4、5),其中 meleagrins B(2)对 A-549、HL-60、BEL-7402 和MOLT-4细胞株表现出较强的细胞毒活性,IC50值分别为 2.7、6.7、1.8 和 2.9 μM[13]。
化合物6~8分离自真菌Penicillium sp.(南极Prydz湾海泥)[14]。化合物 ShearinineD-F(9 ~11)是从真菌Penicillium janthinellum(海底沉积物)中分离到,在浓度小于200 μM时这三个化合物对小鼠表皮JB6 P+Cl41细胞株没有毒活性,但Shearinine E能有效抑制表皮生长因子(EGF)介导的小鼠表皮JB6 P+Cl41细胞恶性转化。此外,研究还发现Shearinine D(9)、E(10)对白血病细胞株HL-60具有一定的抑制作用,浓度为100 μM时,抑制率分别为39% 和 34%[15,16]。喹诺酮化合物 Penicillazine(12)分离自真菌 Penicillium sp.(香港海滩)[17]。Zhou等从真菌 Penicillium griseofulvum(深海沉积物)中分离到四个化合物(13~16),其中前三个表现出微弱的抗细胞增殖活性,IC50值分别为135、120和 91 μM[18]。
1.1.2 萜类
Acetophthalidin(17)是从真菌Penicillium sp.分离到的单萜类化合物,在浓度6.25 μgmL-1时,能够有效阻断tsFT210细胞进入M期进行有丝分裂[19]。倍半萜类化合物18~22是从南极Prydz湾海泥来源真菌Penicillium sp.中分离到,其中化合物18显示出良好的细胞毒活性,对HL-60、A-549细胞株的IC50值为11.8和12.2 μM,另外化合物19、20对 A-549 细胞株的 IC50值为 59.7 和 82.8 μM[14]。化合物23~28分离自Penicillium sp.(白令海峡海泥),对HL-60、A-549、P-388和BEL-740细胞株具有不同程度的生长抑制作用,其中具有环氧结构的化合物24、25和27对4种细胞株的细胞毒活性(IC50值介于0.065~11.8 μM)明显强于无环氧结构的化合物23、26和28,这说明环氧结构是发挥其药效的主要功能基团,进一步分析发现带乙酰基的环氧化合物24活性最强,对四种上述细胞株的IC50值分别为0.065、0.096、0.073 和 4.59 μM,证明乙酰基的存在增强其细胞毒活性[20]。
2009年,Du等上述同一株深海沉积物真菌Penicillium sp.中分离到六个萜类化合物Conidiogenones B-G(29~34),这些化合物对四种肿瘤细胞株A-549、HL-60、BEL-7402和 MOLT-4具有一定强度的细胞毒活性作用,其中Conidiogenones C(30)对HL-60和BEL-7402细胞株的IC50值达0.038和0.97 μM[13,21]。同年,Breviane spiroditerpenoid 类衍生物Breviones F-H(35~37)首次被报道从深海极端环境真菌Penicillium sp.中分离到,这些化合物对HeLa细胞株具有中等程度抑制作用,此外,Brevione F(35)还能有效抑制HIV1在C8166细胞株中增殖[22]。林等从南极Prydz湾海泥 Penicillium sp.中分离出10个化合物(38~47),其中化合物44对A-549细胞株的毒活性实验显示 IC50值为5.2 μM[14]。
1.1.3 聚酮类
聚酮类化合物48、49是由两株青霉真菌(日本Fiji/Matuka深海沉积物)混合培养得到,化合物48能选择性地抑制白血病细胞,另外对人乳腺癌细胞株 MDA-MB-435 的 IC50值为 2.9 μgmL-1[23]。Penicillones A和B(50、51)是两个分离自Penicillium terrestre(青岛胶州湾沉积物)的新聚酮类化合物,MTT法评价其对A-549和P-388细胞株的毒活性结果显示这两个化合物都具有弱细胞毒活性[24,25]。龙胆醇二聚体化合物52~58和龙胆醇三聚体化合物59分离自真菌Penicillium terrestre,微生物来源的龙胆醇及其衍生物大多是单体的,而二聚体和三聚体的衍生物是非常罕见的。化合物52~59对HL-60、BEL-7402、A-549和MOLT-4四种癌细胞株都具有不同程度的抑制作用,其中化合物56对这四种癌细胞的抑制活性较强。此外,在浓度为10 μM时化合物56对酪氨酸激酶KDR和Src具有一定强度的抑制作用,抑制率分别为31.8%和35.9%[26]。
1.1.4 肽类和其他类
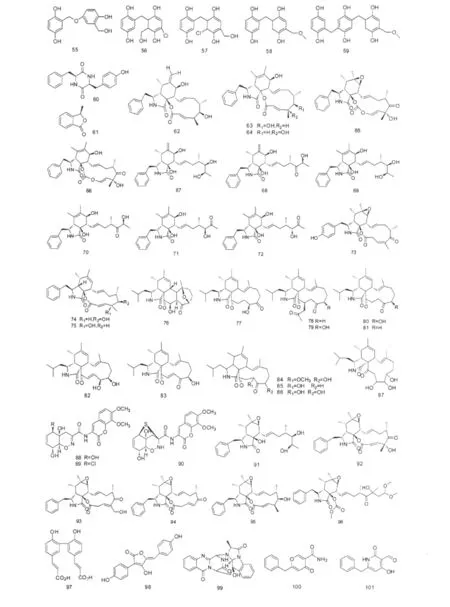
对来源于南极Prydz湾海泥的青霉菌Penicillium sp.的研究,从中分离得到了一个环状苯丙氨酸-酪氨酸缩合肽60和一个苯并呋喃类化合物61[14]。
1.2 Spicaria属
1.2.1 生物碱类
Spicaria elegans是从青岛胶州湾海底沉积物分离得到的一株真菌,Liu等通过静置培养的的方式从中分离到了12元环细胞松弛素Cytochalasins Z7-Z9、E、K(62~66),化合物62~64对 P-388和 A-549细胞株有毒活性作用,IC50值为 8.8、21.0、8.7 μM,其结构中C-6/C-7位是主要的药效基团,其他基团变化对其活性的影响较小[27]。2008年,liu等又发表该真菌来源的7个细胞松弛素(67~73),其中Cytochalasins Z10-Z15(67~72)具有开环型结构,化合物67和68对A-549细胞株的IC50值分别为9.6和 4.3 μM[28]。
随后该研究小组人员通过发酵调控的方式对该株真菌开展了系列的化学多样性和活性研究。2009年,Lin等将真菌Spicaria elegans发酵方式由静置培养改变成摇瓶培养,从中分离到另一类细胞松弛素化合物74~83,其中化合物Spicochalasin A(76)具有独特的五元环体系,对人类白血病HL-60细胞株有中等程度的细胞毒活性,IC50值为19.9 μM。化合物Aspochalasin D(82)对肿瘤细胞株BEL-7402的IC50值达 2.3 μM[29、30]。2010 年,Lin 又从通过延长培养时间(14 d)的方式,从中发现了新化合物Aspochalsins(R-T)(84~86),研究显示延长培养时间可以促进代谢产物的氧化还原反应,进而产生更多的衍生物[31]。2011年,Wang等采用高盐度培养方法,在10%的盐度培养条件下从真菌Spicaria elegans中分离到4个生物碱类化合物87~90,这四个化合物都表现出中等强度的抗菌活性,在低盐度培养时该菌株没有产生化合物87和90[32]。同年,该团队的Wang等通过在培养基中加入L和D型色氨酸,从该真菌中分离到6个松胞菌素91~96,其中化合物91、92和95对A-549细胞株的IC50值分别为 8.2、20.0、3.1 μM[33]。以上研究也表明,通过简单发酵调控方式是可以有效地拓展海洋真菌化学多样性,在一定程度上达到深入可持续利用菌株资源的目的。
1.2.2 聚酮类
聚酮类化合物97、98也是上述真菌Spicaria elegans中分离到,这两个化合物都具有抗菌活性,其中化合物97对细菌Pseudomonas aeruginosa和Escherichia coli的 MIC 值为0.038 和0.767 mM[32]。
1.3 Aspergillus属
1.3.1 生物碱类
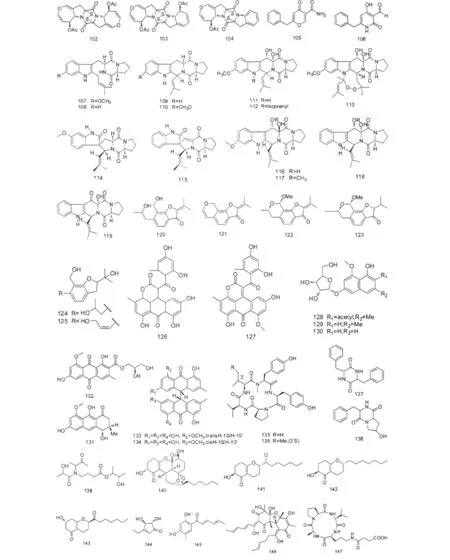
化合物Cottoquinazoline A(99)分离自真菌Aspergillus versicolor(澳大利亚科特斯鲁沙滩)[34]。Zhang等从真菌Aspergillus carbonarius(广西涠洲岛海底沉积物)分离到 Carbonarones A和 B(100~101),这两个化合物对K-562细胞株显示出中等的细胞毒活性,IC50值分别为 56.0、27.8 μgmL-1[35]。二硫化合物 Acetylaranotin、Acetylapoaranotin、Deoxyapoaranotin(102~104)分离自真菌Aspergillus sp.(韩国东海沉积物),研究显示这三个化合物在浓度分别为20、10和50 μM时能诱导HCT116细胞株凋亡速度加快1.93、3.85和3.50倍[36]。化合物105~106分离自真菌 Aspergillus caronarius(广西涠洲岛),这两个化合物都表现出中等的细胞毒活性,对K-562细胞株的EC50值分别为244.54和121.39 μM[21,35]。Cui等从真菌 Aspergillus fumigatus(深海沉积物)分离到系列二酮哌嗪化合物107~119,这些化合物都具有细胞周期抑制活性,其中Tryprostatin A(107)能破坏微导管纺锤体抑制微导管的组装,在浓度分别为50和12.5 μgmL-1时Tryprostatins A、B(107~108)都能使小鼠tsFT210细胞在G2/M时期完全被阻断,化合物109~113抑制该细胞在M期的 MIC 值分别0.45、4.1、60.8、26.1 和12.2 μM,另外化合物Spirotryprostatins A-B(114~115)和Cyclotryprostatins A-D(116~119)抑制该细胞在G2/M时期的 IC50值分别为 197.5、14.0、5.6、19.5、23.4、25.3 μM[37-39]。
1.3.2 聚酮类
2009年,Lu等从真菌Aspergillus ustus(海南文昌红树林木榄植物根系土壤)中分离到6个苯并呋喃衍生物120~125,其中化合物124对HL-60细胞株有较强的抑制作用,IC50值达 0.13 μM[40]。化合物Aspergiolide A(126)能选择性地抑制A-549、HL-60、BEL-7402和P-388肿瘤细胞株,其IC50值分别为0.13、0.28、7.5、35.0 μM,在体内试验显示该化合物能有效抑制大鼠肿瘤细胞生长[21]。系列聚酮化合物127~134分离自真菌Aspergillus glaucus(海洋沉积物),化合物127对A-549和HL-60细胞株表现出很强的细胞毒活性,其IC50值分别为0.24和0.51 mM,从结构分析化合物127是因为8位羟基的甲基化导致细胞毒活性增强。另外,化合物133和顺式异构体134对A-549和HL-60细胞株都表现出中等的细胞毒活性,说明10位的立体异构对细胞毒活性基本没有影响[41]。
1.3.3 肽类
2009年,Fremlin等从真菌 Aspergillus versicolor(澳大利亚科特斯鲁海滩)中分离到两个环五肽类化合物 Cotteslosins A 和 B(135和136)[34]。
1.4 Trichoderma属
1.4.1 生物碱类
2007年,孙等从连云港海域真菌 Trichoderma reesei分离到两个生物碱化合物:3、6-二苄基哌嗪-2、5-二酮(137)和 3-苄基-8-羟基吡咯并哌嗪-2、5-二酮(138)[42]。化合物139分离自南海红树林角果木植物根系土壤真菌 Trichoderma atroviride[43]。
1.4.2 聚酮类
Trichodermatides A-D(140~143)是Sun等从连云港潮间带海泥真菌Trichoderma reesei中分离到的聚酮类化合物,对人黑色素瘤细胞A375-S2的IC50值分别为 102.2、187.3、38.8 和 222.0 μgmL-1[44]。环状戊烯酮类化合物Trichoderone(144)具有选择性的细胞毒活性,对 A-549、NCI-H460、MCF-7、MDAMB-435s、HeLa、DU-145六种肿瘤细胞株都有细胞毒活性作用,但在浓度低于7.02 mM时对正常人肺成纤维细胞(HLF)没有影响,另外该化合物对HIV蛋白酶和Taq DNA聚合酶有抑制作用[45]。化合物145和146分离自真菌Trichoderma sp.(福建沉积物),这两个化合物对HL-60细胞株都有中等程度的细胞毒活性[46]。
1.4.3 肽类
化合物Trichoderide A(147)是由丙氨酸、脯氨酸、缬氨酸和鸟氨酸缩合而成的环四肽,分离自连云港海域潮间带海泥真菌 Trichoderma reesei[47]。Asperelines A-F(148~153)是从真菌 Trichodermaasperellum(南极企鹅岛沉积物)中分离到的系列肽类化合物,这6个化合物的氮端被乙酰化,碳端连接了罕见的脯氨醇残基[48]。环二肽化合物(154~157)分离自真菌Trichoderma atroviride(南海红树林角果木属植物根系土壤)[49]。
1.4.4 甾体类和萜类
甾体化合物158分离自真菌Trichoderma sp.(南海深海沉积物)[45]。化合物159和160分别属倍半萜和降二倍半萜类,分离自真菌Trichoderma reesei(连云港海域潮间带海泥)[42,47]。
1.4.5 其他类
化合物161与化合物159、160来源于同一株真菌[42,47]。化合物162分离自南海红树林植物根系沉积物真菌[49]。
1.5 Emericella属
1.5.1 萜类
二倍半萜化合物163~171属蛇孢菌素类,分离自真菌Emericella variecolor(日本Gokasyo海湾沉积物),其中Ophiobolin K(170)对多种癌细胞表现出较强的细胞毒活性,对P-388细胞株的IC50值为0.27-0.65 μM[50]。
1.6 Alternaria属
1.6.1 生物碱类
2009年,Wang等从真菌 Alternaria raphani(青岛海盐场沉积物)中分离到化合物Alternarosin A(172)和Bisdethiobis(methylthio)acetylaranotin(173),Alternarosin A对三种细菌 Escherichia coli、Bacillus subtilis、Candida albicans的 MIC 值分别为203、203、和 406 μM[51]。
1.6.2 肽类和脑苷脂类
肽类化合物Alternaramide(174)从真菌Alternaria sp.(韩国马山湾沉积物)中分离得到[52]。2009年,Wang等从真菌Alternaria raphani(青岛海盐场沉积物)分离到脑苷脂类化合物Alternarosides A-C(175~177)和 Cerebroside C(178),其中 Alternarosides A-C 对细菌 Escherichia coli、Bacillus subtilis、Candida albicans的 MIC 值为70 ~270 μM[51]。
1.7 Geotrichum属
1.7.1 甾体类
目前被报道来源于Geotrichum属真菌的只有四个甾体化合物179~182,其中化合物180来属双氧桥麦角甾醇,该类化合物不仅能抑制癌细胞生长,而且具有很强的抗氧化活性,能有效抑制脂质过氧化[53]。
1.8 Acremonium属
1.8.1 生物碱类
2006年,Gallardo等从真菌Acremonium furcatum(阿根廷米拉马尔潮间带沉积物)中分离到四个生物碱化合物183~186,这四个化合物都表现出抗细菌和植物病原真菌的活性,其中化合物183对曲霉菌和镰刀霉菌的抑菌圈均为 15 mm(50 μg/spot)[54,55]。
1.9 其他属
1.9.1 生物碱类
生物碱类化合物Plectosphaeroic acids A-C(187~189)分离自真菌Plectosphaerella cucumerina(加拿大西岸巴克利湾),这三个化合物都对人吲哚胺2、3-双加氧酶有抑制作用,IC50值都在 2 μM 左右[56]。黄等从真菌Gliocladium sp.(乳山海泥)中分离到一对几何异构体化合物190~191,是罕见的二酮哌嗪侧链上连接牻牛儿取代基的化合物,这两个化合物对肿瘤细胞都表现出良好的细胞毒活性,但后者的活性强于前者,说明几何异构体对其细胞毒活性具有一定的影响[57]。
1.9.2 聚酮类
2009年,Chen等从Xylaria属真菌(南海红树林沉积物)分离到两个聚醚类化合物Xyloketal A和Xyloketal B(192~193),Xyloketal A能抑制乙酰胆碱酯酶,Xyloketal B能抑制NADPH氧化酶,增加NO的释放,从而保护人脐静脉内皮细胞免于被氧化的低密度脂蛋白诱导损伤[58]。Fusaquinon A(194)属蒽醌类,从珠海红树林沉积物真菌Fusarium sp.中分离到[59]。化合物 Aquastatin A(195)分离自真菌Cosmospora sp.(韩国Gejae岛),能抑制蛋白酪氨酸磷酸酶,EC50值达 0.19 μM[60]。化合物Spiromassaritone和 Massariphenone(196、197)分离自Palau 岛屿海泥真菌 Massarine sp.[61]。
1.9.3 其他类
Zhang等也是从南海潮间带海泥真菌Nigrospora sphaerica 分离到化合物 198 ~199[62]。化合物200分离自真菌Keissleriella sp.(黄海射阳港沉积物),对红色毛霉菌、白色念球菌和黑曲霉菌的MIC值分别为 20、40、80 μg/mL-1[63]。

2 结论与展望
海洋真菌具有易培养、代谢产物量大等优点,但国内外对海洋真菌的系统研究起步较晚,其代谢产物化学以及生物活性的研究远滞后于海洋细菌和放线菌。直到90年代后,对于海洋真菌代谢产物的研究才逐渐进入快速发展阶段[2,64,65]。海洋沉积环境资源丰富,孕育着特殊的微生物多样性,为真菌研究提供了良好的资源基础。
本综述收集了65篇关于海洋沉积环境来源真菌次生代谢产物的文献,从化合物发表的时间来看海洋沉积环境来源真菌的次生代谢产物发表数量逐年增加,增长趋势明显。从真菌属来源分析,共有16个属(图1),但主要分布在前四大属:Penicillium(青霉属)、Aspergillus(曲霉属)、Spicaria(穗霉属)、Trichoderma(木霉属),占有比例分别为30%、19%、18%和13%。从结构分类中发现(图2),生物碱类代谢产物的比例最高,占有43%,其次是萜类(21%)、聚酮类(21%)、肽类(7%)等,活性研究主要集中在细胞毒活性和抗菌方面。
目前,可人工培养的海洋沉积环境来源真菌只占真菌总量的一小部分,沉积物样品采集后真菌脱离原生长环境存活率降低,而且只能在适合的培养基上生长,所以需要解决从采样到分离纯化过程中提高菌株可培养率的问题。此外,发酵条件的创新也可以提高新化合物的产出率,比如改变培养基盐度、延长培养时间或在培养基中加入特定成分,同样的菌株在不同的培养条件下,代谢系统会发生改变,将有利于提高代谢产物的出新率,扩充海洋天然产物库,为开发海洋先导药物奠定基础。
1 Wang XM(王祥敏),et al.A study of marine fungi and the diversity ofbioactive substances produced by them.Trans Oceanol Limnol(海洋湖沼通报),2007,3:70-74.
2 Xiong F(熊枫),et al.Antimicrobial and antitumor activities of marinefungi isolated from sediment in deep sea.J Xiamen Univ,Nat Sci(厦门大学学报,自科版),2006,45:419-423.
3 Rateb ME,Ebel R.Secondary metabolites of fungi from marine habitats.Nat Prod Rep,2011.
4 Qu JH(屈建航),et al.Methodology in studies of microbial resource in sediment.Acta Ecologica Sinaca(生态学报),2007,24:2636-2641.
5 Zhou RL,et al.Recentprogress in the research on bioactive substances from marine fungi.Nat Prod Res Dev(天然产物研究与开发),2008,20:741-747.
6 Dang HY(党宏月),et al.Progresses in the studies of subseafloor deep biosphere microorganisms.Adv Earth Sci(地球科学进展),2005,20:1306-1313.
7 Yin WQ(尹文清),et al.Studies on the secondary metabolites of marine fungus NO.K26 from the South China Sea.Guangxi Normal Coll,Nat Sci(广西师范大学学报,自科版),2004.22(3):54-57.
8 Li YZ(李越中),Chen Q(陈琦).The source of marine microorganisms and their bioactive metabolites.Progr Biotechnol(生物工程进展),2000,20(5):28-31.
9 Kelecom A.Secondary metabolites from marine microorganisms.Anais da Academia Brasileira de Ciências,2002,74:151-170.
10 Kakeya H,et al.Epolactaene,a novel neuritogenic compound in humanneuroblastoma cells,produced by a marine fungus.J Antibiot,1995,48:733-735.
11 Jiang GC(姜广策),et al.A survey of study on secondary metabolites from marine imperfect fungi.J Microbiol(微生物学杂志),2001,21(3):41-44.
12 Mizushina Y,et al.Epolactaene,a novel neuritogenic compound in human neuroblastoma cells,selectively inhibits the activities of mammalian DNA polymerases and human DNA topoisomerase II.Biochem Bioph Res Co,2000,273:784-788.
13 Du L,et al.New alkaloids and diterpenes from a deep ocean sediment derived fungus Penicillium sp.Tetrahedron,2009,65:1033-1039.
14 Lin AQ(林爱群).Studies of the active constituents of secondary metabolites produced by three marine fungal strains.Qingdao:Ocean University of China,PhD.2008.
15 Smetanina OF,et al.Indole alkaloids produced by a marine fungus isolate of Penicillium janthinellum Biourge.J Nat Prod,2007,70:906-909.
16 Long C(龙聪),et al.Anti-tumor natural products from marine fungi.Chem Life(生命的化学),2010,(001):86-91.
17 Pan J,et al.Review of bioactive compounds from fungi in the South China Sea.Bot Mar,2008,51:179-190.
18 Zhou L,et al.Three New Indole-Containing Diketopiperazine Alkaloids from a Deep-Ocean Sediment Derived Fungus Penicillium griseofulvum.Helv Chim Acta,2010,93:1758-1763.
19 Bugni T,Ireland CM.Marine-derived fungi:a chemically and biologically diverse group of microorganisms.Nat Prod Rep,2004,21:143-163.
20 Huang YF,et al.Eremophilane sesquiterenes from the marine fungus Penicillium sp.BL27-2.Chinese Chem Lett,2008,19:562-564.
21 Debbab A,et al.Bioactive Compounds from Marine Bacteria and Fungi.Microbial Biotechnology,2010,3:544-563.
22 Li Y,et al.Breviane spiroditerpenoids from an extreme-tolerant Penicillium sp.isolated from a deep sea sediment sample.J Nat Prod,2009,72:912-916.
23 Gautschi JT,et al.Expanding the strategies in natural product studies of marine-derived fungi:a chemical investigation of Penicillium obtained from deep water sediment.J Nat Prod,2004,67:362-367.
24 Liu W,et al.Penicillones A and B,two novel polyketides with tricyclo[5.3.1.03,8]undecane skeleton,from a marine-derived fungus Penicillium terrestre.Tetrahedron Lett,2005,46:4993-4996.
25 Zhao LL(赵玲玲).Study on the new antitumor metabolities from marine fungi.Shanghai:Fudan University,PhD.2008.
26 Chen L(陈立).Studies on metabolities and antitumor activity of 4 fungal strains and 2 species animals from marine.Qingdao:Ocean University of China,PhD.2008.
27 Liu R,et al.10-Phenyl-[12]-cytochalasins Z7,Z8,and Z9 from the marine-derived fungus Spicaria elegans.J Nat Prod,2006.69:871-875.
28 Liu R,et al.Novel open-chain cytochalsins from the marinederived fungus Spicaria elegans.J Nat Prod,2008,71:1127-1132.
29 Lin ZJ,et al.Deoxy-cytochalasins from a marine-derived fungus Spicaria elegans.Can J Chem,2009,87:486-489.
30 Lin Z,et al.Spicochalasin A and New Aspochalasins from the Marine-Derived Fungus Spicaria elegans.Euro J Org Chem,2009,2009:3045-3051.
31 Lin ZJ,et al.Three new aspochalasin derivatives from the marine-derived fungus Spicaria elegans.Chinese Chem Lett,2010,21:824-826.
32 Wang Y,et al.Effects of High Salt Stress on Secondary Metabolite Production in the Marine-Derived Fungus Spicaria elegans.Marine Drugs,2011,9:535-542.
33 Wang FZ,et al.Three New Cytochalasins from the Marine-Derived Fungus Spicaria elegans KLA03 by Supplementing the Cultures with Land DTryptophan.Chem Biodivers,2011,8:887-894.
34 Fremlin LJ,et al.Cottoquinazoline A and Cotteslosins A and B,metabolites from an australian marine-derived strain of aspergillus versicolor.J Nat Prod,2009,72:666-670.
35 Zhang Y,et al.Carbonarones A and B,new bioactive α-pyrone and α-pyridone derivatives from the marine-derived fungus Aspergillus carbonarius.J Antibiot,2007,60:153-157.
36 Cui E,et al.Apoptosis inducing effect of diketopiperazine di-sulfides produced by Aspergillus sp.KMD 901 isolated from marine sediment on HCT116 colon cancer cell lines.J Appl Microbiol,2010,110:304-313.
37 Cui CB,et al.Novel mammalian cell cycle inhibitors,tryprostatins A,B and other diketopiperazines produced by Aspergillus fumigatus.1.Taxonomy,fermentation,isolation and biological properties.J Antibiot,1996,49:527-533.
38 Cui CB,et al.Novel mammalian cell cycle inhibitors,spirotryprostatins A and B,produced by Aspergillus fumigatus,which inhibit mammalian cell cycle at G2/M phase.Tetrahedron,1996,52:12651-12666.
39 Cui CB,et al.Novel mammalian cell cycle inhibitors,cyclotryprostatins A-D,produced by Aspergillus fumigatus,which inhibit mammalian cell cycle at G2/M phase.Tetrahedron,1997,53:59-72.
40 Lu Z,et al.Sesquiterpenoids and benzofuranoids from the marine-derived fungus Aspergillus ustus 094102.J Nat Prod,2009,72:1761-1767.
41 Du L,et al.Cytotoxic polyketides from a marine-derived fungus Aspergillus glaucus.J Nat Prod,2008.71:1837-1842.
42 Sun Y(孙奕),et al.Secondary metabolism product of fungus Trichodermareesei.J Shenyang Pharm Univ(沈阳药科大学学报),2007,24:546-548.
43 Sun S,et al.Two new compounds from fermentation liquid of the marine fungus Trichoderma atroviride G20-12.J Asian Nat Prod Res,2009,11:898-903.
44 Sun Y,et al.Trichodermatides A-D,novel polyketides from the marine-derived fungus Trichoderma reesei.Organic Lett,2008,10:393-396.
45 You J,et al.Trichoderone,a novel cytotoxic cyclopentenone and cholesta-7,22-diene-3β,5α,6β-triol,with new activities from the marine-derived fungus Trichoderma sp.J Ind Microbiol Biot,2010,37:245-252.
46 Du L,et al.Cytotoxic sorbicillinoids and bisorbicillinoids from a marine-derived fungus Trichoderma sp.Chem Pharm Bull,2009,57:220-223.
47 Sun Y(孙奕).Study on the secondary metabolities of marine-derived fungi and algae.Shenyang:Shenyang Pharmaceutical Univercity,PhD.2006.
48 Ren J,et al.Asperelines A-F,Peptaibols from the Marine-Derived Fungus Trichoderma asperellum.J Nat Prod,2009,72:1036-1044.
49 Sun S,et al.A novel natural product from the fermentation liquid of marine fungus Trichoderma atroviride G20-12.Asian J Trad Med,2009,4:123-127.
50 Wei H,et al.Cytotoxic sesterterpenes,6-epi-ophiobolin G and 6-epi-ophiobolin N,from marine derived fungus Emericella variecolor GF10.Tetrahedron,2004,60:6015-6019.
51 Wang W,et al.Cerebrosides of the Halotolerant Fungus Alternaria raphani Isolated from a Sea Salt Field.J Nat Prod,2009,72:1695-1698.
52 Kim MY,et al.Alternaramide,a Cyclic Depsipeptide from the Marine-Derived Fungus Alternaria sp.SF-5016.J Nat Prod,2009,72:2065-2068.
53 San-mart¨an A,et al.Steroids from the marine fungus geotrichum sp.J Chil Chem Soc,2008.53:1377-1378.
54 Gallardo GL,et al.Antimicrobial metabolites produced by an intertidal Acremonium furcatum.Phytochemistry,2006.67:2403-2410.
55 Zhou RL(周荣丽),et al.Recent progress in the research on bioactive substances from marine fungi.Nat Prod Res Dev(天然产物研究与开发),2008,20:741-747.
56 Carr G,et al.Plectosphaeroic acids A,B,and C,indoleamine 2,3-dioxygenase inhibitors produced in culture by a marine isolate of the fungus Plectosphaerella cucumerina.Organic lett,2009,11:2996-2999.
57 Huang YF(黄永富).Study on the secondary metabolities of 6 kinds of marine microorganisms.Shenyang:Shenyang Pharmaceutical Univercity,PhD.2006.
58 Chen WL,et al.A novel marine compound xyloketal B protects against oxidized LDL-induced cell injury in vitro.Biochempharmacol,2009,78:941-950.
59 Chen Y,et al.Structure elucidation and NMR assignments for three anthraquinone derivatives from the marine fungus Fusarium sp.(No.ZH-210).Magn Reson Chem,2009,47:362-365.
60 Seo C,et al.Isolation of the protein tyrosine phosphatase 1B inhibitory metabolite from the marine-derived fungus Cosmospora sp.SF-5060.Bioorg Med Chem Lett,2009,19:6095-6097.
61 Abdel-Wahab MA,et al.Secondary metabolite chemistry of the marine-derived fungus Massarina sp.,strain CNT-016.Phytochem,2007,68:1212-1218.
62 Zhang QH,et al.Two new compounds from the marine Nigrospora sphaerica.J Asian Nat Prod Res,2009.11:962-966.
63 Liu CH,et al.Antifungal metabolite with a new carbon skeleton from Keissleriella sp.YS4108,a marine filamentous fungus.Planta Med,2002,68:363-365.
64 Hyde KD,et al.Role of fungi in marine ecosystems.Biodivers Conserv,1998,7:1147-1161.
65 Liang JG(梁剑光),et al.Study progress on marine fungi and their active metabolites.Amino Acids Biotic Resour,2004,26(004):1-3.