真菌诱导海南龙血树生产血竭
2013-10-25许小凤李尚真宋启示
许小凤,李尚真,宋启示*
1中国科学院西双版纳热带植物园,昆明 650223;2中国科学院研究生院,北京 100049
血竭作为一种名贵中药,其药理作用已经得到系统研究,并被证实具有活血和止血的双重功效,另外,它还具有抗菌、抗毒、抗氧化、抗肿瘤等作用[1]。20世纪70年代以前,我国所用血竭均为国外进口,直至1972年植物学家蔡希陶在云南孟连县首次发现能够提制血竭的剑叶龙血树[Dracaena cochinchinensis(Lour.)S.C.Chen]后,国产血竭的生产和应用才真正开始[2]。2004年又有学者发现海南龙血树(D.cambodiana Pierre ex Gagnep)可以作为血竭的另一基源植物[3]。血竭形成主要原因是物理损伤和真菌诱导,然而由龙血树自然损伤形成血竭,其过程十分缓慢,需要十几年甚至几十年。目前自然形成的血竭产量远远不能满足急剧上升的市场需求,因此人工诱导血竭生产已成为当务之急。近年来,国内学者江东福、王兴红等[4,5]将从龙血树茎杆上分离得到的镰刀菌属菌株回接于龙血树枝条内,发现这些菌株对于血竭的形成具有良好的诱导作用,这表明镰刀菌属真菌和血竭的形成有一定的关系。本研究采用代号为brwg镰刀菌属真菌为诱导因子,以不同的处理方式将真菌回接于海南龙血树的活体茎干部位,以龙血素A和龙血素B作为检测标准,探讨不同处理方法对血竭产量的影响,从而为人工接菌诱导血竭生产提供理论指导。
1 仪器与材料
1.1 供试材料
海南龙血树是位于云南省勐仑镇中国科学院西双版纳热带植物园综合实验楼旁;所用真菌是2002年从剑叶龙血树茎杆带红色脂块损伤部位分离得到的一株真菌(代号brwg),经中国科学院微生物研究所鉴定为镰刀菌属真菌Fusarium graminearum,菌种保藏于中国科学院微生物研究所;血竭药品为雨林牌龙血竭胶囊,国药准字Z53021514,购于西双版纳雨林制药有限责任公司,生产批号051101;高氮培养基(酵母膏0.1 g,蔗糖2 g,蛋白胨5 g,琼脂15 g,蒸馏水1000 mL);高碳培养基(酵母膏0.1 g,蔗糖10 g,琼脂粉15 g,蒸馏水1000 mL);PDA培养基(土豆200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1000 mL)。
1.2 实验试剂
龙血素A对照品(实验室前期分离得到),龙血素B对照品(中国药品生物制品检定所),甲醇、乙腈均为色谱纯,冰乙酸为分析纯,水为娃哈哈纯净水。
1.3 实验仪器
98-1-B型加热提取器、SW-CJ-2FD型双人单面净化工作台、GNP-9080型隔水式恒温培养箱、HZQF160型全温振荡培养箱、BüCHI R-3旋转蒸发仪、Waters高效液相色谱仪、AL104型电子天平、HS10260D型超声波震荡仪、电钻、80-2型离心沉淀机等。
2 实验方法
2.1 真菌代谢产物检测实验
配制高碳、高氮、PDA平板培养基三组,高温灭菌后均接入brwg真菌,于28℃恒温培养箱中培养5 d。观察记录真菌生长状况。再将生长有真菌的平板培养基分别置于16、28、35℃的环境下培养7 d。取出培养完全的真菌,冷冻干燥24 h,并磨成粉末,用甲醇超声提取,并浓缩得到真菌代谢产物。用HPLC方法检测其成分。
2.2 菌株回接实验
选取自然条件下生长的海南龙血树直径约3 cm的生长健康的枝条,用电钻钻孔,孔径1.2 cm,孔深为枝条直径的2/3。做不同处理,处理①:只钻孔不接菌,不扎伤口,让伤口裸露于空气中;处理②:用滴管将菌悬液(菌株摇床培养所得)滴入孔中,不扎伤口,使其接菌部位自然裸露;处理③:用滴管将菌悬液滴入孔中,并用塑料带扎紧伤口,尽量不让伤口接触空气。以不做任何处理的枝条作为空白对照0。处理过的枝条自然生长4年后采集样品进一步实验。每种处理做5个重复。
2.3 样品预处理
经①、②、③处理过的枝条钻孔部位均呈现了不同程度的红色,将这些含红色物质的茎段锯下并晾干磨成粉末。用甲醇加热至沸腾回流提取,每批样品共提取两次,提取过程:加热12 h后,冷却,静置12 h,取上层甲醇相。将得到的甲醇溶液浓缩蒸干,得到红色粉末,即为待测样品。取空白对照枝条作同样预处理。
2.4 HPLC检测方法
2.4.1 标准品配制
准确称取龙血素A 2 mg和龙血素B 1 mg,加入色谱甲醇,超声溶解30 min后定容至10 mL,将配置成的溶液稀释10倍,即得到0.02 mg/mL的龙血素A溶液和0.01 mg/mL的龙血素B溶液。
2.4.2 待测样品溶液配制
分别精确称取各批次样品100 mg,加入色谱甲醇溶解,超声30 min,定容至10 mL,离心 10 min,经0.45 μm的滤膜过滤,即得待测样品溶液。
2.4.3 血竭药品溶液配制
称取血竭药品100 mg,加色谱甲醇溶解,超声30 min 定容至10 mL,离心10 min,用0.45 μm 的滤膜过滤即得血竭药品溶液,作为指纹图谱的参照品溶液。
2.4.4 色谱条件
使用Waters 1525高效液相色谱系统,装备Waters Symmetry C18柱(4.6 mm × 150 mm,5 μm)和Waters 2487紫外检测器;设定柱温为40℃,流动相:冰醋酸溶液(水∶醋酸 =100∶1)∶乙腈 =63∶37,流速为1 mL/min;检测波长为274 nm。在上述色谱条件下,理论塔板数按龙血素A、B峰计算均不低于10000,龙血素A峰和B峰的分离度大于1.27,龙血素A的保留时间约为28 min,龙血素B的保留时间约为30 min。
2.4.5 标准曲线制作
分别精密量取标准品溶液 1、2、4、5、10、15、20 μL,按上述色谱条件测定色谱峰面积。以标准品进样量(μg)为横坐标,峰面积为纵坐标,绘制标准曲线。结果显示龙血素A在20~400 ng、龙血素B在10~200 ng呈现良好的线性关系。龙血素A、B的回归方程分别为:Y=3×106X+3294.5,R2=0.999;Y=5 ×106X-4201.7,R2=0.9993。
2.4.6 试验样品检测
分别取待测样品和对照品20 μL进样。按照上述色谱条件测定色谱峰面积,根据标准曲线计算得出龙血素A、龙血素B的含量。
1.2.5 数据处理
龙血素A与龙血素B在血脂块中的含量通过如下公式计算:龙血素A(或者B)在血脂块中的含量(mg/g)=[HPLC检测样品浓度(mg/mL)*龙血竭脂块提取物重量(g)]/[龙血竭脂块重量(g)*100 mL],其中,每个处理中5个平行试验结果的平均值代表该处理后的龙血素A和B的含量。采用SPSS13.0软件对实验数据进行统计分析,采用单因子方差分析(One-Way ANOVA)检验不同处理中龙血素A和龙血素B含量之间的差异显著性。
3 实验结果
3.1 真菌单独培养
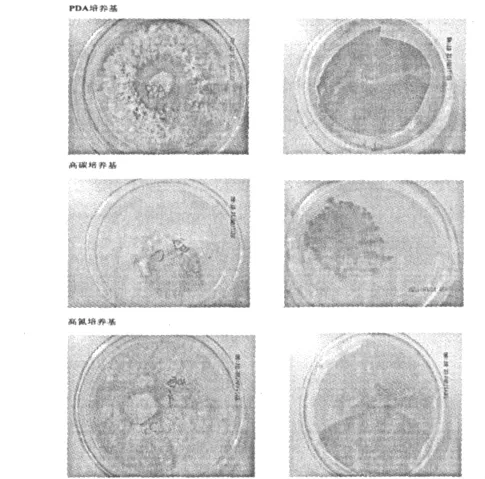
图1 三种不同培养基上真菌的生长状况Fig.1 Fungi grown on three different mediums

三种培养基上真菌生长的状况明显不同,结果如图1。PDA培养基上真菌长势较好,正面菌丝密集呈白色,背面呈红褐色;高碳培养基上,真菌几乎不生长;高氮培养基上,真菌能够生长,但是长势一般,正面菌丝稀疏,背面呈粉色。不同温度环境下培养的真菌,其代谢产物经HPLC检测结果如图2。图3是标准品的HPLC图谱,在30 min左右出现两个峰a和b,分别表示龙血素A和龙血素B。图2中30 min位置没有色谱峰出现,表明真菌的代谢产物中不含有龙血素A和龙血素B。
3.2 三组不同的处理样品及空白对照中龙血素A和龙血素B含量分析
龙血素A的含量在不同的处理中差异不显著(表1);龙血素B在四组处理中含量差异显著,在处理②中龙血素B的含量最高,而在处理①和处理③中龙血素B的含量差异不显著。
3.3 三组不同处理样品与龙血竭胶囊的指纹图谱比较
指纹图谱比较结果显示不同处理的样品的HPLC谱图与龙血竭胶囊药品的HPLC谱图峰形大致相同,前25 min出峰较多,后25 min则比较少。
4 讨论
将真菌brwg培养于不同的培养基上,生长状况明显差异,说明营养结构不同对真菌的生长有刺激作用。再将培养有真菌的培养基置于不同的温度环境下,以温度作为其另一刺激因素,并检测真菌的代谢产物。3.1实验结果,检测不同条件下培养的真菌代谢产物,其成分中均不含有龙血素A和龙血素B。而 Maria S.O.[6]和 F.Lecompte[7]等人指出微生物在温度和不同的营养环境下,微生物会发生应激反应,其代谢产物会发生变化。这说明龙血素A和龙血素B不是真菌自身应激反应产生的代谢产物。
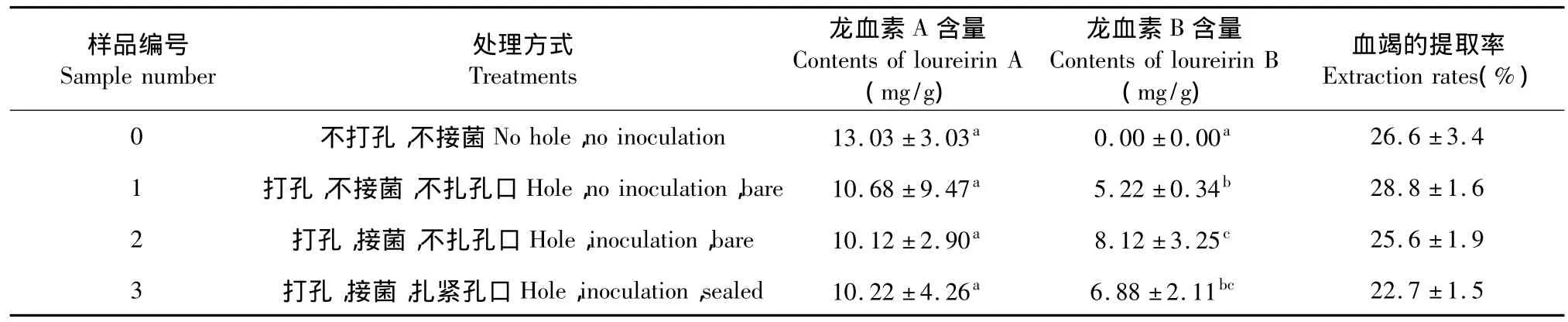
表1 不同处理血脂块中的龙血素A、B含量的检测结果(平均值 ±标准差,n=5)Table 1 The contents of loureirin A and loureirin B detected in dragon's bloods induced by different treatments(mean ± SD,n=5)
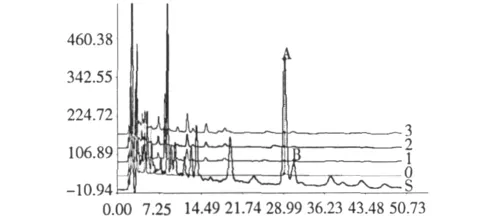
图4 不同处理样品与龙血竭胶囊的HPLC指纹图谱比较Fig.4 Overlaid HPLC fingerprints of different samples
3.2实验结果显示海南龙血树树体本身含有龙血素A而不含有龙血素B,但是做过处理的龙血树损伤部位受到空气中微生物或真菌的侵染后均产生龙血素B,表明龙血素B的产生是微生物和龙血树相互作用的结果。
表1显示经过不同的处理得到的血竭中龙血素A的含量差异不显著,龙血素B的含量差异显著,这一结果说明微生物的侵染对龙血素B的影响较大,而对龙血素A的影响很小,这也表明龙血素A与龙血素B的形成之间没有明显的关系,但目前龙血素B的形成机制仍不明确,所以本实验结论需要进一步研究证实。
龙血素B含量在不同处理样品中差异显著。处理①作了打孔处理,受伤部位裸露在空气中,受到空气中微生物侵染;处理②在打孔部位接入真菌并将伤口裸露在空气中,因此受伤部位既受到空气中微生物的侵染又受到接种真菌的侵染;处理③在打孔部位接入真菌并将伤口扎紧,隔绝空气,伤口部位仅仅受到接种真菌的侵染。表中结果显示处理①、②、③中均含有龙血素B,处理③与处理①中龙血B的含量差异不明显,而处理②中龙血素B的含量远高于处理①、③。王兴红[8]2007年研究表明细菌、真菌共代谢有利于龙血树产生红色的抑菌分泌物,黄酮类成分龙血素B是血竭抑菌作用成分之一[9,10]。因此处理②中龙血素B的含量最高原因可能是龙血树的茎干损伤部位受到空气中的其他真菌及细菌与人工接入的brwg真菌共同作用,侵染能力增强,从而提高了龙血素B的含量。此外,处理②中接入伤口的菌株可以充分接触空气,也可能自身生长较好增强了其侵染能力,从而增加龙血素B的产量。龙血素B作为龙血竭的主要成分具有较好的抗血栓、抗血瘀、抗凝血等活血化瘀药理作用[11],而处理②对龙血素B的产生诱导效果最佳,从而为人工诱导血竭生产提供了方向。
指纹图谱比较结果显示经过不同处理后的含脂块与龙血竭药品成分相似,真菌的接种没有引起组成血竭的各个组分的明显变化,保证了血竭品质的稳定。这进一步为人工接菌诱导血竭生产提供依据。人工接菌方法的优势在于:打孔伤口小且选择树体的侧枝打孔不会影响龙血树的存活;同一枝条可以同时多处打孔提高龙血竭产量;人工接入真菌增加了龙血树的侵染机率,缩短了龙血竭生产周期。因此人工接菌方法有望解决目前龙血竭生产面临的原料枯竭难题。
5 结论
本研究结果在支持了前人结果的基础上,揭示了不同的接种方法对血竭中主要药用成分龙血素A和B在血竭树脂中的含量的影响。通过本研究,对海南龙血树采用树枝打孔处理,孔口接入菌种,保持孔口裸露的处理方式,能够在保证血竭产品中龙血素A成分含量稳定的情况下,明显地增加龙血素B的含量,提高了血竭的品质,所以打孔接种的这种高效稳定方式,有利于大规模推广。
1 Gupta D,Bleakley B,Gupta RK.Dragon's blood:botany,chemistry and therapeutic uses.J Ethnopharmacol,2008,115:361-380.
2 Cai XT(蔡希陶),Xu ZF(许再富).Study on plant resources of dragon's blood resin in China.Acta Bot Yunnanica(云南植物研究),1979,1(2):1-10.
3 Yang XH(杨先会),Deng SM(邓世明),Fan LX(范丽霞).Exploitation to the resources of Dracaena cambodiana plants.Nat Sci J Hainan Univ(海南大学学报,自科版),2004,22:270-272.
4 Jiang DF(江东福),Ma P(马萍),Yang J(杨靖),et al.Formation of blood resin in abiotic Dracaena cochinchinensis inoculated with Fusarium 9568D.Chin J App Ecol(应用生态学报),2003,14:477-478.
5 Wang XH,Yang LL,Jose GL,et al.Enhanced dragon's blood production in Dracaena cochinchinensis by elicitation of Fusarium oxysporum strains.J Med Plants Res,2010,4:2633-2640.
6 Maria SO,Maria LR,Germán GB,et al.Influence of water activity and temerature on growth and mycotoxin production by Alternaria alternata on irradiated soya beans.Int J Food Microbiol,2011,147:127-132.
7 Lecompte F,Abro MA,Nicot PC.Contrasted responses of Botrytis cinerea isolates developing on tomato plants grown under different nitrogen nutrition regimes.Plant Pathol,2010,59:891-899.
8 Wang XH(王兴红).Flavones formed from xylem stem of Dracaena cochinchinensis by co-culture of fungus strain and bacteria strain.Nat Prod Res Dev(天然产物研究与开发),2007,19:11-15.
9 Nakashima K,Abe N,Kamiya F,et al,Novel flavonoids in dragon's blood of Daemonorops draco,Helv Chim Acta,2009,92:1999-2008.
10 Gonzalez AG,Leon F,Hernandez JC,et al.Flavans of dragon's blood from Dracaena draco and Dracaena tamaranae.Biochem Syst Ecol,2004,32:179-184.
11 Deng JG(邓家刚),Huang HB(黄海滨),Nong YQ(农毅清).Experimental study on pharmacological effects of lourerin B.Guangxi J Tradit Chin Med(广西中医药),2004,27:44-46.