巴西绿蜂胶主要生物活性成分的研究进展
2013-10-25张翠平胡福良
王 凯,张翠平,胡福良
浙江大学动物科学学院,杭州 310058
阿替匹林 C(artepillin C,3,5-二异戊烯基-4-羟基肉桂酸),巴西绿蜂胶中的主要活性酚酸类物质,化学式为:3-[4-羟基-3,5-二(3-甲基-2-丁烯基)苯基]-2-(E)-丙烯酸,分子量为300.40。其化学结构如图1所示。

图1 阿替匹林C的化学结构Fig.1 Chemical structure of artepillin C
阿替匹林C首先由Bohlmann和Jakupovic于1979年从菊花(Flourensia heterolepis)中分离出来[1],后来在菊科植物 Baccharis[2]和 Relhania[3]中也发现该成分,特别是在酒神菊属植物(Baccharis dracunculifolia)中的含量特别高[4-6]。
巴西绿蜂胶是目前产量最高、研究最多的巴西蜂胶,诸多研究证实巴西绿蜂胶具有降血脂、降血糖、抗炎及抑制血管生成等多种药理活性[7-10],现已广泛应用于保健食品、药品和化妆品等行业中。巴西绿蜂胶的主要植物来源是酒神菊属植物B.dracunculifolia DC[11],因此,巴西绿蜂胶中阿替匹林 C的含量较高。随着对巴西绿蜂胶研究的逐步深入,针对阿替匹林C在蜂胶质量控制、生物学活性、分离纯化以及人工合成等方面的研究也得到了较为广泛的开展。
1 在蜂胶质量控制中的应用
阿替匹林C不仅是巴西绿蜂胶的主要活性成分之一,而且是巴西绿蜂胶的代表性成分。Kumazawa等[12]对阿根廷、澳大利亚、巴西、保加利亚、智利、中国、匈牙利、新西兰、南非、泰国、乌克兰、乌拉圭、美国和乌兹别克斯坦等地的蜂胶进行检测,结果仅在巴西蜂胶中检测到阿替匹林C,而且含量较高,在乙醇提取物中的含量达43.9 mg/g。但是,阿替匹林C在巴西蜂胶中的含量受地理来源和植物来源影响较大。Matsuda和Muradiam测定了巴西不同地区收集的33个蜂胶样本中阿替匹林C的含量,结果发现样本间的含量差异较大,含量范围从0%至11%不等。从巴西东南部采集的样本中阿替匹林C的含量最为丰富(通常在5% ~11%),而从东北部采集的样本中却基本不含阿替匹林C[13],这是因为巴西绿蜂胶的主要胶源植物酒神菊在巴西东北部基本没有分布。此外,巴西绿蜂胶中阿替匹林C含量受季节影响明显,春夏季采集的绿蜂胶中阿替匹林C含量明显高于秋冬季采集的蜂胶[14]。
由于阿替匹林C是巴西绿蜂胶的代表性成分,阿替匹林C的有无是确定巴西绿蜂胶真实性的主要依据,而且其含量高低是评价巴西绿蜂胶质量优劣的主要指标。Gardana等[15]建立了同时测定57种类黄酮或酚酸的HPLC-MS/MS法方法,对欧洲、中国和阿根廷的蜂胶进行检测,发现类黄酮含量的高低是评价欧洲、中国和阿根廷蜂胶质量好坏的重要指标。但是,巴西绿蜂胶中类黄酮含量相对较低,而酚酸含量较高,特别是阿替匹林C是目前评价巴西绿蜂胶质量优劣的主要指标。韩利文等[16]建立了反相高效液相色谱法测定蜂胶中阿替匹林C含量的方法,为巴西绿蜂胶的质量评价提供了更加简单易行的方法。
2 分离纯化与人工合成
阿替匹林C是巴西绿蜂胶中最主要生物学活性成分之一,也是巴西绿蜂胶最重要的质量评价指标,因此,其纯品的获得不仅有利于其药理活性的深入研究,也为巴西绿蜂胶质量控制提供参考。目前,已从巴西绿蜂胶中分离纯化出阿替匹林C,市场上也有人工合成的阿替匹林C。
2.1 分离纯化
Chang等[17]采用超临界二氧化碳萃取法分离巴西绿蜂胶中的阿替匹林C,实验结果说明萃取温度、乙酸乙酯添加率是影响阿替匹林C回收率和纯度的重要因素。当采用温度50℃(323K)、6%乙酸乙酯添加量时,阿替匹林 C的回收率最佳,为13.9%。阿替匹林C在SC-CO2提取物中含量超过40%,对其采用正相树脂柱层析法纯化回收液可得含95%以上的阿替匹林C产品。Chang等[18]利用超临界二氧化碳反溶剂重结晶法从巴西绿蜂胶中分离制备阿替匹林C亚微米粒子,在SC-CO2反溶剂中,压力20 MPa、温度328 K条件下生成了含阿替匹林C 306 mg/g的超细粉体。
2.2 人工合成
阿替匹林C的全合成已由Uto等[19]于2002年完成,合成反应为在水中通过对碘苯酚的邻戊二烯化反应,再由丙烯酸甲酯参与的Mizoroki-Heck反应及所生成酯的进一步水解得到。反应过程如图2所示。
合成过程为首先在碱性条件通过对碘苯酚的异戊二烯化,得到C-取代和O-取代的异戊烯基类混合物(3~6),该混合物通过色谱柱的分离,得到低回收率(约25%)目标产物邻-邻-二异戊烯基类。然后,化合物3在三邻甲基苯基膦、三乙胺、甲苯中与丙烯酸甲酯经过钯催化的Mizoroki-Heck的交联偶合反应以31%的回收率得到阿替匹林甲酯,再在氢氧化钾溶液中通过甲醇醇解以78%的回收率得到阿替匹林C。
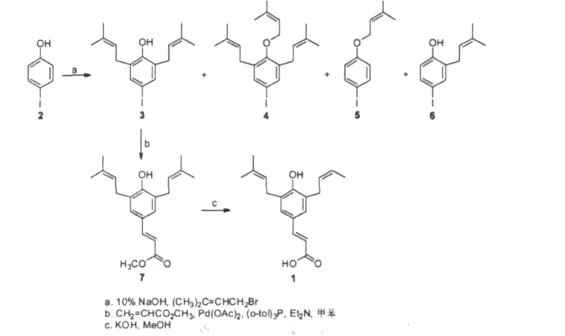
图2 artepillin C的化学合成Fig.2 Total synthesis of artepillin C
3 生物学活性
由于巴西绿蜂胶具有广泛的生物学活性,作为巴西绿蜂胶中最主要的生物活性成分,人们对阿替匹林C所具有的生物学活性也进行了较为广泛的研究。
3.1 抗微生物活性
阿替匹林C对多种致病细菌都表现出很强的抗菌抑菌作用,如蜡样芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、溶壁微球菌(Micro-coccus lysodeikticus)、绿脓杆菌(Pseudomonas aeruginosa)、产气肠杆菌(Enterobacter aerogenes)、耻垢分枝杆菌(Mycobacterium smegmatis)、粪链球菌(Streptococcus faecalis)、大肠杆菌(Escherichia coli),马棒状杆菌(Corynebacterium equi)、金黄色葡萄球菌(Staphylococcus aureus)、甲氧西林耐药金黄色葡萄球菌(Methicillin resistant Staphylococcus aureus)等[20]。Aga等[21]研究认为阿替匹林 C 可能是巴西绿蜂胶中最主要的有效抗菌成分之一。
Feresin等[22]的研究证实阿替匹林C对多种真菌都具有抑制作用,如白色念珠菌(Candida albicans)、热带假丝酵母(Candida tropicalis)、新型隐球酵母(Cryptococcus neoformans)、啤酒酵母(Saccaromyces cerevisiae)、烟曲霉(Aspergillus fumigates)、黄曲霉(Aspergilus flavus)、黑曲霉(Aspergilus niger)、犬小芽孢菌(Microsporum canis)、絮状表皮癣菌(Epidermophyton floccosum)和红色毛癣菌(Trichophyton rubrum)等。
虽然这些研究证实阿替匹林C具有抗微生物的活性,但其作用机制目前尚不十分清楚。
3.2 抗氧化活性
由于阿替匹林C分子结构单元芳香环有多个邻、间位活性酚羟基,易于释放H·给各类自由基,如氢氧游离基(HO·)、氢过氧游离基(ROO·)、超氧阴离子(O-2)等,终止自由基链式反应,从而具有较强的抗氧化活性[23]。Kumazawa等[12]研究发现,阿替匹林C对1,1-二苯基-2-三硝基苯肼(DPPH)自由基具有超过60%的清除活性。Nakanishi等[24]研究发现,阿替匹林C同异丙苯过氧自由基的反应历程是通过一步氢原子的转移实现的,该反应的速率常数堪比右旋儿茶素(+)-catechin,儿茶素是一种已知抗氧化能力最强的抗氧化剂,这表明阿替匹林C具有很强的抗氧化活性。阿替匹林C在小鼠肝脏线粒体细胞中也体现出抑制脂质过氧化的作用,且对线粒体细胞毒性很低[25]。
3.3 抗肿瘤活性
阿替匹林C最早是作为肿瘤抑制成分而受到广泛关注的[26,27],主要通过以下几种方式发挥抗肿瘤活性:
3.3.1 激活抗氧化反应应答原件
研究表明,小鼠肝脏细胞中谷胱甘肽S-转移酶(GST)和NADPH醌还原酶的活性随着阿替匹林C水平上升而增加,激活抗氧化反应应答原件(antioxidant-responsiveelement,ARE),并 同 DNA 结合[28,29]。Kanazawa 等[30]给小鼠注射氧化偶氮甲烷,诱导小鼠鼠产生与人类类似的结肠癌,发现阿替匹林C可以显著减少结肠的畸形隐窝灶(ACF)。这些结果说明了阿替匹林C可以通过激活抗氧化剂应答原件和诱发肝脏产生II相酶(phase II enzymes),从而抑制致癌物质危及细胞中的DNA,阻止结肠的异常隐窝灶的出现,使癌变在早期得到有效抑制。
3.3.2 诱导癌细胞周期阻滞
Shimizu等[31]研究发现,阿替匹林C可以通过刺激Cip1/p21(细胞周期抑制蛋白Cell cycle inhibitory protein)的表达来诱导细胞周期阻滞,从而抑制结肠癌的发生。阿替匹林C也对由氮基三醋酸铁诱导小鼠产生的肺癌[32]、肾癌[33]有抑制作用。这说明阿替匹林C可以有效预防结肠癌的发生,作为化学预防剂起到防癌治癌的作用。
3.3.3 诱导癌细胞发生细胞凋亡
阿替匹林C可通过诱导人体癌细胞发生细胞凋亡从而发挥抗癌作用。Matsuno等[26]发现在人类和小鼠恶性肿瘤细胞中施用阿替匹林C后,肿瘤细胞在生长中的细胞毒性效应明显减轻,组织学分析还发现细胞凋亡、顿挫性核分裂及肿瘤大块性坏死。同时,CD4/CD8 T细胞的比例、辅助T细胞的数量也有所上升。这说明阿替匹林C激活了免疫系统,直接发挥抗癌作用。
阿替匹林C作用于体外培养的人体白血病细胞株不同表型,如淋巴细胞性白血病细胞株(T细胞细胞系、B细胞细胞系)、髓细胞性白血病细胞株、单核细胞性白血病细胞株、非淋巴细胞性白血病细胞株及非髓细胞性白血病细胞株等,结果表明阿替匹林C可以有效地杀死癌细胞,并诱导白血病细胞株发生细胞凋亡[34]。Akao 等[35]通过形态学分析、核小体组蛋白DNA碎片分析等证实阿替匹林C通过直接诱导白血病细胞发生细胞凋亡而产生抗白血病效果。
3.3.4 抑制肿瘤血管生成
阿替匹林C不仅可以直接抑制肿瘤细胞生长,还可以通过抑制血管生成发挥抗癌作用。Ahn等[36]研究发现,阿替匹林C对抑制人类脐带内皮细胞(HUVECs)血管生成有显著的量效关系(3.13~50 μg/mL)。此外,抑制HUVECs的增殖过程也体现了这种量效关系。同时,血管再生分析显示,阿替匹林C能显著减少体内新生血管的数量,这说明阿替匹林C具有很强的抗血管生长能力[37]。
3.3.5 选择性地阻止PAK1信号转导
Messerli等[38]首次发现阿替匹林C可以有选择性地阻止PAK1的信号转导,并不影响其他激酶如AKT等的转导,而PAK1信号转导在多发性神经纤维瘤(NF)细胞生长中起重要作用,实验结果发现阿替匹林C几乎可以完全抑制NF肿瘤的生长。由于多种癌细胞,如乳腺癌[39]、子宫癌[40]、膀胱癌[41]等的生长中都需要PAK1的信号转导,这也为阿替匹林C发挥更广泛的抗癌作用提供了重要依据。
3.3.6 抗化学诱变剂
Tavares等[42,43]研究了酒神菊属乙酸乙酯浸提物(Bd-EAE)和巴西绿蜂胶对由阿霉素诱导的突变性的抑抑制作用。将实验组大白鼠口服不同浓度Bd-EAE,再对其腹腔注射化疗剂阿霉素(DXR),发现微核多染性红细胞数量显著减少,抑制了细胞突变的发生。对Bd-EAE和巴西绿蜂胶进行HPLC分析发现,其中含有大量的阿替匹林C,说明阿替匹林C可能是其抗突变的主要原因。Azevedo Bentes Monteiro Neto等[44]采用微核实验和彗星实验方法,研究给小鼠服用阿替匹林C后再施用DXR和甲基磺酸甲酯(MMS)对小鼠的影响。结果表明,阿替匹林C对化学诱变剂诱导发生染色体DNA发生突变具有很好的保护作用。
3.4 抗炎症活性
Paulino等[45]研究了阿替匹林C在小鼠上的抗炎症效果。他们采用体内试验(角叉菜胶致小鼠足跖肿胀模型、致小鼠腹膜炎模型)、体外试验(测定RAW264.7细胞产生的NO水平、HEK 293细胞NF-κB活性),并测定小鼠口服阿替匹林C的吸收率及生物利用率。结果表明阿替匹林C对小鼠足跖肿胀最多有38%的抑制效果,减少患腹膜炎小鼠中性粒细胞的水平。体外实验也证实了阿替匹林C可以降低NO水平和NF-κB活性。
3.5 其他生物学活性
巴西绿蜂胶醇提物可以缓解季节性过敏性鼻炎,减少病人相关药物使用,推迟症状发生时间。Tani等[46]研究发现阿替匹林C可以有效抑制半胱氨酸白细胞介素(cys-leukotrienes,cys-LT)的释放,从而抑制了过敏反应。
Iio等[47]研究发现蜂胶可以帮助恢复脂联素(一种胰岛素增敏激素,能改善小鼠的胰岛素抗性,同时增加脂肪酸的氧化,减少肌肉中三酰甘油的含量)的表达,增进胰岛素的敏感性。Ikeda等[48]研究了巴西绿蜂胶此作用的分子机制,发现阿替匹林C可以显著阻遏由TNF-α介导的对脂联素表达的抑制,却可以激活过氧化物酶体增殖活化受体(PPAR-γ,Peroxisome proliferator-activated receptor-gamma)。该受体可调节许多基因的转录,包括脂肪细胞的分化、体内脂质的稳态及体内胰岛素的活动。所以阿替匹林C是通过激活PRAR-γ从而抑制了TNF-α的表达,进而恢复了脂联素的活性。Choi等[49]的研究也证实阿替匹林C能够显著增强PPAR-γ的转录调控能力,促进脂肪细胞的分化,提高胰岛素的敏感性,有抗2型糖尿病的效果。
4 结语
阿替匹林C是巴西绿蜂胶的重要生物活性物质,是目前确认巴西绿蜂胶真实性及衡量巴西绿蜂胶质量优劣的重要指标。但是,蜂胶化学成分复杂,目前已从蜂胶中分离鉴定出的化学成分有黄酮类、萜烯类、醌类、酯类、醇类、醛类、酚类、有机酸类,还有大量的氨基酸类、酶类、维生素类、多糖及多种微量元素等。其中,黄酮类化合物多达136种[50],酚酸类化合物 131 种[51],萜类化合物 194 种[52],因此,蜂胶生物学活性的发挥不是单一成分决定的,仅以阿替匹林C为指标不足以评价巴西绿蜂胶的质量优劣,以阿替匹林C为主的多指标成分结合指纹图谱分析可能是评价巴西绿蜂胶质量优劣的有效途径。
阿替匹林C具有多种生物学活性,但目前大部分的研究仍以巴西绿蜂胶为对象。因此,阿替匹林C单体的生物学活性及作用机制有待今后深入研究。
1 Bohlmann F,Jakupovic J.New sesquiterpene acids,sesquiterpene diol,flavanones and other aromatic-compounds from Flourensia-Heterolepis.Naturally occurring terpene Derivatives.Phytochemistry,1979,18:1189-1194.
2 Bohlmann F,et al.Naturally-occurring terpene derivatives.307.5 Diterpenes and other constituents from 9 Baccharis species.Phytochemistry,1981,20:281-286.
3 Tsichritzis F,Jakupovic J.Diterpenes and other constituents from Relhania species.Phytochemistry,1990,29:3173-3187.
4 De Sousa JP,et al.A validated reverse-phase HPLC analyti-cal method for the quantification of phenolic compounds in Baccharis dracunculifolia.Phytocheml Anal,2009,20:24-32.
5 Park YK,et al.Chemical constituents in Baccharis dracunculifolia as the main botanical origin of southeastern Brazilian propolis.J Agric Food Chem,2004,52:1100-1103.
6 de Funari CS,et al.Analysis of propolis from Baccharis dracunculifolia DC.(compositae)and its effects on mouse fibroblasts.J Ethnopharmacol,2007,111:206-212.
7 Hu FL(胡福良).Studies on Pharmacological Actions of Propolis(蜂胶药理作用研究),Hangzhou:Zhejiang University Press,2005.
8 Zhu W(朱威).Effects of Chinese propolis and Brazilian propolis on diabetic rats and the possible protection mechanism on diabetic nephropathy.Hangzhou:Zhejiang University(浙江大学),PhD.2010.
9 Zhu W,et al.Biological activities of Chinese propolis and Brazilian propolis on streptozotocin-induced type 1 diabetes mellitus in rats.Evid-based Compl Alt,2011,Article ID 468529,doi:10.1093/ecam/neq025.
10 Xuan HZ,et al.Effect of Brazilian propolis on human umbilical vein endothelial cell apoptosis.Food Chem Toxicol,2011,49:78-85.
11 Sawaya Alexandra,et al.Analytical methods applied to diverse types of Brazilian propolis.Chem Cent J,2011,5:27-37.
12 Kumazawa S,et al.Antioxidant activity of propolis of various geographic origins.Food Chem,2004,84:329-339.
13 Matsuda AH,de Almeida-Muradian LB.Validated method for the quantification of artepillin-C in Brazilian propolis.Phytochem Anal,2008,19:179-183.
14 Simoes-Ambrosio LM,et al.The role of seasonality on the inhibitory effect of Brazilian green propolis on the oxidative metabolism of neutrophils.Fitoterapia,2010,81:1102-1108.
15 Gardana C,et al.Analysis of the polyphenolic fraction of propolis from different sources by liquid chromatography-tandem mass spectrometry.J Pharmaceut Biomed Anal,2007,45:390-399.
16 Han LW(韩利文),et al.Determination of Artepillin C in propolis by HPLC.Chin Pharm Affairs(中国药事),2008,22:312-314.
17 Chang CMJ,et al.Isolation and purification of 3,5-diprenyl-4-hydroxycinnamic acid(artepillin C)in Brazilian propolis by supercritical fluid extractions.Sep Purif Technol,2007,54:130-138.
18 Chang CMJ,et al.Precipitation of sub-micron particles of 3,5-diprenyl-4-hydroxycinnamic acid in Brazilian propolis from supercritical carbon dioxide anti-solvent solutions.J Supercrit Fluid,2009,50:176-182.
19 Uto Y,et al.First total synthesis of artepillin C established by o,o'-diprenylation of p-halophenols in water.J Org Chem,2002,67:2355-2357.
20 Da Silva JF,et al.Artepillin C:a review.Lett Drug Des Discov,2008,5(2):88-92.
21 Aga H,et al.Isolation and identification of antimicrobial compounds in Brazilian propolis.Biosci Biotechnol Biochem,1994,58:945-946.
22 Feresin GE,et al.Constituents of the Argentinian medicinal plant Baccharis grisebachii and their antimicrobial activity.J Ethnopharmacol,2003,89:73-80.
23 Devasagayam TP,et al.Free radicals and antioxidants in human health:current status and future prospects.J Asso Physi India,2004,52:794-804.
24 Nakanishi I,et al.Efficient radical scavenging ability of artepillin C,a major component of Brazilian propolis,and the mechanism.Org Biomol Chem,2003,1:1452-1454.
25 Hori H,et al.Artepillin C isoprenomics:Design and synthesis of artepillin C isoprene analogues as lipid peroxidation inhibitor having low mitochondrial toxicity.Bioorg Med Chem,2006,14:5721-5728.
26 Matsuno T,et al.Preferential cytotoxicity to tumor cells of 3,5-diprenyl-4-hydroxycinnamic acid(artepillin C)isolated from propolis.Anticancer Res,1997,17:3565-3568.
27 Kimoto T,et al.Cell cycle and apoptosis in cancer induced by the artepillin C extracted from Brazilian propolis.Japanese J Cancer Chemotherapy,1996,23:1855-1859.
28 Finley JW.The antioxidant responsive element(ARE)may explain the protective effects of cruciferous vegetables on cancer.Nutr Rev,2003,61:250-254.
29 Menshchikova EB,et al.Active defense under oxidative stress.The antioxidant responsive element.Biochemistry-Moscow,2006,71:962-974.
30 Kanazawa K,et al.Dietary artepillin C suppresses the formation of aberrant crypt foci induced by azoxymethane in mouse colon.Cancer Lett,2006,240:135-142.
31 Shimizu K,et al.Artepillin C in Brazilian propolis induces G(0)/G(1)arrest via stimulation of Cip1/p21 expression in human colon cancer cells.Mol Carcinogen,2005,44:293-299.
32 Kimoto T,et al.Pulmonary carcinogenesis induced by ferric nitrilotriacetate in mice and protection from it by Brazilian propolis and artepillin C.Virchows Arch,2001,438:259-270.
33 Kimoto T,et al.Renal carcinogenesis induced by ferric nitrilotriacetate in mice,and protection from it by Brazilian propolis and artepillin C.Pathol Int,2000,50:679-689.
34 Kimoto T,et al.Apoptosis of human leukemia cells induced by artepillin C,an active ingredient of Brazilian propolis.Anticancer Res,2001,21:221-228.
35 Akao Y,et al.Cell growth inhibitory effect of cinnamic acid derivatives from propolis on human tumor cell lines.Biol Pharm Bull,2003,26:1057-1059.
36 Ahn MR,et al.Suppression of tumor-induced angiogenesis by Brazilian propolis:major component artepillin C inhibits in vitro tube formation and endothelial cell proliferation.Cancer Lett,2007,252:235-243.
37 Ohta T,et al.Correlation between antiangiogenic activity and antioxidant activity of various components from propolis.Mol Nutr Food Res,2009,53:643-651.
38 Messerli SM,et al.Artepillin C(ARC)in Brazilian green propolis selectively blocks oncogenic PAK1 signaling and suppresses the growth of NF tumors in mice.Phytother Res,2009,23:423-427.
39 Kumar R,et al.p21-activated kinase-1 signaling mediates cyclin D1 expression in mammary epithelial and cancer cells.J Biol Chem,2004,279:1422-1428.
40 Schraml P,et al.Combined array comparative genomic hybridization and tissue microarray analysis suggest PAK1 at 11q13.5-q14 as a critical oncogene target in ovarian carcinoma.Am J Pathol,2003,163:985-992.
41 Ogawa O,et al.P21-activated kinase 1:A new molecular marker for intravesical recurrence after transurethral resection of bladder cancer.J Urology,2007,178:1073-1079.
42 Tavares DC,et al.Inhibition of doxorubicin-induced mutagenicity by Baccharis dracunculifolia.Mutat Res-Gen Tox En,2007,634:112-118.
43 Tavares DC,et al.Effects of propolis crude hydroalcoholic extract on chromosomal aberrations induced by doxorubicin in rats.Planta Med,2007,73:1531-1536.
44 Azevedo Bentes Monteiro Neto M,et al.Antigenotoxicity of artepillin C in vivo evaluated by the micronucleus and comet assays.J Appl Toxicol,2011,published online.
45 Paulino N,et al.Anti-inflammatory effects of a bioavailable compound,artepillin C,in Brazilian propolis.Eur J Pharmacol,2008,587:296-301.
46 Tani H,et al.Inhibitory activity of Brazilian green propolis components and their derivatives on the release of cys-leukotrienes.Bioorg Med Chem,2010,18:151-157.
47 Iio A,et al.Ethanolic extracts of Brazilian red propolis promote adipocyte differentiation through PPAR gamma activation.Phytomedicine,2010,17:974-979.
48 Tsuda T,et al.Brazilian propolis-derived components inhibit TNF-alpha-mediated downregulation of adiponectin expression via different mechanisms in 3T3-L1 adipocytes.BBAGen Subjects,2011,1810:695-703.
49 Choi SS,et al.Artepillin C,as a PPARgamma ligand,enhances adipocyte differentiation and glucose uptake in 3T3-L1 cells.Biochem Pharmacol,2011,81:925-933.
50 Zhang CP(张翠平),Hu FL(胡福良).Flavonoids in propolis.Nat Prod Res Dev(天然产物研究与开发),2009,21:1084-1090.
51 Zhang CP(张翠平),Hu FL(胡福良).Phenolic Acid contribution in Propolis.Nat Prod Res Dev(天然产物研究与开发),Contribution.
52 Zhang CP(张翠平),Hu FL(胡福良).Terpenoids in propolis.Nat Prod Res Dev(天然产物研究与开发),in press.