新疆不同地区产蜂胶抗氧化活性研究
2013-10-25尼砸木艾海提买热艳木艾尔肯祖丽比亚司马义依米提热合曼
尼砸木·艾海提,买热艳木·艾尔肯,祖丽比亚·司马义,依米提·热合曼
新疆大学生命科学与技术学院,乌鲁木齐 830046
蜂胶具有抗氧化、抗菌、等多种药理活性,在民间医疗中具有悠久的历史。蜂胶基本成分是树脂(类黄酮和相关的酚酸)、蜡、挥发油、花粉[1],目前蜂胶中鉴定出的化合物中黄酮类化合物71种,芳香酸及其酯59种,咖啡酸酯类化合物近10种[2]。日本研究者Yoshimi Nakajima对巴西蜂胶水提物,醇提物及花粉的抗氧化活性进行比较研究中发现巴西蜂胶醇提物表现较强羟基和超氧阴离子自由基清除化活性[3]。
新疆具有丰富的蜂胶资源,蜂胶的生物学活性受生态系统和气候条件的影响,由于新疆区内各地生态环境差异较大,在新疆不同区域产蜂胶成分也必然存在一定的差异同时具有相似的一些生物学活性,在这科研领域内有关基于新疆产蜂胶进行研究的报道很少,因此我们使用新疆伊犁那拉提,尼勒克县产蜂胶抗氧化活性进行研究为蜂胶研究开发提供一些实验依据。
1 材料与方法
1.1 材料、试剂与仪器
蜂胶取自新疆伊犁那拉提、尼勒克县蜂场(采集时间为2011年秋季)。槲皮素、芦丁对照品(中国药品生物制品检定所,批号080-9705);二苯代苦味酰自由基(DPPH,Sigma产品);无水乙醇、5%亚硝酸钠、10%硝酸铝、5%氢氧化钠、焦性没食子酸(邻苯三酚)、Tris-盐酸、盐酸等试剂均为市售国产分析纯;水为纯化水。离心机(上海安亭医用仪器厂);UV-3600型紫外线分光光度计(UV-2100型,上海分析仪器厂);电子天平(JA1203型,上海天平仪器厂);GKC型水浴锅;RE-52AA旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 方法
1.2.1 总黄酮含量的测定
1.2.1.1 蜂胶醇提物的制备
将原料蜂胶加入冰箱冷冻5 h(蜂胶在15℃以下变硬变脆,在此温度以上具有粘性,不便粉碎),粉碎取2 g粉碎的蜂胶,按料液比10∶1用浓度为95%的乙醇,浸提34 h,提取温度34℃,离心分离取上清液旋转蒸发浓缩得浸膏,在烘箱中烘至恒重。
1.2.1.2 标准曲线制作
称取在120℃减压干燥至恒重的芦丁标准品20.00 mg,置100 mL容量瓶中加入乙醇溶液定容,即得0.2 mg/mL芦丁标准液。取芦丁标准液1.0、2.0、3.0、4.0、5.0、6.0 mL 分别置于 25 mL 容量瓶中,各加乙醇6 mL,5%亚硝酸钠溶液1 mL,摇均,放置10 min;加10%硝酸铝溶液1 mL,摇均,放置10 min;加5%氢氧化钠溶液10 mL,摇均,加乙醇定容,放置15 min;以铺料溶液作为空白,同芦丁标准曲线一样配置样品溶液,取1 mL置于25 mL容量瓶中加乙醇6 mL,空白对照直接加乙醇至25 mL容量瓶中,其余操作同芦丁标准曲线的绘制方法。芦丁对照品乙醇溶液及蜂胶提取液用NaNO2、A1(NO)3、NaOH显色后,于200~700 nm间扫描,在500 nm处有均最大吸收,因此选择500 nm为测定波长[4,6]。
总黄酮含量计算公式:
式中:S:总黄酮含量%;C:通过标准曲线差的总黄酮质量浓度(mg/mL);M:蜂胶用量(g)。
1.2.2 抗氧化活性测定
1.2.2.1 蜂胶醇提物超氧阴离子自由基清除率测定
取0.05 mol/L Tris-HCl缓冲液(pH=8.2)1.4 mL,置于25℃水浴中预热20 min,分别加入试样1 mL和2 mmol/L联苯三酚溶液0.1 mL,混匀后于25℃水浴中反应5 min,加入8 mol/L HCl 0.5mL终止反应,325 nm处测定光密度D(λ)i对照组以相同体积的蒸馏水代替样品。每个试样作5次平行实验,取其平均值。清除率计算公式为[7]
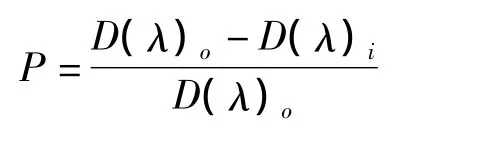
式中:D(λ)o为空白对照的光密度;D(λ)i为试样的光密度。
1.2.2.2 蜂胶醇提物DPPH清除率测定
取2 mL不同浓度的蜂胶醇提物液液于试管中,加入2 mL DPPH溶液(无水醇配制),混合均匀,反应30 min后在518 nm测定其吸光度Ai,以2 mL水代替样品Ac,以2 mL样品与2 mL无水乙醇混合液为Aj,以消除样品本身的影响,以2 mL水与2 mL无水乙醇的混合液调零点[8]。
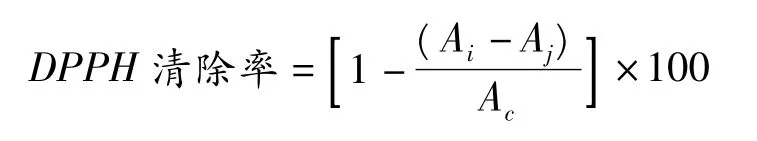
式中:Ai=2 mL DPPH溶液+2 mL待测溶液吸光度值;Aj=2 mL待测溶液+2 mL溶剂的吸光度值;Ac=2 mL DPPH溶液+2 mL溶剂的吸光度值。
1.2.2.3 蜂胶醇提物羟基自由基清除率
取0.2 mL的FeSO4-EDTA(10 mmol/L)混合液于具塞试管中,加入0.2 mL的2-脱氧-D-核糖溶液(10 mmol/L),然后再加入一定量的样品溶液,并用磷酸缓冲液(pH 7.4)定容到1.8 mL,最后加入0.2 mL的H2O2(10 mmol/L),混匀后于37℃保温1 h,再加入2.8%三氯乙酸1.00 mL,1.0%硫代巴比妥酸溶液1 mL,混匀后,沸水浴煮沸10 min,冷水冷却。不加DR的反应混合液不发生反应,作为比色时的空白液,测 A532,计算清除率 P[9]。
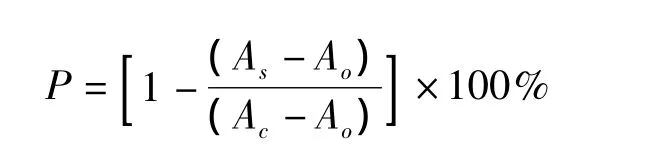
式中:As:加样品液并在37℃水浴中反应的吸光值;Ac:不加样品液,同上操作的吸光值;Ao:不加样品液并且不在37℃水浴中反应的吸光值。
1.3 数据统计
为了检验不同浓度梯度样品抗氧化活性与阳性对照间有无显著差异,使用SPSS 13.0软件进行数据处理,用单因素方差分析的方法,检验水准:α =0.05;测定样品的半清除率使用单因素线性回归分析。
2 实验结果
2.1 蜂胶黄酮含量
伊犁那拉提县和尼勒克县蜂胶经过95%乙醇提取后提取率分别为40%、34%。以质量浓度对吸光度作图,线性回归得芦丁质量浓度(x)和吸光度(y)的回归方程为 y=9.8223x-0.003(R2=0.9998)。伊犁那拉提县和尼勒克县蜂胶总黄酮含量分别为9.015±0.203%、7.710±0.259%,总黄酮含量无显著差异(P>0.05)。
2.2 蜂胶醇提物超氧自由基清除作用
槲皮素作为阳性对照,使用浓度为100、80、40、20、10 μg/mL的蜂胶醇提物测定对超氧阴离子自由基的清除能力,结果表1显示,随着那拉提、尼勒克蜂胶醇提物浓度升高对超氧阴离子自由基清除活性也增加,当浓度为100 μg/mL时那拉提、尼勒克蜂胶醇提物对超氧阴离子自由基清除活性与槲皮素进行比较,没有显著差异(P >0.05),浓度为80、40、20、10 μg/mL时那拉提、尼勒克蜂胶醇提物对超氧阴离子自由基的清除能力显著低于槲皮(P <0.01)。那拉提蜂胶醇提物回归曲线方程:Y=1.355X-21.27,R2=0.9584,IC50=46.48 μg/mL;尼勒克蜂胶醇提物回归曲线方程:Y=1.3152X-18.568,R2=0.9477,IC50=47.19 μg/mL;槲皮素回归曲线方程:Y=1.7769X-67.585,R2=0.9591,IC50=21.26 μg/mL(X:清除率;Y:样品浓度)。
表1 那拉提、尼勒克蜂胶醇提物超氧阴离子自由基的清除活性(n=5,±s)Table 1 Superoxide anion radical scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)

表1 那拉提、尼勒克蜂胶醇提物超氧阴离子自由基的清除活性(n=5,±s)Table 1 Superoxide anion radical scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)
注:与槲皮素比较,*P <0.05,**P <0.01。Note:Compared with quercetin,*P < 0.05,** P < 0.01.
样品浓度Sample concentration(μg/mL)那拉提蜂胶醇提物超氧阴离子自由基的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nalati(%)尼勒克蜂胶醇提物超氧阴离子的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nileke(%)槲皮素超氧阴离子清除活性Superoxide anion radical scavenging activity of quercetin(%)100 87.66±3.50 89.33±2.41 92.36±1.46 80 70.50±1.96** 68.73±2.31** 81.80±1.28 40 53.10±1.55** 51.16±1.47** 62.63±1.20 20 34.6±1.08** 36.53±1.90** 55.66±1.45 10 17.13±1.29** 14.93±2.23**38.43±0.97
2.3 蜂胶醇提物DPPH清除作用
表2显示随着那拉提、尼勒克蜂胶醇提物浓度升高对DPPH自由基清除作用也呈显增加趋势,当浓度为40 μg/mL时那拉提蜂胶醇提物对DPPH自由基清除作用与槲皮素进行比较,没有显著差异(P> 0.05);浓度为 20、10、8、5 μg/mL 时那拉提、尼勒克蜂胶醇提物对DPPH自由基清除作用清除能力显著低于槲皮素(P<0.01)。那拉提蜂胶醇提物回归曲线方程:Y=0.7422X-17.724,R2=0.8951,IC50=18.37 μg/mL;尼勒克蜂胶醇提物回归曲线方程:Y=0.8323X-21.494,R2=0.9054,IC50=20.12 μg/mL;槲皮素回归曲线方程:Y=1.0274X-41.41,R2=0.9141,IC50=9.95 μg/mL(X:清除率;Y:样品浓度)。
表2 那拉提和尼勒克蜂胶醇提物DPPH自由基的清除活性(n=5,±s)Table 2 DPPH radical-scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)

表2 那拉提和尼勒克蜂胶醇提物DPPH自由基的清除活性(n=5,±s)Table 2 DPPH radical-scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)
样品浓度Sample concentration(μg/mL)那拉提蜂胶醇提物超氧阴离子自由基的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nalati(%)尼勒克蜂胶醇提物超氧阴离子的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nileke(%)槲皮素超氧阴离子清除活性Superoxide anion radical scavenging activity of quercetin(%)74.67±1.10 40 71.67±1.15 68.9±1.85*

注:与槲皮素比较,P <0.05,P <0.01。Note:Compared with quercetin,*P < 0.05,** P < 0.01.
2.4 蜂胶醇提物羟基自由基清除作用
表3显示,槲皮素作为阳性对照使用浓度为100、80、40、20、10 μg/mL 的蜂胶醇提物测定其对羟基自由基的清除能力。随着那拉提、尼勒克蜂胶醇提物浓度升高对羟基自由基清除活性也呈显增加趋势。当浓度为100、80 μg/mL时那拉提、尼勒克蜂胶醇提物对羟基自由基清除作用与槲皮素进行比较,没有显著差异(P > 0.05);浓度为40、20、10 μg/mL时那拉提、尼勒克蜂胶醇提物对羟基自由基的清除能力显著低于槲皮素(P<0.01)。那拉提蜂胶醇提物回归曲线方程:Y=1.0819X-16.55,R2=0.8912,IC50=37.54 μg/mL;尼勒克蜂胶醇提物回归曲线方程:Y=1.1327X-20.746,R2=0.9163,IC50=36.24 μg/mL;槲皮素回归曲线方程:Y=1.2817X-36.167,R2=0.9221,IC50=28.18 μg/mL(X:清除率;Y:样品浓度)。
表3 那拉提和尼勒克蜂胶醇提物羟基自由基的清除活性(n=5,±s)Table 3 Hydroxyl radicals-scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)
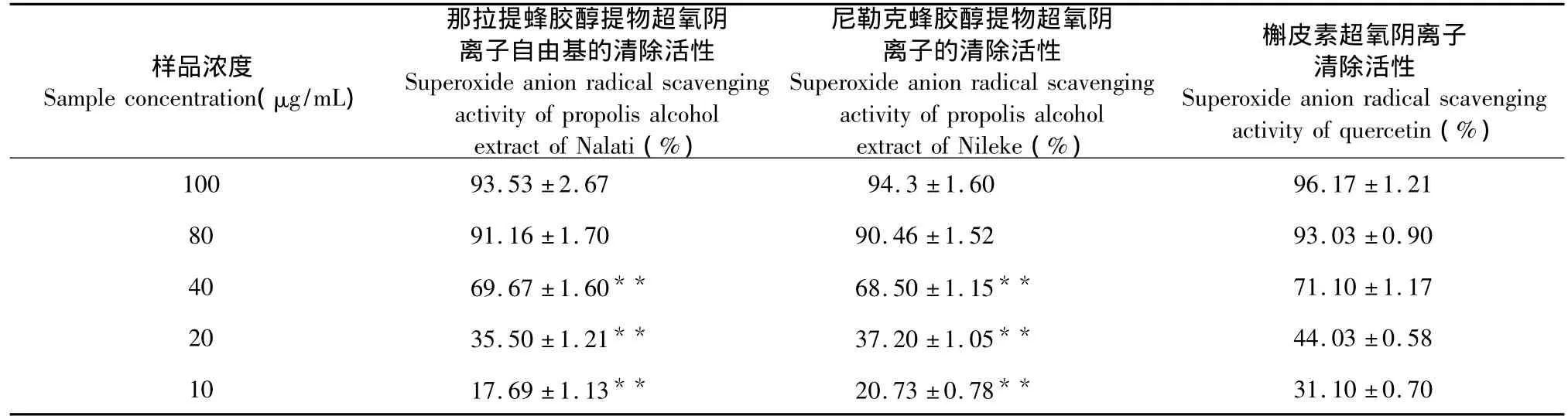
表3 那拉提和尼勒克蜂胶醇提物羟基自由基的清除活性(n=5,±s)Table 3 Hydroxyl radicals-scavenging activity of propolis alcohol extract of Nalati and Nileke(n=5,±s)
注:与槲皮素比较,*P <0.05,**P <0.01。Note:Compared with quercetin,*P < 0.05,** P < 0.01.
样品浓度Sample concentration(μg/mL)那拉提蜂胶醇提物超氧阴离子自由基的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nalati(%)尼勒克蜂胶醇提物超氧阴离子的清除活性Superoxide anion radical scavenging activity of propolis alcohol extract of Nileke(%)槲皮素超氧阴离子清除活性Superoxide anion radical scavenging activity of quercetin(%)100 93.53±2.67 94.3±1.60 96.17±1.21 80 91.16±1.70 90.46±1.52 93.03±0.90 40 69.67±1.60** 68.50±1.15** 71.10±1.17 20 35.50±1.21** 37.20±1.05** 44.03±0.58 10 17.69±1.13** 20.73±0.78**31.10±0.70
3 讨论
蜂胶的化学成分复杂,其中主要的功效成分为黄酮类化合物。新疆那拉提、尼勒克县产蜂胶总黄酮含量分别为9.015±0.203%、7.710±0.259%,总黄酮含量无显著差异(P >0.05),其醇提物对DPPH、羟自由基、超氧阴离子自由基均有一定的清除作用。本实验槲皮素作为阳性对照评价那拉提、尼勒克县产蜂胶醇提物的抗氧化活性;那拉提、尼勒克县产蜂胶醇提物浓度100 μg/mL时对超氧阴离子自由基清除活性与槲皮素比较没有显著差异(P>0.05);那拉提、尼勒克县产蜂胶醇提物IC50为46.48 μg/mL、47.19 μg/mL,槲皮素 IC50为 21.26 μg/mL;当那拉提、尼勒克县产蜂胶醇提物浓度为100、80 μg/mL羟基自由基的清除活性与槲皮素比较,没有显著差异(P >0.05);那拉提、尼勒克县产蜂胶醇提物 IC50为37.54、36.24 μg/mL,槲皮素 IC50为28.18 μg/mL;浓度为40 μg/mL 时那拉提蜂胶醇提物对DPPH自由基清除活性与槲皮素进行比较,没有显著差异(P >0.05),那拉提、尼勒克县产蜂胶醇提物 IC50为18.37、20.12 μg/mL,槲皮素 IC50为9.95 μg/mL。蜂胶的生物学、药理学及医疗功效主要与蜂胶中所含的黄酮成分有关。研究表明,黄酮类化合物不仅可以清除机体内外的自由基,同时对自由基和脂质过氧化引起的多种疾病有治疗作用,蜂胶作为一种天然抗氧化剂和活性氧清除剂,能防止机体各种疾病的引发良好天然产物。
1 Pietta PG,Gardana G,Pietta AM,et al.Analytical methods for quatity control of propolis.Fitoterapia,2002,73:7-20.
2 Cinzia L,Mercedes CF,Anna LP,et al.Chemical constituents of red Mexican propolis.J Agric Food Chem,2010,58:2209-2213.
3 Nakajima Y,Tsuruma K,Shimazawa M,et al.Comparison of bee products based on assays of antioxidant capacities.BMC Complement Altern Med,2009,9:4.
4 Wang L(王莲),Mi S(米沙),Pang WY(庞文悦),et al.Determination of total flavone in diospyros leaves via colorimetry.Food Res And Dev(食品研究与开发),2012,33:124-127.
5 Zhang DQ(章杜前),Su FP(苏峰平),Lou YC(楼一层),et al.Comparative analysis of total flavonoids content in polygonum Orientale.L from different habitatis.China Pharm(中国药师),2012,5:155-156.
6 Wang YH(王英豪),Wei GQ(魏国强),Zhang LP(张理平).Identification of Artemisia Scoparia formula granule by thin-layer chromatography and UV first derivative spectroscopy.J Fujian Univ of TCM(福建中医药大学学报),2012,22(12):45-46.
7 Siddhuraju P,Becker K.The antioxidant and free radical scavenging activity of processed cowpea seed extracts.Food Chem,2007,101:10-19.
8 Biglari F,Alkarkhi AF,Easa AM,et al.Antioxidant activity and phenolic content of various datepalm(Phoenix dactylifera)fruits from Iran.Food Chem,2008,107:1636-1641.
9 Smirnoff N,Cumbes QJ.Hydroxyl radical scavenging activity of compatible solutes.Phytochemistry,1989,28:1057-1060.