人α1-抗胰蛋白酶在胰岛β细胞移植中免疫抑制和保护作用的研究*
2013-10-25张晓丹廖玉婷邓春燕李富荣
张晓丹, 叶 剑, 廖玉婷, 齐 晖, 邓春燕, 李富荣
(暨南大学第二临床医学院深圳市人民医院干细胞与细胞治疗重点实验室,广东 深圳 518020)
人α1-抗胰蛋白酶在胰岛β细胞移植中免疫抑制和保护作用的研究*
张晓丹, 叶 剑, 廖玉婷, 齐 晖, 邓春燕, 李富荣△
(暨南大学第二临床医学院深圳市人民医院干细胞与细胞治疗重点实验室,广东 深圳 518020)
目的探讨人α1-抗胰蛋白酶(hAAT)蛋白在胰岛β细胞移植中的免疫抑制和保护作用。方法构建稳定表达hAAT蛋白的NIT-hAAT细胞系。将NIT-1细胞系和NIT-hAAT细胞系分别2次腹腔注射正常BALB/c小鼠,诱导细胞毒性T淋巴细胞(CTL)产生,将丝裂霉素处理后的2种细胞系与CTL混合培养,流式细胞术检测NIT-hAAT细胞凋亡情况;ELISA检测细胞因子表达;实时荧光定量PCR检测炎症因子mRNA表达。将2种细胞系分别植入糖尿病模型小鼠左肾包膜内,动态观察血糖和体重变化、血清中胰岛素和C肽水平以及移植部位的病理学变化。结果CTL实验中,NIT-hAAT细胞受体鼠淋巴细胞的细胞毒作用较NIT-1细胞受体鼠明显减轻。hAAT具有减轻细胞凋亡、抑制炎症因子IL-1β、IL-6 mRNA的表达以及调节Th1/Th2细胞因子平衡的作用。NIT-hAAT细胞移植到糖尿病模型小鼠后,血糖明显下降并维持至28 d,血清中胰岛素和C肽含量明显升高,移植部位炎症细胞浸润明显减轻。结论hAAT蛋白可减轻CTL对β细胞的杀伤作用,抑制炎症因子的表达,短期内可以抑制移植物免疫排斥反应,对胰岛β细胞移植治疗糖尿病具有明显的免疫抑制和保护作用。
α1-抗胰蛋白酶; β细胞; 移植; 免疫抑制; 糖尿病
受移植后炎症反应介导的移植物破坏与凋亡、免疫抑制剂使用导致胰岛β细胞功能损害以及自身免疫作用等多种因素的影响,胰岛移植5年后胰岛素脱离率只有10%[1-4]。因此,自身免疫和免疫排斥是目前胰岛移植需重点解决的问题。
α1-抗胰蛋白酶(α1-antitrypsin,AAT)是体内重要的丝氨酸蛋白酶抑制剂[5],近年来研究发现,AAT不但能够抑制血清中的各种酶,包括中性粒细胞弹性蛋白酶、组织蛋白酶G、蛋白酶3、凝血酶、胰蛋白酶和糜蛋白酶,还能通过抑制细胞因子、补体活化和免疫细胞渗透发挥抗炎症反应作用[6]。除了抵抗炎症作用外,AAT还能显著地降低细胞因子和链脲佐菌素(streptozocin, STZ)对胰岛β细胞的凋亡作用[7-8]。另外,AAT治疗能够显著延长移植的胰岛在受体小鼠体内存活时间[9],并诱导特异性免疫耐受[10]。本研究旨在将人源AAT基因导入小鼠胰岛β细胞(NIT-1细胞),构建稳定表达人AAT蛋白的NIT-1细胞系(NIT-hAAT),探讨人AAT(human AAT,hAAT)对移植的β细胞是否具有免疫抑制和保护作用。
材 料 和 方 法
1材料
稳定表达hAAT基因的pBS-RSV-hAAT质粒由美国华盛顿大学Andre Lieber教授惠赠。真核表达载体pDsRed-N111由北京大学深圳研究生院卢志刚教授惠赠。NIT-1细胞系由中山大学李芳萍教授惠赠。BALB/c小鼠,20周龄,雌雄各半,由广东省实验动物中心供给。
2试剂
胎牛血清(Gibco);DMEM培养基(Sigma);LipofectamineTM2000(Invitrogen);G418(Sigma);小鼠干扰素γ(interferon γ,IFN-γ)和白细胞介素4(interleukin-4,IL-4)ELISA检测试剂盒(Neobioscience);总RNA提取试剂盒(Gibco);RevertAidTMFirst Strand cDNA Synthesis Kit(MBI);C-肽水平ELISA检测试剂盒(Mercodia)。
3方法
3.1NIT-hAAT细胞系的构建和鉴定 将PCR扩增的hAAT基因亚克隆至真核表达载体pDsRed-N111的多克隆位点,构建pDsRed-hAAT质粒。用含10%FCS的DMEM培养基在24孔板中扩增NIT-1细胞系。用LipofectamineTM2000将pDsRed-hAAT转染至NIT-1细胞,72 h后向培养基中加入G418(350 mg/L)进行筛选,之后用低剂量G418(175 mg/L)对细胞株进行筛选,最终获得的稳定传代的细胞株即NIT-hAAT细胞系。取第10代和第40代NIT-hAAT细胞系,Western blotting检测hAAT蛋白的表达。
3.2CTL实验 取40只BALB/c小鼠,分别在第1 d腹腔注射5×106个NIT-1或NIT-hAAT细胞后,第10 d重复注射等量同种细胞。另20只BALB/c小鼠腹腔注射生理盐水,作为空白对照组。第20 d处死各组小鼠,取脾脏研磨,红细胞裂解液裂解红细胞,RPMI-1640培养液洗涤2次,经200目尼龙网过滤后,淋巴细胞分离液分离淋巴细胞,调整细胞浓度为1×109/L,备用。
3.3单向混合淋巴细胞增殖实验 CTL实验中各组淋巴细胞作为反应细胞。将NIT-1和NIT-hAAT细胞接种于12孔培养板中,待细胞密度生长至5×105左右时,每孔加入1~1.5 mL丝裂霉素(30 g/L),避光处理30 min,作为刺激细胞,进行混合淋巴细胞反应(mixed lymphocyte reaction,MLR)。反应细胞与刺激细胞之比分别为5∶1、10∶1、20∶1及50∶1,5%CO2、37 ℃培养72 h,加入CCK-8试剂(10 μL/well),测定450 nm波长的吸光度(A)。依下列公式计算刺激细胞的刺激指数(stimulation index,SI)=(实验孔A值-空白孔A值)/(阴性对照孔A值-空白孔A值)。每组设置3个复孔,并设置相应的阴性对照及空白对照孔。
3.4炎症细胞因子检测 取CTL实验中各组5×106个淋巴细胞与丝裂霉素处理的NIT-1或NIT-hAAT细胞,按10∶1混合培养7 d后,获取培养上清,-80 ℃保存待用。小鼠IFN-γ和IL-4 ELISA检测试剂盒检测细胞因子含量,450 nm波长测定吸光度,通过标准曲线计算各组细胞因子含量。每个样品设置3个复孔。
3.5流式细胞术检测细胞凋亡 CTL实验中各组5×106个淋巴细胞与丝裂霉素处理的NIT-1或NIT-hAAT细胞,按10∶1混合培养7 d后,弃去悬浮的淋巴细胞,用不含EDTA的胰酶消化并收集NIT-1或NIT-hAAT细胞。调整细胞浓度为1×109/L,取100 μL细胞悬液分别加入5 μL Annexin V-FITC和1 μL PI 混匀,避光孵育30 min,PBS洗涤2次,流式细胞术分析细胞凋亡情况。
3.6实时荧光定量PCR检测炎症因子C反应蛋白(C-reactive protein,CRP)、IL-1β和IL-6 mRNA表达 CTL实验中各组5×106个淋巴细胞与丝裂霉素处理的NIT-1或NIT-hAAT细胞,按10∶1混合培养7 d后,收集淋巴细胞,提取总RNA。逆转录反应按Revert-AidTMFirst Strand cDNA Synthesis Kit说明书操作。
荧光定量PCR反应体系50 μL,PCR扩增条件为: 93 ℃ 3 min,93 ℃ 45 s,55 ℃ 1 min,72 ℃ 45 s,共40个循环,最后72 ℃ 10 min 。每个样本同时设置3个平行管,β-actin作为内参照,LightCycler Software 4.05分析计算结果,得到cDNA拷贝数(copies/μL),结果分析采用目的基因分子拷贝数/β-actin分子拷贝数,计算K值。以取材时间为横坐标,各基因相应K值作折线图,分析其表达量。引物序列见表1。
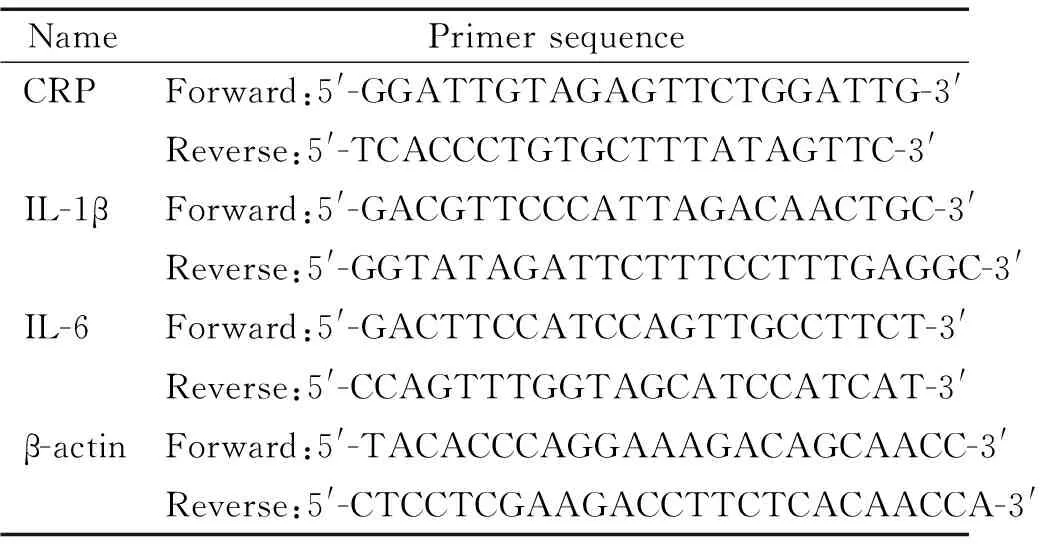
表1 引物序列
3.7小鼠糖尿病模型的制备 适应性喂养3~5 d后,将BALB/c小鼠禁食12 h,腹腔注射2% STZ溶液(170 mg/kg),以高糖/高脂喂养。72 h后尾静脉采血监测血糖,连续3 d血糖浓度大于0.3 g/L的小鼠为造模成功的糖尿病小鼠。
3.8细胞移植 将BALB/c糖尿病小鼠模型随机分为3组:(1)NIT-hAAT组(n=10):左肾包膜下注射1.5×107个NIT-hAAT细胞;(2)NIT-1组(n=10):左肾包膜下注射1.5×107个NIT-1细胞;(3)对照组(n=10):左肾包膜下注射PBS 0.1 mL。
3.9移植后功能学检测 移植后BALB/c小鼠,每天15:00断尾法取血,MediSenseOptium血糖仪检测,纸片法连续测定非空腹血糖至36 d。在30 d时摘取左肾。当血糖连续2 d超过0.3 g/L 则诊断为糖尿病。在移植后第7、14、21、28 d,各组小鼠眶周采血0.5 mL,离心分离血清-20 ℃保存,采用ELISA法检测血清中胰岛素和C肽水平。
3.10移植部位病理学观察 BALB/c小鼠在细胞移植后14和28 d,每组各处死3只BALB/c小鼠取移植左肾组织,10%中性甲醛溶液固定,石蜡包埋固定,切成5 μm组织切片,HE染色。400倍光学显微镜下,在移植部位随机选取10个视野,计数白细胞浸润个数。
4统计学处理
数据以均数±标准差(mean±SD)表示。随时间检测的数据比较采用重复测量设计的方差分析,组间数据分析采用完全随机设计的方差分析(One-way ANOVA)。两组均数比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1NIT-hAAT细胞系构建及hAAT表达的鉴定
将构建的pDsRed-hAAT转染至NIT-1细胞,经G418筛选后建立稳定的NIT-hAAT细胞系。对NIT-hAAT细胞系表达的hAAT蛋白进行Western blotting鉴定。与第10代结果一致,第40代对照组NIT-1细胞只表达42 kD的β-actin,而NIT-hAAT细胞同时表达β-actin与55 kD的hAAT。这表明构建的NIT-hAAT细胞系在体外传代至40代,仍能稳定表达hAAT蛋白,见图1。

Figure 1. hAAT expression confirmed by Western blotting.1:NIT-1 cells transfected with pDsRed-hAAT; 2:NIT-1 cells transfected with pDsRed.
图1NIT-hAAT表达hAAT蛋白的Westernblotting分析
2AAT的免疫保护和免疫抑制作用
2.1单向混合淋巴细胞增殖实验 各组淋巴细胞与丝裂霉素处理的NIT-hAAT或NIT-1细胞进行混合淋巴细胞培养,NIT-hAAT组淋巴细胞增殖与NIT-1组相比,受到明显的抑制(P<0.05),并随着NIT-hAAT相对于淋巴细胞比例的提高,抑制效果逐渐增强,具有量效关系,见图2。当10∶1时,抑制效果呈显著差异(P<0.01),且NIT-1组较对照组和NIT-hAAT组淋巴细胞增殖能力明显增强(P<0.01,P<0.05)。
2.2ELISA检测炎症细胞因子 ELISA检测各组淋巴细胞与丝裂霉素处理的NIT-hAAT或NIT-1细胞10∶1比例共培养上清中Th1细胞因子(IFN-γ)和Th2细胞因子(IL-4)水平。结果显示,与NIT-1组相比,NIT-hAAT组淋巴细胞的IFN-γ分泌水平明显降低(P<0.05),IL-4分泌水平明显升高(P<0.05)。而同一种细胞的移植受体鼠脾细胞中,IFN-γ和IL-4分泌水平无明显差异(P>0.05),见表2。
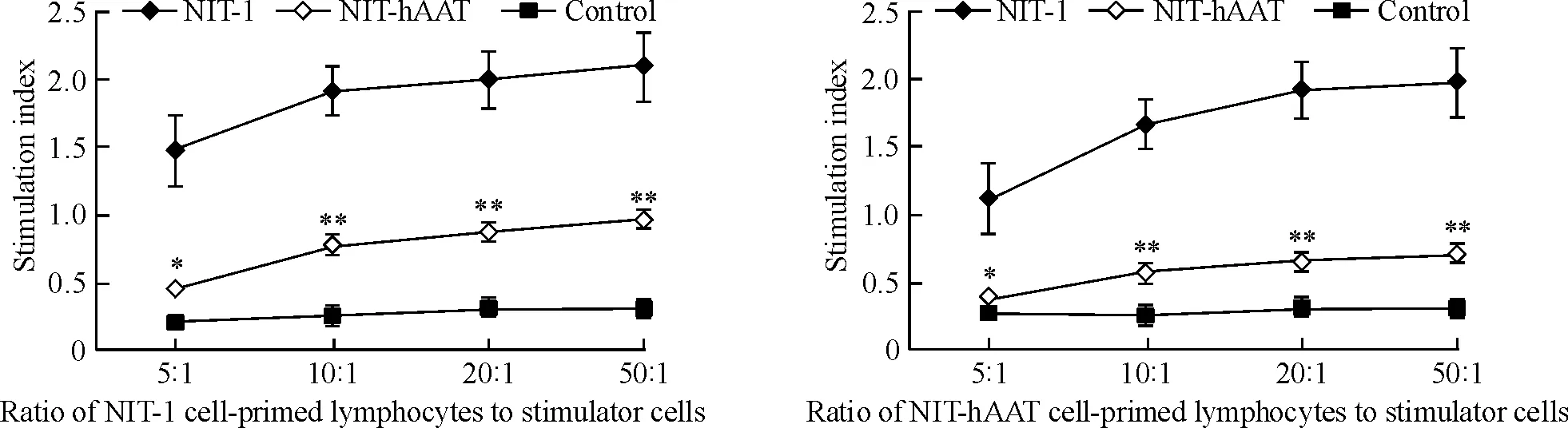
Figure 2. Mixed lymphocyte reactions stimulated by NIT-hAAT and NIT-1 cells.Mean±SD.n=3.*P<0.05,**P<0.01vsNIT-1.
图2NIT-hAAT和NIT-1单向混合淋巴细胞实验
表2单向混合淋巴细胞实验中分泌炎症细胞因子IFN-γ和IL-4的水平
Table 2. Comparison of the secretion of IFN-γ and IL-4 in lymphocytes immunized by NIT-1 or NIT-hAAT cells(ng/L.Mean±SD.n=3)

GroupIFN-γ(Th1)IL-4(Th2)NIT-1cell-primedlymphocytesNIT-hAATcell-primedlymphocytesNIT-1cell-primedlymphocytesNIT-hAATcell-primedlymphocytesNIT-1218.29±4.75196.06±1.82*22.80±3.7524.20±4.75*NIT-hAAT41.83±3.46**33.54±5.82**45.40±2.60**52.10±3.25**Control182.01±6.42164.60±5.2328.20±0.8232.20±7.21
*P<0.05,**P<0.01vscontrol or NIT-1.
2.3实时荧光定量PCR检测炎症因子mRNA表达 与NIT-1细胞移植受体鼠相比,NIT-hAAT细胞移植受体鼠脾淋巴细胞中CRP mRNA的表达明显增强(P<0.05),而IL-1β和IL-6 mRNA的表达减弱(P<0.05),见图3。这表明hAAT可抑制炎症因子的表达。

Figure 3. Inflammatory cytokine expression analysed by real-time fluorescence quantitative PCR from aninvitroextended CTL assay. A,C,E:mediated by NIT-1 cell-primed lymphocytes; B,D,F: mediated by NIT-hAAT cell-primed lymphocytes.Mean±SD.n=3.*P<0.05vsNIT-1.
图3实时荧光定量PCR检测炎症因子mRNA表达
2.4流式细胞术检测细胞凋亡 经丝裂霉素处理的NIT-1或NIT-hAAT细胞分别与NIT-1或NIT-hAAT细胞诱导产生的CTL混合培养7 d后,流式细胞术检测发现,NIT-1细胞与NIT-1诱导产生的CTL细胞混合培养时,NIT-1细胞发生明显的细胞凋亡(37.55%±1.05%);与NIT-hAAT诱导产生的CTL细胞混合培养时,NIT-1细胞凋亡发生率较低(12.94%±0.36%)(P<0.05)。NIT-hAAT细胞与NIT-1诱导产生的CTL细胞混合培养时,NIT-hAAT细胞凋亡明显降低(10.05%±0.95%);而与NIT-hAAT诱导产生的CTL细胞混合培养时,NIT-hAAT细胞凋亡最低(8.56%±1.34%)(P<0.05),见图4。

Figure 4. The apoptosis of NIT-1 (A,C) and NIT-1-hAAT (B,D) cells determined by flow cytometric analysis with Annexin V-FITC and PI staining. A, B:mediated by NIT-1 cell-primed lymphocytes; C,D:mediated by NIT-hAAT cell-primed lymphocytes.
图4流式细胞术分析NIT-1或NIT-hAAT细胞凋亡散点图
3AAT对NIT-1细胞移植后的功能影响
3.1糖尿病模型小鼠血糖和体重变化 糖尿病BALB/c小鼠左肾包膜移植NIT-1或NIT-hAAT细胞后,每3 d监测1次各组小鼠血糖浓度变化,移植后第3 d两组小鼠的血糖均迅速降低。NIT-1组在移植12 d后血糖开始升高,15 d时升至0.3 g/L,第30 d摘除左肾后血糖无明显变化;NIT-hAAT组小鼠维持正常血糖水平至30 d,在第30 d摘除左肾后血糖迅速升高至糖尿病水平。NIT-hAAT组小鼠体重平缓增加,NIT-1组和糖尿病组小鼠体重逐渐减少,见图5A。
3.2胰岛素和C肽水平 胰岛素和C肽水平方面,NIT-hAAT组小鼠移植3 d后开始明显升高,并维持在较高水平,较糖尿病组小鼠升高显著(P<0.01)。NIT-1组小鼠在移植后第3 d开始明显升高并持续至第14 d,之后胰岛素和C肽水平逐渐降低,第21 d时与糖尿病组相比无明显区别,见图5B、C。
4病理学观察
NIT-1组移植后14 d时只残存少量移植细胞,浸润炎症细胞数量为(31.0±1.0),28 d时未见移植细胞,组织呈纤维化改变。NIT-hAAT组在移植后14 d时有大部分移植细胞存活,浸润炎症细胞数量为(14.0±2.9),明显低于NIT-1组(P<0.01),28 d后NIT-hAAT组炎症细胞浸润(16.0±3.6)与14 d无明显变化,仍有移植细胞存活,见图6。

Figure 5. Changes of blood glucose (A), insulin (B) and C-peptide (C) levels in diabetic mice after transplantation. Mean±SD. Ten mice were used in monitoring blood sugar level. Five mice were used in determination of C-peptide and insulin secretion.*P<0.05vsdiabetes.
图5糖尿病小鼠移植NIT-1或NIT-hAAT细胞后血糖、胰岛素和C-肽水平的变化
讨 论
NIT-1是一种能自主分泌胰岛素的NOD鼠源β细胞系,是研究1型糖尿病的常用细胞模型[11]。本研究中将AAT基因导入NIT-1,构建NIT-hAAT细胞系,经Western blotting方法证实,NIT-hAAT细胞系在体外扩增培养至40代后仍具有良好的自我增殖和分泌hAAT的能力。在体外CTL实验中,将NIT-hAAT和NIT-1细胞分别与NIT-hAAT和NIT-1细胞刺激的同种异体BALB/c小鼠CTL共培养,发现NIT-hAAT细胞对CTL的刺激增殖作用明显低于NIT-1细胞。与NIT-1组相比,NIT-hAAT组CTL的Th1(IFN-γ)分泌水平明显降低(P<0.05),Th2(IL-4)分泌水平明显升高。与NIT-1细胞移植受体小鼠相比,NIT-hAAT细胞移植受体鼠CTL中CRP mRNA的表达明显增强(P<0.05),而炎症因子IL-1β、IL-6mRNA的表达减弱(P<0.05)。NIT-hAAT细胞与NIT-hAAT诱导产生的CTL混合培养时,NIT-hAAT细胞凋亡最低(P<0.05)。通过CTL实验证实,hAAT具有保护NIT-1细胞的作用,可能通过与IL-1β和IFN-γ结合抑制对β细胞破坏[12];也可能在β细胞内通过抑制caspase-3活化直接发挥抗凋亡作用[7];或通过调节Th1/Th2细胞因子的平衡发挥作用。IL-4属于Th2型细胞因子,可以促进Th0向Th2分化,抑制Th0向Th1分化,NIT-hAAT细胞能够促进IL-4的产生。因此推测,AAT可能诱导Th2细胞的产生,分泌过量的IL-4,进而下调Th1细胞因子的杀伤能力,同时抑制炎症因子的基因表达。本研究的实验结果证实,NIT-hAAT细胞与NIT-hAAT细胞介导的CTL共培养时,NIT-hAAT细胞凋亡率最低,与NIT-1细胞介导的CTL共培养,NIT-hAAT细胞凋亡率也明显降低,表明AAT可能通过免疫保护和免疫抑制发挥双重作用。

Figure 6. The pathological changes of mouse left kidneys after transplantation (HE staining).A,B:14 d after transplantation;C,D:21 d after transplantation; A,C: NIT-1 group; B,D: NIT-hAAT group. Scale bar=200 μm.
图6糖尿病小鼠移植部位病理学分析
糖尿病模型鼠的移植实验中,将NIT-hAAT细胞移植到糖尿病小鼠左肾[13],血糖在移植3 d后明显降低,维持至30 d,左肾摘除后血糖迅速升高成为高血糖症;而NIT-1细胞移植组小鼠血糖在移植3 d后降低,12 d后即开始迅速升高。我们同时观察到,在14、21和28 d时NIT-hAAT组小鼠血清胰岛素和C肽水平较糖尿病组和NIT-1组小鼠明显升高(P<0.05)。张悦等[14]同样证实,AAT可提高NIT-1细胞生存能力和减轻炎症反应的发生。我们先前将NIT-hAA移植到7周龄雌性NOD鼠左肾包膜下,发现NIT-hAAT移植后NOD鼠糖尿病的发生时间明显推迟,发病率明显降低;胰腺炎减轻,胰岛细胞凋亡减少,移植部位炎症细胞浸润减少, hAAT具有抑制移植物免疫排斥反应和抑制自身免疫攻击的双重作用[12]。Lewis等[15]在胰岛移植实验中发现,AAT可阻断中性粒细胞与巨噬细胞对移植物的浸润,在移植物周围形成袖口状T调节细胞层,这些细胞表达Foxp3、TGF-β、CTLA-4等T调节细胞相关蛋白;Walters等[16]也在移植物周围发现类似的保护细胞层,从而减少移植物的炎症浸润,延长存活时间。由于胰岛素瘤细胞系来自NOD/Lt小鼠,移植后会发生免疫排斥,NIT-hAAT细胞表达的hAAT蛋白能够抑制对胰岛细胞的免疫排斥反应,并表现出免疫保护作用;通过上调IL-4的分泌,调节Th1/Th2细胞的平衡,抑制免疫反应发生,减轻胰岛β细胞移植中的免疫排斥反应,延长胰腺β细胞在小鼠体内存活期。NIT-hAAT在体内如何发挥免疫抑制和免疫保护的作用机制,以及是否具有诱导免疫耐受,维持长久移植的胰岛细胞存活,还需要进一步研究。
综上所述,本研究通过构建携带免疫调节功能元件hAAT的胰岛β细胞构建NIT-hAAT细胞系。通过单向混合淋巴细胞增殖实验,证实hAAT对胰岛细胞具有双重免疫保护作用。将NIT-hAAT移植到糖尿病小鼠体内,发现NIT-hAAT能够在体内发挥负性免疫调节作用,短期内可以抑制移植物免疫排斥反应。
[1] Couzin J.Diabetes:islet transplants face test of time [J].Science,2004,306(5693):34-37.
[2] Jie Z,Cai Y,Yang W,et al. Protective effects of α1-antitrypsin on acute lung injury in rabbits induced by endoto-xin[J].Chin Med J (Engl),2003,116(11):1678-1682.
[3] Churg A,Dai J,Zay K,et al.α1-antitrypsin and a broad spectrum metalloprotease inhibitor, RS113456, have similar acute anti-inflammatory effects[J].Lab Invest,2001,81(8):1119-1131.
[4] Daemen MA,Heemskerk VH,van’t Veer C,et al.Functional protection by acute phase proteins α1-acid glycoprotein and α1-antitrypsin against ischemia/reperfusion injury by preventing apoptosis and inflammation[J].Circulation,2000,102(12):1420-1426.
[5] Brantly ML,Wittes JT,Vogelmeier CF, et al.Use of a highly purified α1-antitrypsin standard to establish ranges for the common normal and deficient α1-antitrypsin phenotypes[J]. Chest,1991,100(3):703-708.
[6] Weir GC,Koulamnda M.Control of inflammation with α1-antitrypsin: a potential treatment for islet transplantation and new-onset type 1 diabetes[J].Curr Diab Rep, 2009, 9(2):100-102.
[7] Zhang B, Lu Y, Campbell-Thompson M,et al.α1-antitrypsin protects β-cells from apoptosis[J].Diabetes,2007,56(5):1316-1323.
[8] 徐明彤,程 桦,陈黎红,等. 实时FQ-PCR检测链脲佐菌素诱导糖尿病小鼠模型胰腺survivin基因的表达[J].中国病理生理杂志,2006,22(2):330-333.
[9] Molano RD, Pileggi A, Song S, et al. Prolonged islet allograft survival by alpha-1 antitrypsin: the role of humoral immunity[J].Transplant Proc,2008,40(2):455-456.
[10] Lewis EC,Mizrahi M,Toledano M,et al.α1-Antitrypsin monotherapy induces immune tolerance during islet allograft transplantation in mice[J]. Proc Natl Acad Sci U S A,2008,105(42):16236-16241.
[11] Hamaguchi K,Gaskins HR,Leiter EH. NIT-1, a pancrea-tic β-cell line established from a transgenic NOD/Lt mouse[J].Diabetes,1991,40(7):842-849.
[12] Ye J, Liao YT, Jian YQ,et al.Alpha-1-antitrypsin for the improvement of autoimmunity and allograft rejection in beta cell transplantation[J].Immunol Lett, 2013,150(1-2):61-68.
[13] 祝希媛,何 瑾,柏平阿. 刀豆素A对小鼠同种胰岛移植的影响[J].中国病理生理杂志,1991,7(1):54-57.
[14] 张 悦,张育森,余小舫,等. 胎鼠胰腺干细胞原位移植治疗糖尿病的实验研究[J].中国病理生理杂志,2008,24(8):1595-1599.
[15] Lewis EC,Shapiro L,Bowers OJ, et al.α1-Antitrypsin monotherapy prolongs islet allograft survival in mice[J]. Proc Natl Acad Sci U S A,2005,102(34):12153-12158.
[16] Walters S, Webster KE, Sutherland A, et al.Increased CD4+Foxp3+T cells in BAFF-transgenic mice suppress T cell effector responses[J].J Immunol,2009,182(2):793-801.
Immunosuppressiveandprotectiveeffectsofhumanα1-antitrypsinonpancreaticβ-celltransplantation
ZHANG Xiao-dan, YE Jian, LIAO Yu-ting, QI Hui, DENG Chun-yan, LI Fu-rong
(KeyLaboratoryofStemCellandCellularTherapy,theSecondClinicalMedicalCollege,ShenzhenPeople’sHospital,JinanUniversity,Shenzhen518020,China.E-mail:frli62@yahoo.com)
AIM: To study the immunosuppressive and protective effects of human α1-antitrypsin (hAAT) on pancreatic β-cell transplantation.METHODSAn NIT-1 cell line (NIT-hAAT) was constructed, which can stably express the protein of hAAT. The BALB/c mice were intraperitoneally injected with NIT-1 and NIT-hAAT cell lines twice to induce cytotoxic T-lymphocytes (CTL). The apoptotic situation, the cytokine expression, and the mRNA expression of inflammatory factors were examined after mixed culture of CTL with NIT-1 or NIT-hAAT cell line pretreated with mitomycin. Both cell lines were transferred into the left renal capsule of the diabetic mice to dynamically observe the changes of blood sugar and body weight, the serum levels of insulin and C-peptide, and the pathological changes of the transplanted sites.RESULTSThe results of extended CTL killing assay showed that the cytotoxic effect on NIT-hAAT cell acceptor mice was significantly reduced compared with NIT-1 cell acceptor mice. hAAT effectively reduced apoptosis, inhibited the mRNA expression of inflammatory factors IL-1β and IL-6, and adjusted the balance of Th1/Th2 cytokine expression. After NIT-hAAT was transplanted into the diabetic mice, blood glucose decreased obviously and maintained for 28 d. The serum levels of insulin and C-peptide increased obviously. The infiltration of the inflammatory cells in the transplanted sites significantly reduced.CONCLUSIONhAAT has the abilities of reducing cytotoxic effect of CTL on the β-cells, inhibiting inflammatory factor expression, and stopping short-term immunological rejection of the acceptor. hAAT has obvious immunosuppressive and protective effects on pancreatic β-cell transplantation for treatment of diabetes.
α1-antitrypsin; β-cells; Transplantation; Immunosuppression; Diabetes mellitus
R392.11
A
10.3969/j.issn.1000- 4718.2013.04.008
1000- 4718(2013)04- 0619- 07
2013- 01- 14
2013- 03- 11
国家973前期专项(No. 2007CB516811);国家自然科学基金资助项目(No.81270857);深圳市科技计划(No. 200901001)
△通讯作者 Tel: 0755-25533018-2450; E-mail: frli62@yahoo.com
