瑞舒伐他汀抑制C-反应蛋白诱导的晚期内皮祖细胞炎症因子的表达*
2013-12-23钟钧琳罗艳婷刘金来
钟钧琳, 彭 隆, 罗艳婷, 刘金来
(中山大学附属第三医院心内科,广东 广州510630)
C-反应蛋白(C-reactive protein,CRP)不仅是一种炎症标志物和心血管疾病强有力预测因子,而且参与了从脂质条纹形成到易损斑块破裂所致急性冠脉综合征的形成过程[1]。CRP 可通过减少一氧化氮(nitric oxide,NO)的释放[2]、上调黏附分子的表达[3]、刺激平滑肌细胞增殖及迁移[4]、激活补体系统[5]等一系列生物学作用导致内皮动脉粥样硬化。
血管内皮祖细胞(endothelial progenitor cells,EPCs)是内皮细胞前体细胞,参与血管损伤后修复,维持血管壁完整性。EPCs 分为早期内皮祖细胞(early EPCs)和晚期内皮祖细胞(late EPCs;又称endothelial outgrowth cells,EOCs)。自1997 年Arasaha等[6]从人外周血中分离出内皮祖细胞以来,大多数研究将能摄取乙酰化低密度脂蛋白(ac-LDL)和结合荆豆凝集素(UEA-1),并表达CD34、VEGFR2 和CD133 等抗原的一群细胞称为EPCs。2000 年Lin等[7]从人外周血中成功分离培养出EOCs。EOCs 是一类能增殖并分化为成熟且有功能的血管内皮细胞的前体细胞。Hur 等[8]发现EOCs 比早期EPCs 有更强的黏附能力,在体外血管形成能力上,EOCs 要显著强于早期EPCs。
本课题拟研究CRP 对EOCs 旁分泌致炎因子单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)、白细胞介素8(interleukin-8,IL-8)、血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)及细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)情况的影响,以及探讨他汀药物瑞舒伐他汀对CRP 所致致炎因子的作用,进一步提供CRP 致炎、致动脉粥样硬化的证据,为动脉粥样硬化的防治提供新的靶点。
材 料 和 方 法
1 主要材料与试剂
淋巴细胞分离液购于MP Biomedicals;内皮细胞基础培养基(endothelial basal medium-2,EBM-2)购于Lonza,内皮细胞培养基生长因子套装(EGM-2 singleQuot Kit Suppl & Growth Factors)购于Clonetics;人纤维连接蛋白(fibronectin,FN)购于Millipore;重组人C 反应蛋白CRP 购自Calbiochem;DiI-乙酰化低密度脂蛋白(DiI-ac-LDL)购于Molecular Probe;FITC-荆豆凝集素Ⅰ(FITC-UEA-I)购于Sigma;FITC-CD14、FITC-CD34、PE-VEGFR2 和PC5-CD45 均购于BD,PE-CD133 购于Miltenyi;Trizol 试剂购于Invitrogen;逆转试剂盒购于TaKaRa;荧光定量PCR 试剂盒购于TaKaRa;MCP-1 和VCAM-1 ELISA 试剂盒购于Bender;瑞舒伐他汀购于南京德宝公司。
2 方法
2.1 人脐血EOCs 的分离与培养 收集中山三院健康足月产孕妇脐带血30 mL,所有血标本的获得均告知产妇,并签署知情同意书。用PBS 缓冲液1∶1稀释,铺于淋巴细胞分离液表面,稀释血与淋巴细胞分离液体积比为2 ∶1,形成清晰界面。800 × g 离心30 min,将白膜状单个核细胞吸入另一管内,PBS 清洗2 次后,用5%胎牛血清EGM-2 培养液重悬,接种于包被有纤维连接蛋白的6 孔板,置37 ℃、5%CO2培养箱(95%空气)中孵育24 h 后用PBS 轻柔洗去未贴壁细胞并更换新鲜培养液。此后每3 d 更换全部培养液。待原代细胞生长汇合后传代进行下一步实验。
2.2 EOCs 的鉴定
2.2.1 DiI-ac-LDL 和FITC-UEA-1 双荧光染色鉴定
取传代后第2 代细胞与10 mg/L DiI-ac-LDL 置于37 ℃下孵育4 h,以2%多聚甲醛固定10 min,再加入10 mg/L FITC-UEA-1,37 ℃孵育1 h。荧光显微镜下观察,DiI-ac-LDL 和FITC-UEA-1 双染色阳性的细胞即为正在分化的EOCs。
2.2.2 流式细胞术测定法 将传代后第2 代细胞以0.25%胰酶消化后,制成106个细胞/L 单细胞悬液加入荧光标记抗CD34、KDR、CD133、CD14 和CD45 抗体各5 μL,避光孵育30 min 后上机,流式细胞仪分析EOC 的CD34、KDR、CD133、CD14 和CD45表达。
2.3 细胞分组处理 取第3 ~6 代细胞分为3 组进行实验。CRP 量效组:将CRP 不同浓度(0、5、10、25、50 mg/L)分别与EOCs 孵育。CRP 时效组:将50 mg/L CRP 分别与EOC 孵育不同时间(0、3、6、12 h)。瑞舒伐他汀量效组:将细胞用瑞舒伐他汀不同浓度(10-8mol/L,10-7mol/L,10-6mol/L)预孵育12 h,再加入CRP 50 mg/L 刺激。空白对照不加任何试剂,阳性对照只加CRP 50 mg/L。
2.4 荧光定量PCR 检测 分别收集各组细胞,按照Trizol 说明书提取各组细胞总RNA 后,将RNA 逆转录为cDNA,cDNA 逆转录按试剂盒说明书进行。以所逆转录的cDNA 为模板,各靶基因PCR 引物设计参考文献,由上海英潍捷基公司合成。IL-8 正义序列5'-AAACCACCGGAAGGAACCAT-3',反义序列5'-CCTTCACACAGAGCTGCAGAAA-3';MCP-1 正义序列5'-CAGCCAGATGCAATCAATGC-3',反义序列5'-GTGGTCCATGGAATCCTGAA-3';VCAM-1 正义序列5'-CAAATCCTTGATACTGCTCATC-3',反义序列5'-TTGACTTCTTGCTCACAGC-3';ICAM-1 正义序列5'-CTCAGTCAGTGTGACCGCAGA-3',反 义 序 列 5'-CCCTTCTGAGACCTCTGGCTTC-3';内参照β-actin 正义序列5'-CAACTGGGACGACATGGAGAAA-3',反义序 列 5'-GATAGCAACGTACATGGCTGGG-3'。使 用SYBR® Green 嵌合荧光法,按试剂盒进行操作。95℃30 s 预变性后,95 ℃5 s,60 ℃34 s,40 个循环,最后95 ℃15 s,60 ℃1 min,95 ℃15 s 融解。根据2-ΔΔCt值计算mRNA 表达的相对量。
2.5 ELISA 检测 细胞经分组处理培养后收集上清液,步骤严格按照试剂盒操作说明进行,分别检测细胞上清液中MCP-1 和ICAM-1 表达量。
3 统计学处理
每组实验重复3 次以上,计量资料以均数±标准差(mean ±SD)表示。主要统计数据均进行正态性及方差齐性检验,正态分布数据组间差异性比较采用单因素方差分析,LSD 法进行两组间多重比较。采用SPSS 15.0 统计软件进行分析,以P <0.05 为差异有统计学意义。
结 果
1 EOCs 的鉴定
脐血分离获得的单个核细胞培养约第4 ~6 d 开始出现梭形细胞,第6 ~8 d 左右形成若干个细胞集落,在15 ~20 d 左右各个集落相互融合呈椭圆形铺路石样排列(图1A)。荧光显微镜观察,DiI-ac-LDL和FITC-UEA-1 双染色阳性的细胞为正在分化的EOCs(图1D)。用流式鉴定法可见干细胞标志CD34阳性率30.6%,CD133 阳性率5.97%,内皮细胞系标志KDR(VEGFR2)阳性率92.9%,而CD14 阳性率3.26%,CD45 阳性率2.96%,见图2。
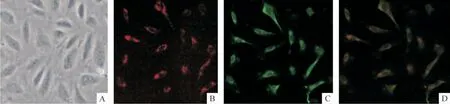
Figure 1. Morphoplogy and identification of the EOCs(×200). A:cobblestone-like cells;B:DiI-ac-LDL;C:FITC-UEA-1;D:merged.图1 EPCs 细胞形态及荧光染色鉴定结果
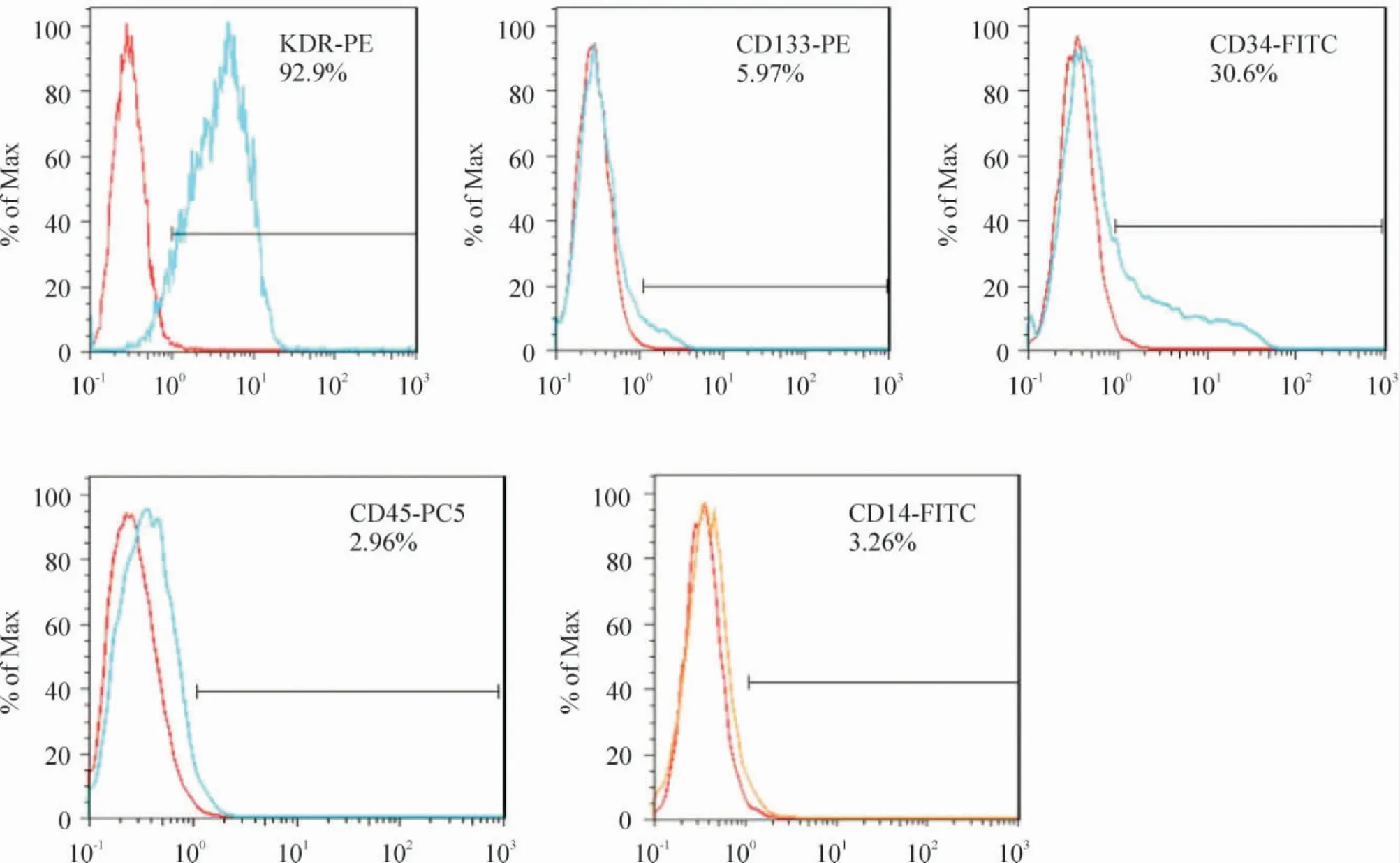
Figure 2. Phenotyping of EOCs detected by flow cytometry.图2 EOCs 流式鉴定结果
2 CRP 刺激EOCs 后炎症 因子IL-8、MCP-1、VCAM-1 和ICAM-1 mRNA 表达
CRP(5、10、25 和50 mg/L)刺激EOCs 6 h 后,IL-8 mRNA 表达量分别为97%、98%、141% 和198%,MCP-1 mRNA 表达量分别为99%、116%、152% 和197%,VCAM-1 mRNA 表达量分别为102%、119%、133%和147%,ICAM-1 mRNA 表达量分别为102%、103%、130%和160%,在CRP 50 mg/L 刺激下四者的表达量均达高峰,与对照组比较差异有统计学意义(P <0.01),见图3A。同时,我们用CRP 50 mg/L 分别刺激EOCs 3、6 和12 h,IL-8 mRNA 的表达量分别为227%、260% 和120%,MCP-1 mRNA 表达量分别为340%、180%和109%,VCAM-1 mRNA 表达量为152%、260%和102%,ICAM-1 mRNA 表达量为155%、173% 和127%,可见IL-8、VCAM-1 和ICAM-1 mRNA 表达量在CRP 刺激6 h达高峰,MCP-1 mRNA 表达量在CRP 刺激3 h 后达高峰,且与对照组比较均差异有统计学意义(P <0.01),见图3B。
3 CRP 刺激EOCs 后MCP-1 和VCAM-1 蛋白表达
在CRP 为5、10、25 和50 mg/L 浓度下培养12 h,上清液中MCP-1 蛋白表达量分别为218.9 ng/L、240.2 ng/L、343.0 ng/L 和512.0 ng/L(对 照 组212.5 ng/L),VCAM-1 蛋白表达量分别为34.8 ng/L、37.7 ng/L、48.5 ng/L 和61.2 ng/L(对照组34.5 ng/L),其中50 mg/L 组与对照组比较差异有统计学意义(P <0.05),见表1。同样,EOCs 在CRP 50 mg/L 浓度刺激3、6 和12 h,上清液中MCP-1 蛋白表达量为346.8 ng/L、460.2 ng/L 和517.5 ng/L(对照组276.7 ng/L),VCAM-1 蛋白表达量为31.8 ng/L、32.1 ng/L和45.8 ng/L(对照组30.5 ng/L),其中CRP 刺激12 h 组与对照组比较两者均有显著差异(P <0.05),见表2。
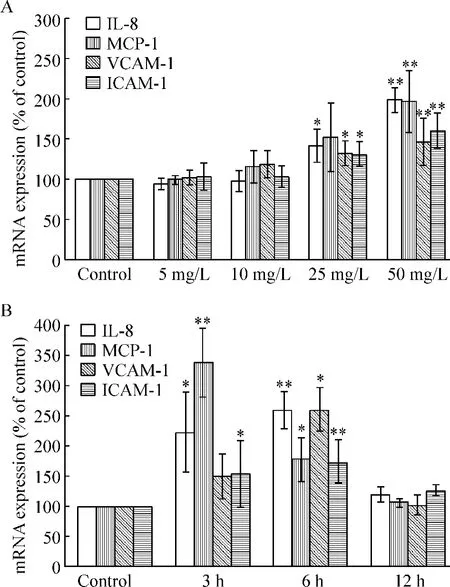
Figure 3. Effects of CRP on the expression of IL-8,MCP-1,VCAM-1 and ICAM-1 mRNA in EOCs. A:EOCs were treated with CRP at different concentrations (0,5,10,25 and 50 mg/L)for 6 h;B:EOCs were incubated with 50 mg/L CRP for different exposure time(0,3,6 and 12 h). Mean ± SD. n = 3. * P <0.05,**P <0.01 vs control.图3 CRP 对EOCs IL-8、MCP-1、VCAM-1 和ICAM-1 mRNA 表达的影响
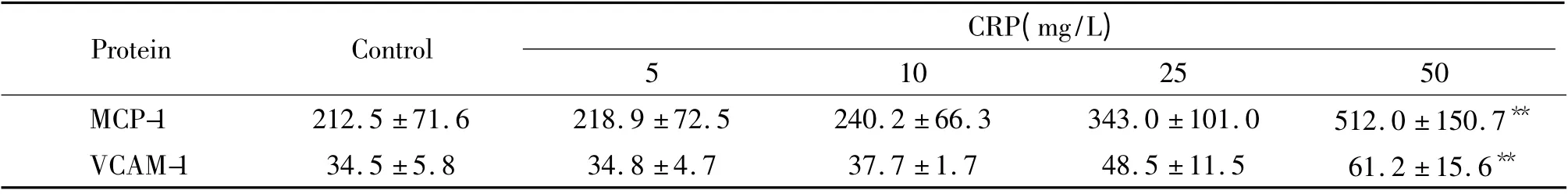
表1 不同浓度CRP 刺激EOCs 后细胞上清液MCP-1 和VCAM-1 的变化Table 1. Supernatant MCP-1 and VCAM-1 levels in EOCs stimulated with CRP at different doses(ng/L.Mean±SD.n=3)

表2 50 mg/L CRP 不同时间刺激EOCs 后细胞上清液MCP-1 和VCAM-1 的变化Table 2. Supernatant MCP-1 and VCAM-1 levels in EOCs stimulated with 50 mg/L CRP at different time points(ng/L.Mean±SD.n=3)
4 瑞舒伐他汀下调CRP 所致的EOCs IL-8、MCP-1 、VCAM-1 和ICAM-1 mRNA 表达
以50 mg/L CRP 刺激6 h 为阳性对照,分别用不同浓度的瑞舒伐他汀(10-8、10-7和10-6mol/L)预孵育12 h 再加50 mg/L CRP 刺激6 h。与空白对照组比较,阳性对照组细胞内IL-8、MCP-1、VCAM-1 和ICAM-1 mRNA 表达量分别为205%、161%、268%和194%。随着瑞舒伐他汀浓度增加(10-8、10-7和10-6mol/L),各基因表达量均减少,IL-8 mRNA 表达量分别为165%、131%和66%;MCP-1 mRNA 表达量分别为155%、138%和94%;VCAM-1 mRNA 表达量分别为265%、208%和144%;ICAM-1 mRNA 表达量分别为190%、180%和126%。各基因在10-6mol/L组与阳性对照CRP 组比较表达量均下降,差异均有统计学意义(P <0.05),见图4。
5 瑞舒伐他汀下调CRP 刺激EOCs 所致的MCP-1和VCAM-1 蛋白表达
以50 mg/L CRP 刺激12 h 为阳性对照,分别用瑞舒伐他汀不同浓度(10-8、10-7和10-6mol/L)预孵育12 h 再加50 mg/L CRP 刺激12 h。阳性对照组细胞上清液中MCP-1 和VCAM-1 蛋白表达量分别为606 ng/L(对照组276.7 ng/L)和51.0 ng/L(对照组32.0 ng/L)。随着他汀浓度增加,上清液中MCP-1蛋白表达量分别为559.6 ng/L、494.8 ng/L 和217.5 ng/L;VCAM-1 上清液蛋白表达量分别为46.8 ng/L,38.1 ng/L 和26.2 ng/L。各基因10-6mol/L 组与阳性对照CRP 组比较表达量均下降,均有统计学意义(P <0.05),见表3。
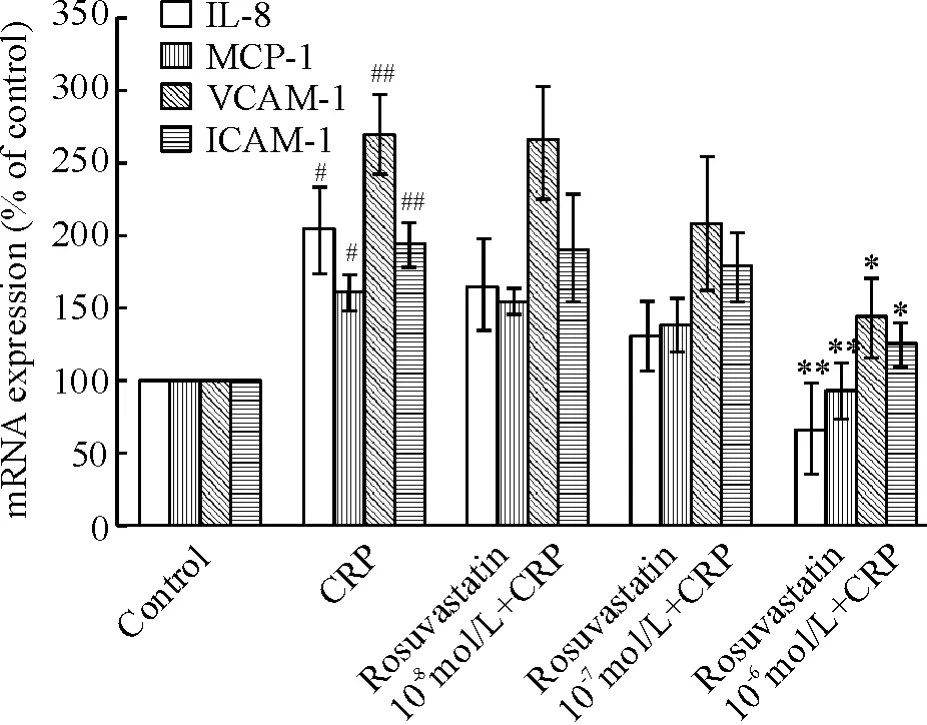
Figure 4. Effects of rosuvastatin on CRP-induced expression of IL-8,MCP-1,VCAM-1 and ICAM-1 in EOCs. EOCs were treated with different concentrations of rosuvastatin (10 -8,10 -7 和10 -6 mol/L)for 12 h,and then stimulated with 50 mg/L CRP.Maen±SD. n =3. * P<0.05,** P <0.01 vs CRP group;#P <0.05,##P <0.01 vs control.图4 瑞舒伐他汀对CRP 诱导EOCs IL-8、MCP-1、VCAM-1和ICAM-1 mRNA 表达的影响

表3 瑞舒伐他汀对50 mg/L CRP 刺激后EOCs 细胞上清液MCP-1 和VCAM-1 变化的影响Table 3. Effects of rosuvastatin on supernatant MCP-1 and VCAM-1 levels in EOCs stimulated with 50 mg/L CRP(ng/L.Mean±SD.n=3)
讨 论
CRP 是一种非特异性急性期反应蛋白,是体内炎症反应和组织损伤敏感性指标之一,与冠心病的发生和发展有着密切的关系。冠心病的始动因素是内皮损伤。Liang 等[9]发现,CRP 可通过脐静脉内皮细胞和大动脉内皮细胞细胞膜上CD32 受体引起转录因子NF-κB 激活,使细胞VCAM-1 mRNA 及蛋白表达增高;又有报道CRP 可通过促进晚期糖基化终产物(advanced glycation end-products,AGEs)与内皮细胞表面的晚期糖基化终产物受体(receptor for AGEs,RAGE)结合,促进MCP-1 表达增加,引起单核细胞、中性粒细胞募集、趋化至血管内皮细胞处[10]。而RAGE 与配体相互作用还可激活NF-κB 途径,导致细胞信号级联反应,如激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、p38 有丝分裂原激活蛋白激酶(p38 MAPK)和PKC 从而传递炎症信号,上调一系列炎症细胞因子的表达[11]。而IL-8 和MCP-1 可引起单核细胞和中性粒细胞募集、趋化至血管内皮细胞处[12],同时VCAM-1 和ICAM-1可增加单核细胞和内皮细胞黏附。而单核细胞进入内皮下后,可分化成血管内膜巨噬细胞,脂质摄取转化为泡沫细胞,泡沫细胞堆积在血管壁上,导致脂肪条纹加速形成,启动动脉粥样硬化过程[9]。EPCs 是内皮细胞的前体,它在血管新生和维持内皮功能完整中具有重要作用,有文献报道[13-14],CRP 可直接影响EPCs 的增殖、迁移、黏附功能,促进其凋亡,损害其再内皮化功能,降低血管再生潜能。研究发现冠心病患者外周血EPCs 的数量、生物学功能均有显著下降[15]。故本课题主要研究CRP 对EOCs 是否存在致炎作用,通过体外培养EOCs,发现不同浓度和不同时间的CRP 刺激可促进EOCs 分泌炎症因子IL-8、MCP-1、VCAM-1 和ICAM-1,这一发现为解释炎症和心血管疾病之间的关系提供了依据,然而具体的机制尚未清楚。有文献报道[16],MCP-1 能通过p35依赖的线粒体途径促进内皮细胞凋亡。
他汀类药物是一类HMG-CoA 还原酶抑制剂,不仅具有降脂作用,还有明显改善血管内皮功能、抑制炎症的作用。Chen 等[17]报道,高脂饮食能导致小鼠炎症相关的内皮功能障碍,而阿托伐他汀能下调体内CRP 和IL-6 水平改善炎症,并下调内皮素1(endothelin-1,ET-1)及上调NO 水平而改善内皮功能。杨冰等[18]发现阿托伐他汀可通过提高循环中EPCs数量,改善EPCs 的增殖、迁移、黏附功能,增加EPCs对血管内皮细胞的修复能力。那么他汀对于CRP 所致EOCs 炎症因子情况是否存在影响?本研究首次发现,瑞舒伐他汀能明显降低CRP 所致EOCs 分泌炎症因子的水平,这进一步支持了Chang 等[19]的研究:辛伐他汀能抑制CRP 所致的脐静脉内皮细胞VCAM-1、MCP-1 和IL-8 分泌,抑制CRP 在血管炎症发生过程中的作用。但瑞舒伐他汀调节CRP 刺激EOCs 所致炎症的分子机制有待于进一步的研究。
总之,本研究表明CRP 可作为致炎因子刺激晚期内皮祖细胞分泌趋化因子(IL-8、MCP-1)及黏附分子(VCAM-1、ICAM-1);瑞舒伐他汀能显著抑制CRP刺激EOCs 所致的炎症因子(IL-8、MCP-1)和黏附分子(VCAM-1、ICAM-1)的分泌,从而为动脉粥样硬化的防治提供了新的靶点。
[1] Paffen E,deMaat MP. C-reactive protein in atherosclerosis:a causal factor?[J]. Cardiovasc Res,2006,71(1):30-39.
[2] Verma S,Wang CH,Li SH,et al. A self-fulfilling prophecy:C-reactive protein attenuates nitric oxide production and inhibits angiogenesis[J]. Circulation,2002,106(8):913-919.
[3] Verma S,Li SH,Badiwala MV,et al. Endothelin antagonism and interleukin-6 inhibition attenuate the proatherogenic effects of C-reactive protein[J]. Circulation,2002,105(16):1890-1896.
[4] Wang CH,Li SH,Weisel RD,et al. C-reactive protein upregulates angiotensin type 1 receptors in vascular smooth muscle[J]. Circulation,2003,107(13):1783-1790.
[5] Wolbink GJ,Brouwer MC,Buysmann S,et al. CRP-mediated activation of complement in vivo:assessment by measuring circulating complement-C-reactive protein complexes[J]. J Immunol,1996,157(1):473-479.
[6] Arasaha T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J]. Science,1997,275(5302):964-967.
[7] Lin Y,Weisdorf DJ,Solovey A,et al.Origins of circulating endothelial cells and endothelial outgrowth from blood[J].J Clin Invest,2000,105(1):71-77.
[8] Hur J,Yoon CH,Kim HS,et al. Characterization of two types of endothelial progenitor cells and their different contributions to neovasculogenesis[J]. Arterioseler Thromb Vasc Biol,2004,24(2):288-293.
[9] Liang YJ,Shyu KG,Wang BW,et al. C-reactive protein activates the nuclear factor-κB pathway and induces vascular cell adhesion molecule-1 expression through CD32 in human umbilical vein endothelial cells and aortic endothelial cells[J]. J Mol Cell Cardiol,2006,40 (3):412-420.
[10]Zhong Y,Li SH,Liu SM,et al. C-reactive protein upregulates receptor for advanced glycation end products expression in human endothelial cells[J].Hypertension,2006,48(3):504-511.
[11]Soro-Paavonen A,Watson AM,Li J,et al. Receptor for advanced glycation end products (RAGE)deficiency attenuates the development of atherosclerosis in diabetes[J]. Diabetes,2008,57(9):2461-2469.
[12]Gerszten RE,Garcia-Zepeda EA,Lim YC,et al. MCP-1 and IL-8 trigger firm adhesion of monocytes to vascular endothelium under flow conditions[J]. Nature,1999,398(6729):718-723.
[13]Verma S,Kuliszewski MA,Li SH,et al. C-reactive protein attenuates endothelial progenitor cell survival,differentiation and function:further evidence of a mechanistic link between C-reactive protein and cardiovascular disease[J].Circulation,2004,109(17):2058-2067.
[14]赵 薇,杨向红. C 反应蛋白对大鼠骨髓内皮祖细胞参与血管形成的影响[J]. 中国动脉硬化杂志,2011,19(2):105-109.
[15]张文斌,宋筱筱,傅国胜,等. 血管内皮生长因子对外周血内皮祖细胞功能的影响[J]. 中国病理生理杂志,2007,23(10):1896-1899.
[16]Zhang X,Liu X,Shang H,et al. Monocyte chemoattractant protein-1 induces endothelial cell apoptosis in vitro through a p53-dependent mitochondrial pathway[J]. Acta Biochim Biophys Sin,2011,43(10):787-795.
[17]Chen YX,Wang XQ,Fu Y,et al. Pivotal role of inflammation in vascular endothelial dysfunction of hyperlipidemic rabbit and effects by atorvastatin [J]. Int J Cardiol,2011,146(2):140-144.
[18]杨 冰,杨 松,周建中. 阿托伐他汀钙对高血压大鼠血管内皮细胞的保护作用[J]. 中国病理生理杂志,2010,26(3):452-456.
[19]Chang LT,Sun CK,Chiang CH,et al. Impact of simvastatin and losartan on anti-inflammatory effect:in vitro study[J]. J Cardiovasc Pharmacol,2007,49(1):20-26.
