PLGF 参与Ang II 诱导的心脏成纤维细胞激活*
2013-12-23张晓歌陶小玲张贤锐
张晓歌, 陶小玲, 张贤锐, 苏 立
(重庆医科大学附属第二医院心内科,重庆400010)
血管紧张素Ⅱ(angiotensin II,AngⅡ)与其I 型受体(angiotensin II receptor 1,AT1)结合可通过多个环节刺激炎症,促进细胞增殖及纤维化,导致心脏重构。研究提示,胎盘生长因子(placental growth factor,PLGF)与心血管疾病的病理过程有密切联系。在人血管内皮细胞和平滑肌细胞,Ang II 可诱导PLGF 的表达[1],在缺血性心肌病患者中PLGF 随心力衰竭的加重而升高[2]。心脏成纤维细胞(cardiac fibroblasts,CFs)在受到病理刺激后会发生增殖,其表型转化为有分泌胞外基质功能的肌成纤维细胞,在心脏重构过程中具有重要作用[3]。心肌重构过程中,在血液动力学和神经体液激素的影响下,各种炎症细胞被激活,分泌大量炎症因子,加剧纤维化的发展。研究表明,可溶性血管内皮生长因子受体1(soluble vascular endothelial growth factor receptor-1,sFlt-1)能够通过特异性的捕获PLGF 而抑制其活性,减少腹膜炎症过程中胶原的沉积,对腹膜纤维化有一定的抑制作用[4]。在心肌成纤维细胞中,阻断PLGF 对Ang II 诱导的细胞增殖及纤维化是否具有抑制作用尚不清楚。本研究旨在探讨PLGF 在Ang II 激活心脏成纤维细胞中的表达及其作用。
材 料 和 方 法
1 动物及主要试剂
出生2 ~3 d SD 大鼠,SPF 级,由重庆医科大学动物中心提供。小鼠抗大鼠波形蛋白单克隆抗体和蛋白酶抑制剂试剂盒均购自Abcam;Ang II、胰蛋白酶和II 型胶原酶均购自Sigma-Aldrich;胎牛血清购自Gibco;重组人PLGF 购自Peprotech;α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)和山羊单克隆抗体PLGF(anti-PLGF)购自Santa Cruz;兔抗大鼠ERK1/2 和p-ERK1/2 购自CST;DMEM/高糖培养基、兔抗山羊Ⅱ抗、山羊抗兔Ⅱ抗及山羊抗小鼠Ⅱ抗均购自北京鼎国公司;RIPA 蛋白裂解液、BCA 蛋白浓度测定试剂盒及小鼠抗大鼠α-tubulin 均购自碧云天公司;Trizol Reagent、逆转录、RT-PCR 试剂盒及引物均购自大连宝生生物公司。
2 主要方法
2.1 心脏成纤维细胞培养 无菌开胸剪取SD 大鼠心尖部(心室肌)组织,移入离心管后各加入3 mL浓度为0.08%胰蛋白酶和0.08%II 型胶原酶,37 ℃水浴中消化组织碎块,重复3 ~4 次。收集各次消化所得细胞,用含10%胎牛血清的DMEM 高糖培养基在5%CO2、37 ℃培养箱中培养,差速贴壁60 min 后弃去培养液,剩余贴壁细胞即为心脏成纤维细胞。将传代2 次的心脏成纤维细胞用于实验研究。
2.2 WST-1 检测细胞增殖 消化后用培养基吹散的细胞以4 000 cells/well 接种在96 孔板中,培养12 h 后无血清培养基饥饿24 h,药物干预24 h 后,每孔加入WST-1 10 μL,5%CO2、37 ℃培养箱继续孵育4 h,终止培养,振荡混匀15 min 后在酶联免疫检测仪上470 nm 波长处测定吸光度值,用600 nm 的波长作为参考波长。
2.3 免疫印迹 常规提取心肌组织总蛋白,BCA 法测定各组蛋白浓度。SDS-PAGE 凝胶电泳,蛋白电转移至PVDF 膜,封闭后分别稀释Ⅰ抗[ERK1/2(1∶1 000)、p-ERK1/2(1 ∶1 000)、α-SMA(1 ∶200)、PLGF(1∶200)和α-tubulin(1∶1 000)]孵育,4 ℃过夜,根据Ⅰ抗来源选用相应HRP 标记的Ⅱ抗孵育,ECL 显影,凝胶图像分析系统进行图像分析,以特异性目的蛋白条带光密度值与对应α-tubulin 蛋白条带吸光度值间的比值对蛋白表达量进行半定量分析。
2.4 免疫荧光检测α-SMA 的表达 将细胞种在24孔板的载玻片上,培养12 h,饥饿24 h,给予100 ng/L PLGF 干预24 h,4%多聚甲醛固定15 min,加1%BSA 室温下封闭非特异抗原1 h,冲洗后加入α-SMA Ⅰ抗4 ℃过夜,加入抗大鼠荧光标记Ⅱ抗37 ℃孵育1 h,荧光显微镜下观察分析。
2.5 实时荧光定量PCR 收集细胞,用Trizol 提取总RNA,紫外分光法确定RNA 的浓度和纯度,将其逆转录为cDNA。实时荧光定量反应条件:95 ℃预变性90 s 后进入PCR 循环:95 ℃变性10 s,60 ℃退火30 s,共40 个循环;扩增反应结束后,从65 ℃缓慢加热到95 ℃,以建立PCR 产物的熔解曲线。每个标本均设置复管PCR 反应。反应体系:10 μL。引物序列如下:I 型胶原蛋白上游引物5'-TCTGACTGGAAGAGCGGAGAG-3',下游引物5'-GAGTGGGGAACACACAGGTCT-3';III 型胶原蛋白上游引物5'-ACAGATGCTGGTGCTGAGAAGA-3',下 游 引 物 5'-GCTGGAAAGAAGTCTGAGGAAGG-3';PLGF 上游引物5'-CTGCTGGGAACAACTCAACAGA -3',下游引物5'-CTACAGCGACTCAGAAGGACACA-3';内参 照 βactin 上游引物5'-ACGGTCACAGG TCATCACTATCG-3',下游引物5'-GGCATAGAGGTCT TTACGGATG-3'。
数据的分析采用下述表达公式:目的mRNA 表达水平=2-ΔΔCt。
3 统计学处理
计量资料以均值±标准差(mean ±SD)表示,多组均数比较采用单因素ANOVA 法进行统计分析,组间两两比较采用最小显著性差异法(LSD 法),以P<0.05 为差异有统计学意义,统计软件采用SPSS 17.0。
结 果
1 Ang II 对PLGF 表达的影响
据预实验结果,Ang II(10-6mol/L)干预SD 大鼠的心脏成纤维细胞24 h,PLGF mRNA 表达水平最高,Ang II 可以增加PLGF 表达4.90 倍(P <0.01)。AT1受体阻断剂telmisartan(10-6mol/L)和AngII(10-6mol/L)联用干预后,PLGF mRNA 表达被抑制(P <0.05),见图1。图2 示Ang II 可以诱导PLGF蛋白水平的表达上调(P <0.05)。上述结果表明,Ang II 可能通过AT1受体调节PLGF 在心脏成纤维细胞内表达。
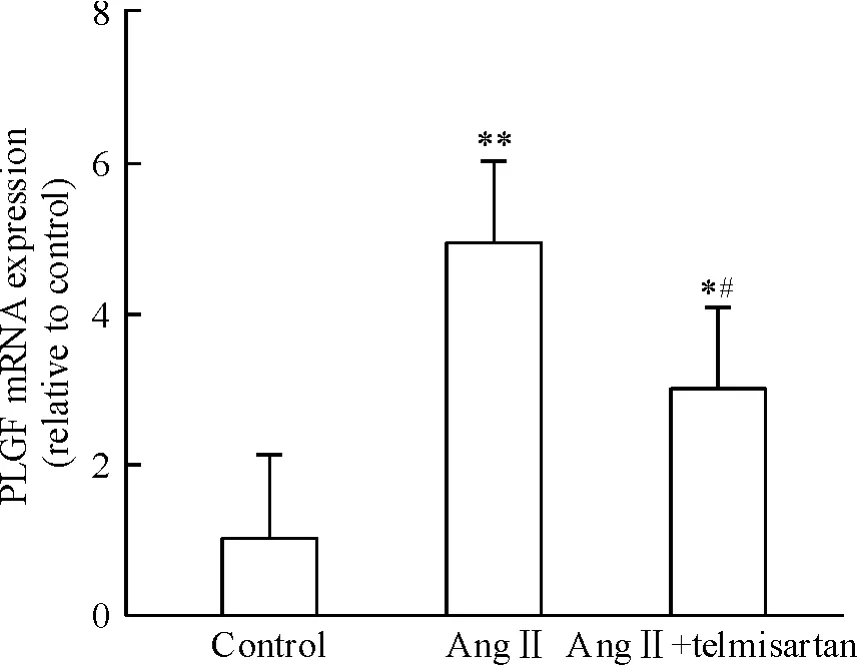
Figure 1. Effect of Ang II on the mRNA expression of PLGF.Mean ±SD.n =5. * P <0.05,**P <0.01 vs control;#P <0.05 vs Ang II.图1 Ang II 对PLGF mRNA 表达的影响
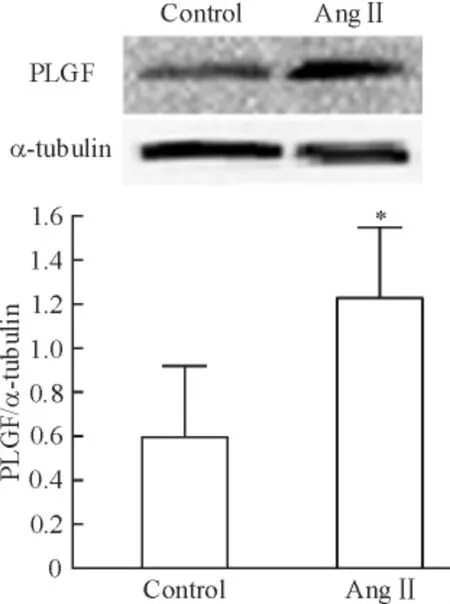
Figure 2. Effect of Ang II on the protein expression of PLGF in CFs.Mean±SD.n=4. * P <0.05 vs control.图2 Ang II 对PLGF 蛋白表达的影响
2 PLGF 对心脏成纤维细胞的影响
运用不同浓度(10、50 和100 ng/L)PLGF 干预成纤维细胞24 h 后细胞增殖如图3 所示,100 ng/L PLGF 明显诱导细胞增殖达2.21 倍(P <0.05)。PLGF(100 ng/L)干预细胞24 h 后,免疫荧光检测α-SMA,结果如图4 所示,与对照组相比,细胞荧光强度增加。相同浓度的PLGF 分别干预36 h 和48 h 后检测α-SMA 蛋白水平表达,如图5 所示,PLGF 干预48 h 后诱导α-SMA 表达明显增加(P <0.05)。以上结果提示,PLGF可以诱导心脏成纤维细胞增殖及向肌成纤维细胞转化。PLGF 干预细胞0 min、5 min、15 min、30 min 和60 min 后,检测p-ERK1/2 蛋白水平表达,如图6 所示,60 min 时p-ERK1/2 蛋白水平明显高于对照组(P <0.01)。
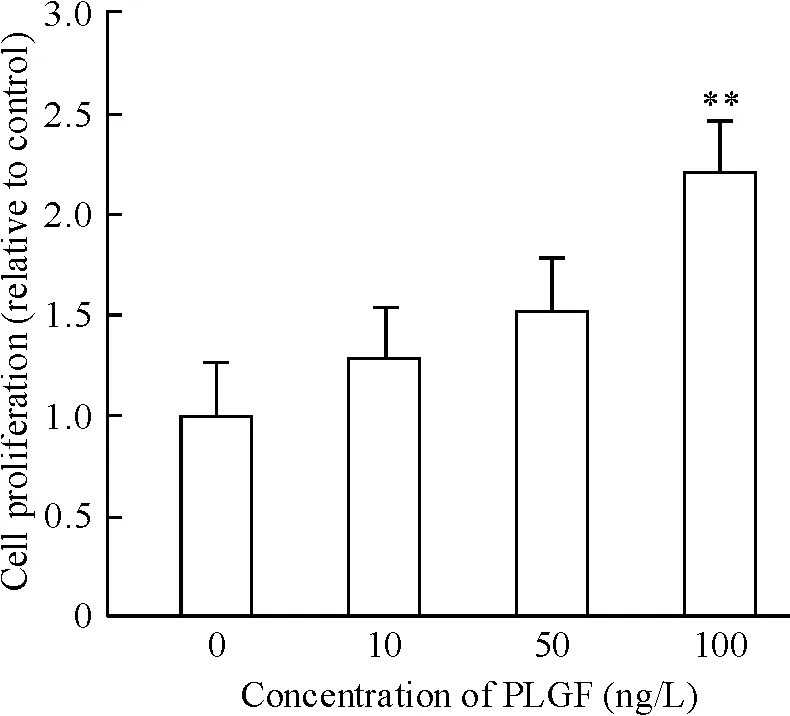
Figure 3. The proliferation of CFs treated with PLGF. Mean ±SD.n=5. **P <0.01 vs control (0 ng/L).图3 PLGF 对CFs 增殖的影响
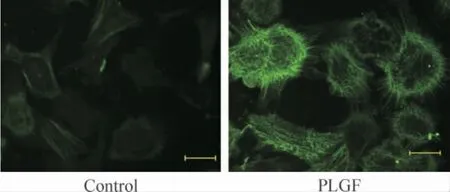
Figure 4. Effect of PLGF on α-SMA protein expression detected by immunofluorescence (×200).Bar:5 μm.图4 免疫荧光评价PLGF 对α-SMA 蛋白表达的影响

Figure 5. Effect of PLGF on α-SMA protein expression detected by Western blotting. 36C:36 h in control group;36P:36 h in PLGF group;48C:48 h in control group;48P:48 h in PLGF group.Mean ±SD. n =5.#P <0.05 vs 48C.图5 PLGF 对α-SMA 蛋白表达的影响
3 Anti-PLGF 对Ang II 诱导心脏成纤维细胞增殖的影响
用不同浓度(5、10、20 和30 μg/L)PLGF 抗体(anti-PLGF)干预成纤维细胞,结果显示浓度为20 μg/L 的anti-PLGF 抑制作用最明显,干预24 h 后,结果如图7 所示,Ang II 可以诱导细胞的增殖达2.23倍(P <0.05),Ang II 和anti-PLGF 联用后可明显抑制Ang II 诱导的细胞增殖(P <0.05)。上述结果提示anti-PLGF 可拮抗Ang II 诱导的成纤维细胞增殖效应。
4 Anti-PLGF 对Ang II 诱导α-SMA 表达影响
为探讨anti-PLGF(20 μg/L)对拮抗Ang II 诱导的成纤维细胞表型转化的影响,以Ang II 及anti-PLGF 同时干预成纤维细胞48 h,结果如图8 所示。Ang II 可增加α-SMA 的表达1.93 倍(P <0.05),anti-PLGF 可 拮抗AngII 诱 导 的α-SMA 表达(P <0.05)。结果提示anti-PLGF 可拮抗Ang II 诱导的成纤维细胞表型转化。
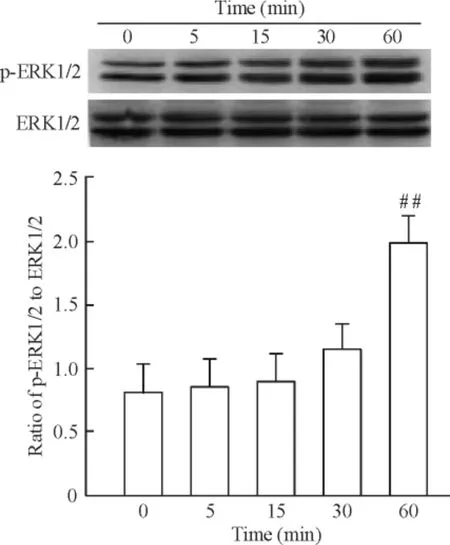
Figure 6. Effect of PLGF (100 μg/L)on the protein expression of p-ERK1/2 and ERK1/2 detected by Western blotting.Mean±SD.n=5. ##P <0.01 vs control (0 min).图6 PLGF 对p-ERK1/2 表达的影响
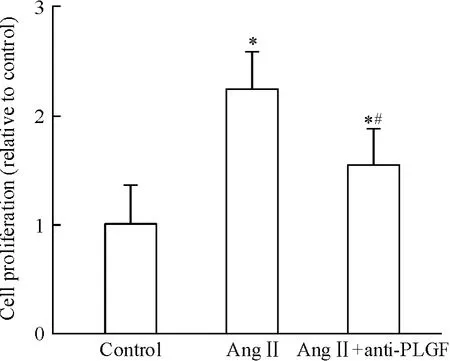
Figure 7. Effects of anti-PLGF and Ang II on the proliferation of CFs.Mean ± SD. n =5. * P <0.05 vs control;#P <0.05 vs Ang II.图7 Anti-PLGF 对Ang II 诱导细胞增殖的影响
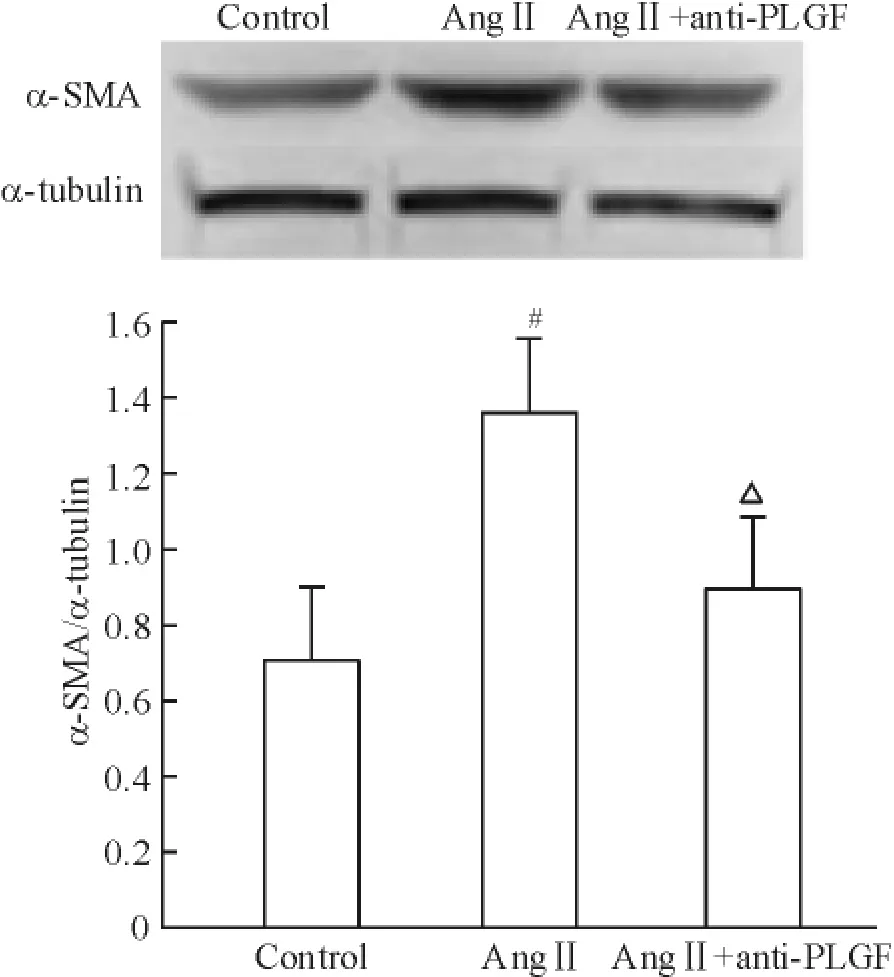
Figure 8. Effects of anti-PLGF on Ang II-induced α-SMA protein expression. Mean ± SD. n = 5. # P <0.05 vs control;△P <0.05 vs Ang II.图8 Anti-PLGF 对Ang II 诱导α-SMA 蛋白表达的影响
5 Anti-PLGF 对Ang II 诱导I 型和III 型胶原蛋白mRNA 表达的影响
Anti-PLGF(20 μg/L)和Ang II 共同干预SD 大鼠的心脏成纤维细胞30 h,结果如图9 所示。Ang II可增加I 型和III 型胶原蛋白的mRNA 表达分别为2.33 倍和2.47 倍(均P <0.05)。Anti-PLGF 可拮抗Ang II 诱导I 型和III 型胶原蛋白mRNA 表达上调(P <0.05)。
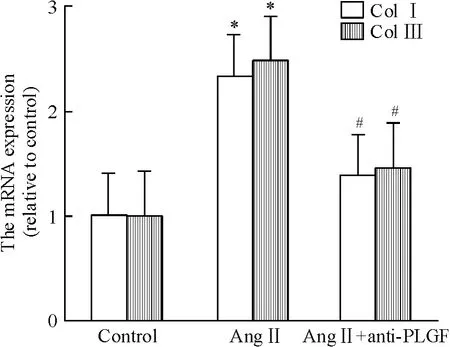
Figure 9. Collagen I and collagen III mRNA expression in various groups.Mean±SD.n=5. * P <0.05 vs control;#P <0.05 vs Ang II.图9 Anti-PLGF 对Ang II 诱导胶原蛋白mRNA 表达的影响
讨 论
本研究通过观察Ang II 对心脏成纤维细胞PLGF 表达的影响及后者对细胞表型转化、增殖和纤维化促进作用,以及给予anti-PLGF 阻断PLGF 后对Ang II 介导的成纤维细胞激活的抑制效应,探讨PLGF 参与Ang II 介导的心肌重构的可能机制。主要发现:(1)PLGF 可促进成纤维细胞增殖和表型转化,激活ERK1/2;(2)Ang II 可通过AT1受体诱导成纤维细胞PLGF 表达升高;(3)anti-PLGF 对Ang II 诱导的成纤维细胞增殖、表型转化及I 型和III 型胶原蛋白基因表达效应具有拮抗作用。
PLGF 是VEGF 家族成员之一,其碱基序列与血管内皮生长因子(vascular endothelial growth factor,VEGF)有高度的同源性。有研究表明,PLGF 在炎症反应和心肌重构等病理过程中可能具有重要作用。在主动脉缩窄诱导心脏负荷增加的小鼠模型中,心肌细胞内PLGF 的表达升高[5],同时PLGF 在心脏超负荷状态下,是肿瘤坏死因子α(tumor necrosis factor α,TNF-α)激活和巨噬细胞聚集的必需因子[6]。既往已有研究提示Ang II 可诱导VEGF 表达上调,同时激活血管炎症反应[7],并通过AT1受体调节细胞增殖、细胞因子的产生及一些疾病的病理过程如高血压、心脏的肥大及心脏纤维化等[1]。但有关PLGF在上述病理过程中的作用研究尚少,本研究结果提示,Ang II 可能通过AT1受体后水平,上调PLGF 在细胞中的表达,参与Ang II 介导的心血管疾病的病理过程。
PLGF 参与心血管重构的机制尚未完全阐明。研究表明,PLGF 可能通过破坏基质金属蛋白酶抑制因子3/肿瘤坏死因子α 转化酶轴的平衡等多种途径激活心脏的炎症反应,诱发或促进心肌重构[6,8]。本研究中,以PLGF 干预成纤维细胞后,细胞增殖明显,且成纤维细胞向肌成纤维细胞表型转化;同时短期给予PLGF 处理后,纤维化通路中的磷酸化ERK1/2 蛋白表达水平增高,而总ERK1/2 的表达水平无明显改变,提示PLGF 可能通过影响细胞ERK1/2 蛋白的磷酸化水平产生生物学效应。既往研究证实,磷酸化ERK1/2 水平增高后,可启动核内纤维化、增殖性相关基因的转录与表达,并成为心脏成纤维细胞趋化和增殖、胶原蛋白合成增加、心肌纤维化改变等效应的共同通路之一[9-10]。
细胞的炎症反应可诱导或加重心肌纤维化过程[11-12],大量研究证实,PLGF 可激活机体内巨噬细胞,促使白细胞介素6、TNF-α 和单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)表达升高,抑制其活性后可通过减少炎症反应,阻断疾病的进展[13-15]。
值得注意的是,尽管给予PLGF 干预细胞后,PLGF 本身对TGF-β、I 型和III 型胶原蛋白的mRNA 表达水平无显著影响,但用anti-PLGF 阻断PLGF 后可拮抗Ang II 诱导的成纤维细胞增殖和α-SMA 蛋白水平表达增加,同时降低Ang II 诱导I 型和III 型胶原蛋白mRNA 表达水平。最近,Van Steenkiste 等[16]关于肝纤维化的研究亦表明,PLGF 虽不能直接引起纤维化指标的显著改变,但抑制PLGF 活性可显著减少肝硬化小鼠肝纤维化及炎症反应严重程度。另一项有关肝纤维化的研究显示,anti-PLGF 干预或PLGF 基因敲除同样可拮抗二乙基亚硝胺或四氯化碳诱导的肝纤维化[17]。以上2 项在肝细胞中观察到的现象与本研究在心肌成纤维细胞中所观察的结果近似。产生这一现象的具体机制仍不清楚。有作者推测,在心脏处于超负荷状态下,机体内PLGF 与其受体Flt-1 可能通过激活心脏的炎症反应,使心肌纤维化信号转导通路中的ERK 或Akt 活性增加,最终导致心肌纤维化,这一效应可能需要病理状态下其它周围环境因素的协同作用[8]。我们推测Ang II 促细胞增殖及纤维化效应,可能部分需通过诱导PLGF 在心肌成纤维细胞中的表达而实现,这一过程发生于AT1 受体后水平。anti-PLGF 通过与PLGF 结合,抑制高浓度PLGF 对ERK1/2 的磷酸化效应,拮抗Ang II 的部分生物学效应。
综上所述,本研究提示Ang II 促进心脏成纤维细胞内PLGF 表达,PLGF 可能为Ang II 下游调节因子,可通过ERK 途径诱导细胞增殖及表型转化,anti-PLGF 可拮抗Ang II 诱导的细胞增殖、表型转化及I型和III 型胶原蛋白mRNA 的上调。PLGF 参与了Ang II 诱导的心肌重构过程。
[1] Pan P,Fu H,Zhang L,et al. Angiotensin II upregulates the expression of placental growth factor in human vascular endothelial cells and smooth muscle cells[J]. BMC Cell Biol,2010,11:36.
[2] Nakamura T,Funayama H,Kubo N,et al. Elevation of plasma placental growth factor in the patients with ischemic cardiomyopathy[J]. Int J Cardiol,2009,131(2):186-191.
[3] Turner NA. Therapeutic regulation of cardiac fibroblast function:targeting stress-activated protein kinase pathways[J]. Future Cardiol,2011,7(5):673-691.
[4] Motomura Y,Kanbayashi H,Khan WI,et al. The gene transfer of soluble VEGF type I receptor (Flt-1)attenuates peritoneal fibrosis formation in mice but not soluble TGF-β type II receptor gene transfer[J]. Am J Physiol Gastrointest Liver Physiol,2005,288(1):G143-G150.
[5] Accornero F,van Berlo JH,Benard MJ,et al. Placental growth factor regulates cardiac adaptation and hypertrophy through a paracrine mechanism[J]. Circ Res,2011,109(3):272-280.
[6] Carnevale D,Cifelli G,Mascio G,et al. Placental growth factor regulates cardiac inflammation through the tissue inhibitor of metalloproteinases-3/tumor necrosis factor-αconverting enzyme axis:crucial role for adaptive cardiac remodeling during cardiac pressure overload[J]. Circulation,2011,124(12):1337-1350.
[7] Zhao Q,Ishibashi M,Hiasa K,et al. Essential role of vascular endothelial growth factor in angiotensin II-induced vascular inflammation and remodeling[J]. Hypertension,2004,44(3):264-270.
[8] Carnevale D,Lembo G. Placental growth factor and cardiac inflammation[J]. Trends Cardiovasc Med,2012,22(8):209-212.
[9] Li L,Fan D,Wang C,et al. Angiotensin II increases periostin expression via Ras/p38 MAPK/CREB and ERK1/2/TGF-β1 pathways in cardiac fibroblasts[J].Cardiovasc Res,2011,91(1):80-89.
[10]Eliceiri BP,Klemke R,Strömblad S,et al. Integrin αvβ3 requirement for sustained mitogen-activated protein kinase activity during angiogenesis[J]. J Cell Biol,1998,140(5):1255-1263.
[11]敖杰男,冯慧娟,吴 迪,等.炎症细胞因子的心力衰竭发病过程中的作用[J]. 中国病理生理杂志2005,21(10):2062-2064.
[12]Liu Y,Liao Y,Cheng X,et al. TGF-β1of cardiac tissue and ventricular remodeling in rats with acute myocardial infarction[J]. Chin J Pathophysiol,2005,21(12):2305-2309.
[13]Yoo SA,Yoon HJ,Kim HS,et al. Role of placenta growth factor and its receptor flt-1 in rheumatoid inflammation:a link between angiogenesis and inflammation[J].Arthritis Rheum,2009,60(2):345-354.
[14]Luttun A,Tjwa M,Moons L,et al. Revascularization of ischemic tissues by PlGF treatment,and inhibition of tumor angiogenesis,arthritis and atherosclerosis by anti-Flt1[J]. Nat Med,2002,8(8):831-840.
[15] Markovic' M,Ignjatovic' S,Dajak M,et al. Placental growth factor as short-term predicting biomarker in acute coronary syndrome patients with non-ST elevation myocardial infarction[J]. South Med J,2010,103(10):982-987.
[16]Van Steenkiste C,Ribera J,Geerts A,et al. Inhibition of placental growth factor activity reduces the severity of fibrosis,inflammation,and portal hypertension in cirrhotic mice[J]. Hepatology,2011,53(5):1629-1640.
[17] Heindryckx F,Bogaerts E,Coulon SH,et al. Inhibition of the placental growth factor decreases burden of cholangiocarcinoma and hepatocellular carcinoma in a transgenic mouse model[J]. Eur J Gastroenterol Hepatol,2012,24(9):1020-1032.
