去氢骆驼蓬碱诱导HepG2细胞凋亡并增强其对5-氟尿嘧啶和顺铂的敏感性*
2013-10-25曹明溶刘志龙蒋建伟
李 强, 曹明溶△, 刘志龙, 蒋建伟
(暨南大学 1附属第一医院普通外科, 2医学院生物化学教研室,广东 广州 510632)
去氢骆驼蓬碱诱导HepG2细胞凋亡并增强其对5-氟尿嘧啶和顺铂的敏感性*
李 强1, 曹明溶1△, 刘志龙1, 蒋建伟2
(暨南大学1附属第一医院普通外科,2医学院生物化学教研室,广东 广州 510632)
目的研究去氢骆驼蓬碱体外诱导HepG2细胞凋亡过程中c-Jun N末端激酶(JNK)途径的作用,并观察其联合化疗药物对HepG2细胞的影响。方法CCK-8法检测联合或不联合使用JNK特异性抑制剂SP600125对细胞增殖的抑制作用;克隆形成实验观察不同浓度药物对细胞克隆形成的影响;Hoechst 33258染色法观察细胞形态变化;PI单染检测细胞亚二倍体率;Annexin V-PI双染测定细胞早期凋亡水平;Western blotting检测细胞聚(ADP-核糖)聚合酶(PARP)、JNK和p-JNK蛋白表达的改变;联合5-氟尿嘧啶(5-FU)或顺铂(DDP)观察细胞对化疗药物的敏感性。结果去氢骆驼蓬碱随药物浓度的升高而抑制作用增强,48 h后IC50为9.80 mg/L;去氢骆驼蓬碱能显著抑制细胞克隆形成,并且导致细胞凋亡形态学变化;PI单染检测发现细胞周期的G1期前有亚二倍体凋亡峰,Annexin V-PI 双染检测细胞出现明显的早期凋亡细胞群;Western blotting检测到随着去氢骆驼蓬碱浓度增加PARP及p-JNK蛋白表达增加,JNK蛋白表达减少;联合使用SP600125对细胞增殖的抑制作用减弱;联合5-FU或顺铂明显增强化疗药物对肿瘤细胞的抑制作用,增敏倍数分别为1.47和5.78倍。结论去氢骆驼蓬碱对HepG2细胞有增殖抑制作用,并诱导其凋亡,激活JNK信号通路可能是其主要机制之一;同时去氢骆驼蓬碱可以增强HepG2细胞对5-FU和顺铂的敏感性。
去氢骆驼蓬碱; HepG2细胞; c-Jun N末端激酶; 细胞凋亡
近年来研究发现,去氢骆驼蓬碱(harmine)可以通过人肝癌HepG2细胞发生G2/M期阻滞,并通过启动线粒体途径诱导HepG2细胞凋亡[1],发挥抗肝癌作用。本文观察去氢骆驼蓬碱诱导HepG2细胞凋亡的作用,探讨c-Jun N末端激酶(c-Jun N-terminal kinase,JNK)信号转导途径在细胞凋亡中的作用。
材 料 和 方 法
1主要材料和仪器
HepG2细胞由暨南大学生物化学教研室刘誉教授惠赠。去氢骆驼蓬碱纯度为99.8%,棕色小瓶装,购自西安飞达生物有限公司。DMSO、胰蛋白酶和Hoechst 33258均购自Sigma。新生牛血清购自杭州四季青生物工程材料有限公司。RPMI-1640培养液购自Gibco。Annexin V-PI双染试剂盒购自北京宝赛生物技术公司。CCK-8购自日本同仁化学研究所。SP600125(JNK抑制剂)及聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]、JNK和p-JNK抗体购自Cell Signal。
2方法
2.1细胞培养 HepG2细胞用含10%新生牛血清的RPMI-1640培养基,置37 ℃、5% CO2细胞培养箱常规培养,每3 d传代1次,细胞贴壁达到80%时,以0.25%胰酶消化传代。
2.2CCK-8法检测细胞增殖抑制率 取对数生长期的细胞(5×107/L),接种于96孔培养板,每孔100 μL,置37 ℃、5% CO2培养箱24 h后加药,设细胞对照组、DMSO对照组(浓度为0.1%)和去氢骆驼蓬碱各组(终浓度为0.625、1.25、2.5、5、10、20 mg/L),每组设5个复孔,置37 ℃、5% CO2培养箱培养48 h后,每孔加入10 μL CCK-8 试剂,继续培养1 h,酶标仪检测吸光度(A570),按下列公式求增殖抑制率,增殖抑制率(% ) = (1-A实验组/A对照组) ×100%,该实验重复3次。
2.3克隆形成抑制实验 在对数生长期,将细胞悬液调成300 cells/well接种于12孔培养板,置37 ℃、5% CO2培养箱24 h后加药,设细胞对照组、DMSO对照组(浓度为0.1%)和去氢骆驼蓬碱各组(终浓度为0.625、1.25、2.5、5 mg/L),每组设2个复孔,置37 ℃、5%CO2培养箱培养,7 d后,吸去培养液,PBS洗涤2次,甲醇∶冰醋酸(3∶1)固定液固定10 min后晾干,结晶紫染色15 min后流水冲洗,倒置显微镜下计数细胞克隆(>20个细胞记1个克隆)并拍照。
2.4Hoechst 33258染色观察凋亡细胞形态学变化 在对数生长期,将细胞悬液调成1.0×104/L接种于6孔培养板,每组设2个复孔,置37 ℃、5% CO2培养箱24 h后加药,设细胞对照组、DMSO对照组(浓度为0.1%)和去氢骆驼蓬碱组(5 mg/L),继续培养48 h后消化收集细胞,PBS重悬细胞,取250 μL细胞悬液涂片,室温自然干燥,用甲醇∶冰醋酸(3∶1)固定液固定20 min,用Hoechst 33258 染色工作液(10 mg/L)避光染色10 min,流水冲脱,荧光显微镜观察并拍照。
2.5PI单染和Annexin V-PI双染实验 在对数生长期,将细胞悬液调成1.0×107/L接种于12孔培养板,2 mL/well,每组设2个复孔,置37 ℃、5% CO2培养箱24 h后加药,设细胞对照组、DMSO对照组(浓度为0.1%)和去氢骆驼蓬碱各组(终浓度为5、10和20 mg/L),继续培养48 h后按照试剂盒步骤消化收集细胞,上机检测,BD FAC Sort Cell Quest 软件分析处理结果。
2.6Western blotting检测蛋白变化 收集6孔板(对照组和去氢骆驼蓬碱处理组细胞),冷PBS洗2次,在孔板内加入细胞裂解液冰上裂解10 min,离心,吸取上清,BCA法测蛋白浓度。取适量蛋白,用12%聚丙烯酰胺凝胶电泳分离蛋白质,电泳后电转至PVDF膜(恒压100 V,转膜1.5~2 h),印迹膜在含有5%脱脂牛奶的TBS-T缓冲液中封闭2 h,GAPDH (1∶4 000)、PARP、JNK和p-JNK(1∶1 000)Ⅰ抗孵育过夜,洗涤,Ⅱ抗(1∶3 000)孵育1 h,ECL发光液孵育后,X光片感光定影,扫描纪录。
2.7CCK-8法检测联合使用SP600125细胞增殖抑制率 取对数生长期的细胞,5×107/L接种于96孔培养板,每孔100 μL,置37 ℃、5% CO2培养箱24 h后加药,设细胞对照组、DMSO组(浓度为0.1%)和SP600125组(浓度为10 μmol/L)、去氢骆驼蓬碱组(终浓度2.5 mg/L)和SP600125与去氢骆驼蓬碱联合使用组,每组设5个复孔。SP600125预处理细胞1 h后,加入药物,培养48 h,CCK-8法检测各孔的吸光度,并计算增殖抑制率。
2.8药物敏感实验 取对数生长期的细胞,5.0×107/L,取100 μL接种于96孔培养板内,设5个复孔,置37 ℃、5% CO2培养箱24 h后加药。对不同药物的实验都分为4组:细胞对照组、化疗药物组、去氢骆驼蓬碱组和化疗药物与去氢骆驼蓬碱联合使用组。培养48 h,CCK-8法检测各孔的吸光度,计算各组抑制率及IC50。去氢骆驼蓬碱终浓度为2.5 mg/L,顺铂和5-氟尿嘧啶(5-fluorouracil,5-FU)终浓度均为1.25、2.5、5和10.0 mg/L。化疗增敏倍数=单用时化疗药物IC50/联合用药时化疗药物IC50。并采用金正均Q值法判断化疗药物与去氢骆驼蓬碱联合使用的效果:Q=Ea+b/(Ea+Eb-Ea×Eb),Ea和Eb分别为单用去氢骆驼蓬碱和单用化疗药物的抑制率,Ea+b为合并用药的抑制率。式中分子代表“实测合并效应”,分母是“期望合并效应”,Q值是两者之比,Q<0.85为拮抗作用,0.85≤Q<1.15为相加作用,Q≥1.15为协同作用。
3统计学处理
计量资料以均数±标准差(mean±SD)表示,SPSS 13.0统计软件处理,采用完全随机设计的单因素方差分析(One-way ANOVA)分析组间差异的显着性,以P<0.05为差异有统计学意义。
结 果
1去氢骆驼蓬碱对HepG2细胞增殖抑制作用
不同浓度去氢骆驼蓬碱作用于细胞48 h后,与对照组相比出现增殖抑制作用,去氢骆驼蓬碱为1.25 mg/L时,差异有统计学意义(P<0.05),IC50为9.80 mg/L,空白组与DMSO组相比无显著差异(P>0.05)。随着去氢骆驼蓬碱浓度的增加,细胞的增殖抑制越明显,表明去氢骆驼蓬碱以剂量依赖的方式抑制HepG2细胞的增殖,见图1。不同浓度去氢骆驼蓬碱作用细胞7 d后,与对照组相比较克隆形成数量明显减少,且克隆逐渐变小,去氢骆驼蓬碱浓度为1.25 mg/L时,即产生明显的克隆形成抑制作用,当浓度达到5 mg/L时,基本无克隆细胞株形成,见图2。
2去氢骆驼蓬碱诱导HepG2细胞凋亡
Hoechst 33258染色可见,去氢骆驼蓬碱组细胞核固缩、边聚、裂解、凋亡小体形成等凋亡形态学变化,见图3。不同浓度去氢骆驼蓬碱作用细胞48 h后,用Annexin V-PI双染流式细胞仪检测细胞早期凋亡率,随着去氢骆驼蓬碱浓度增加,早期凋亡率明显增加,各组的早期凋亡率分别为:(7.12±0.21)%、(7.23±0.35)%、(20.07±0.46)%、(31.75±0.24)%和(63.91±0.67)%,见图4A;同时实验组细胞出现明显的亚二倍体凋亡峰,随着去氢骆驼蓬碱浓度的增大,HepG2细胞的亚二倍体百分率增加,各组的亚二倍体率分别为:(5.23±0.11)%、(4.57±0.45)%、(10.67±0.36)%、(18.75±0.76)%和(21.35±0.77)%,见图4B。
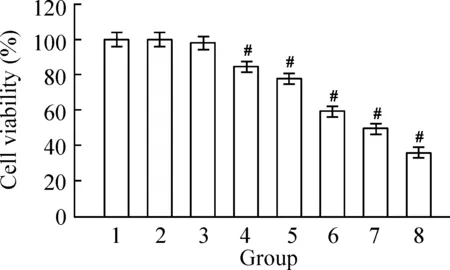
Figure 1. Effect of harmine on the proliferation of HepG2 cells determined by CCK-8 assay. 1: control; 2: DMSO; 3~8: 0.625, 1.25, 2.5, 5, 10 and 20 mg/L harmine, respectively. Mean±SD.n=3.#P<0.05vs1 or 2.
图1CCK-8法检测去氢骆驼蓬碱对细胞存活率的影响
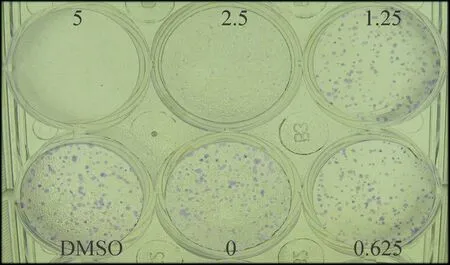
Figure 2. Colony formation assay was used to evaluate the effects of harmine on the proliferation of HepG2 cells. HepG2 cells were treated with 0.625, 1.25, 2.5 and 5 mg/L harmine for 7 d.
图2克隆形成实验观察去氢骆驼蓬碱对细胞增殖的抑制作用

Figure 3. Harmine-induced apoptosis of HepG2 cells assessed by Hoechst 33258 staining (×200). Morphology of HepG2 cells exposed to harmine at different concentrations was observed under fluorescence microscope.A:DMSO;B:0 mg/L harmine;C:5 mg/L harmine.
图3Hoechst33258染色观察细胞形态学变化
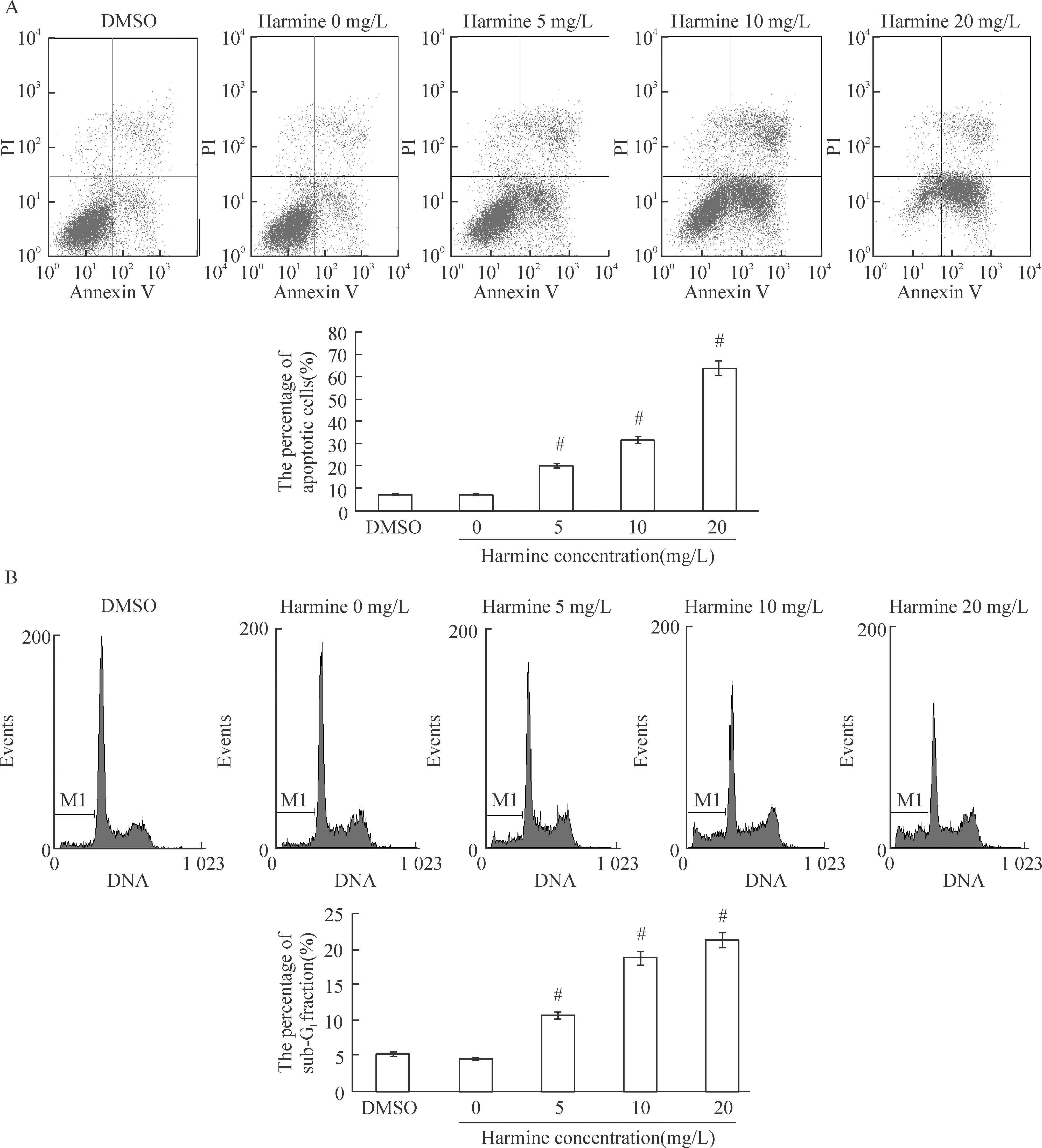
Figure 4. Apoptosis of HEG2 cells detected by flow cytometry.A:Annexin V-FITC/PI staining,B:sub-G1fraction.Mean±SD.n=3.#P<0.05vsDMSO or 0 mg/L harmine.
图4流式细胞术检测细胞凋亡
3Westernblotting检测PARP、JNK和p-JNK蛋白的表达
Western blotting检测去氢骆驼蓬碱作用于HepG2细胞48 h后,PARP和p-JNK蛋白随去氢骆驼蓬碱浓度增加而增加,JNK蛋白量减少,见图5。
4CCK-8检测联合SP600125对细胞增殖抑制率的影响
与空白组比较,JNK单独作用不对细胞产生增殖抑制作用,SP600125预处理细胞1 h后,加入去氢骆驼蓬碱48 h后,细胞存活率增加,见图6。
5药物敏感性实验
5.15-FU单用或与去氢骆驼蓬碱联用HepG2的增殖抑制作用 单独5-FU作用细胞48 h,IC50为7.12 mg/L,与2.5 mg/L去氢骆驼蓬碱联合作用后,IC50为4.86 mg/L,增敏倍数为1.47。其中1.25 mg/L 5-FU与2.5 mg/L去氢骆驼蓬碱联合为协同作用,Q值为1.23,见表1。

Figure 5. The effect of harmine on the protein expression evaluated by Western blotting.
图5Westernblotting检测HepG2细胞PARP、JNK和p-JNK蛋白的表达
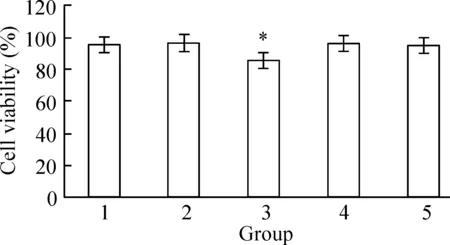
Figure 6. Effects of harmine (HAM) and SP600125 on HepG2 cell viability. 1:DMSO group; 2:control group; 3: 2.5 mg/L HAM group; 4:SP600125 group; 5:2.5 mg/L HAM+SP600125 group.Mean±SD.n=3.*P<0.05vsDMSO or control group.
图6JNK特异性抑制剂对HepG2细胞增殖抑制的影响
表15-FU联合2.5mg/L去氢骆驼蓬碱对HepG2细胞增殖的抑制作用
Table 1. Effects of HAM in combination with 5-FU on HepG2 cell growth inhibition(mean±SD.n=3)
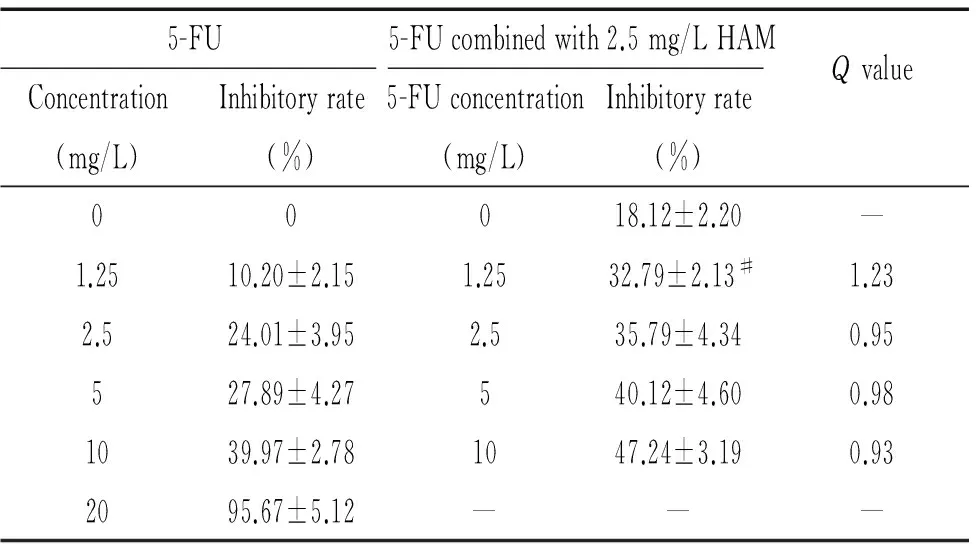
5-FU5-FUcombinedwith2.5mg/LHAMQvalueConcentration(mg/L)Inhibitoryrate(%)5-FUconcentration(mg/L)Inhibitoryrate(%)00018.12±2.20—1.2510.20±2.151.2532.79±2.13#1.232.524.01±3.952.535.79±4.340.95527.89±4.27540.12±4.600.981039.97±2.781047.24±3.190.932095.67±5.12———
#P<0.05vs1.25 mg/L 5-FU alone.
5.2顺铂单用或与去氢骆驼蓬碱联用HepG2的增殖抑制作用 单独顺铂作用细胞48 h,IC50为14.67 mg/L,与2.5 mg/L去氢骆驼蓬碱联合作用后,IC50为2.54 mg/L,增敏倍数为5.78。其中1.25 mg/L顺铂与2.5 mg/L去氢骆驼蓬碱联合为协同作用,Q值为1.17,见表2。
表2顺铂联合2.5mg/L去氢骆驼蓬碱对HepG2细胞增殖的抑制作用
Table 2. Effects of HAM in combination with cisplatin on HepG2 cell growth inhibition(mean±SD.n=3)

CisplatinCisplatincombinedwith2.5mg/LHAMQvalueConcentration(mg/L)Inhibitoryrate(%)Cisplatinconcentration(mg/L)Inhibitoryrate(%)00018.12±2.20—1.2530.97±4.151.2550.78±3.53#1.172.546.51±5.052.554.27±6.740.97560.96±7.27567.25±5.660.991067.40±6.581070.78±4.390.962090.86±7.12———
#P<0.05vs1.25 mg/L cisplatin alone.
讨 论
骆驼蓬属(Peganum)植物为蒺藜科多年生草本植物,具有坚固筋脉、助阳暖阴、消除黏稠体液等功能,主治筋脉软弱、骨关节痛、神昏头痛等症[2-3]。骆驼蓬植物的主要化学成分为生物碱,主要包括骆驼蓬碱(harmaline)、去氢骆驼蓬碱和哈尔满碱(harman)。去氢骆驼蓬碱是其中的主要有效成分之一,别名为哈尔明碱、肉叶云香碱,是淡黄色针状晶体,分子量为236.7,分子式为C13H12N2O,它在骆驼蓬种子中的含量高、结构稳定且具有肯定的抗肿瘤作用。从80年代早期开始,国内就对骆驼蓬碱类化合物抗肿瘤活性及毒性展开了临床研究,其中以去氢骆驼蓬碱的抗肿瘤作用最强,体外实验发现,去氢骆驼蓬碱对宫颈癌HeLa细胞、胃癌MGC-803和HGC27细胞、肝癌BEL-7402细胞、鼻咽癌CNE2细胞、人胰腺癌AsPC1细胞、白血病K562细胞、小鼠结肠癌Colon26细胞等多种体外培养的肿瘤细胞有明显的抑制作用[4-9]。在体内抗肿瘤活性方面,去氢骆驼蓬碱对S-180小鼠、网织细胞肉瘤L2和小鼠肝癌都有显著疗效,与顺铂、阿霉素联用有明显协同作用。在临床上骆驼蓬粗提物用于治疗未手术或不宜手术的恶性肿瘤,取得了较好的临床效果[10-11]。
近来研究表明,肿瘤是细胞增殖过度和分化异常的疾病,也是凋亡异常的疾病,通过诱导肿瘤细胞使其重新恢复凋亡,更加符合人体生理性细胞死亡过程,可以明显减轻或消除化疗药物所导致的毒副作用,是一种有效的抗癌途径。目前化疗药物种类繁多,但都不可避免产生很多毒副作用,比如骨髓抑制、脱发、神经毒性等等[12-13]。许多抗癌药物的作用机理都与它们诱导肿瘤细胞的凋亡有关[14-15]。在本实验中CCK-8及克隆形成实验结果表明去氢骆驼蓬碱可有效抑制HepG2细胞的增殖生长,其抑制细胞增殖的作用随药物浓度升高而增强,表现出剂量依赖性,当药物浓度为1.25 mg/L时,细胞克隆数明显减少并减小。Hoechst 33258染色观察可见明显核固缩、边聚、裂解、凋亡小体形成等细胞凋亡形态学变化。进一步流式细胞术可见随药物浓度增加,早期凋亡细胞和亚二倍体细胞群明显增加,亦呈浓度依赖性。结果表明,去氢骆驼蓬碱可抑制HepG2细胞增殖,诱导其凋亡。
PARP是DNA修复酶,作为caspase-3的作用底物,所以PARP又被称为死亡底物,PARP蛋白的剪切是细胞凋亡的标志。随着药物浓度增加,PARP蛋白表达逐渐增加。在我们前期研究中发现去氢骆驼蓬碱活化caspase-3诱导HepG2细胞的凋亡,caspase-3作为细胞凋亡的执行因子,受多种信号转导通路的调控。JNK也被称为压力激活的蛋白激酶(stress-activated protein kinase, SAPK),作为丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族中的重要成员,是细胞内重要的信号转导通路之一[16-17]。JNK通过其氨基酸残基端的磷酸化而活化,一旦被激活,胞浆中的JNK转位到细胞核,对转录因子c-Jun、活化转录因子2(activating transcription factor 2,ATF2)等磷酸化促进新蛋白质的合成或引起细胞凋亡。本研究中发现去氢骆驼蓬碱可以诱导JNK信号通路活化,使p-JNK蛋白表达随药物浓度增加明显上调。应用特异性JNK阻断剂SP600125,预处理HepG2细胞后则能够显著降低该药对HepG2细胞的增殖活性。去氢骆驼蓬碱,说明去氢骆驼蓬碱可能通过线粒体通路诱导细胞凋亡,JNK位于caspase-3的上游,但SP600125并不能完全阻断caspase-3和PARP活化,说明去氢骆驼蓬碱可能通过其它通路诱导细胞凋亡,要阐明所有参与去氢骆驼蓬碱诱导HepG2细胞凋亡反应的信号转导通路,尚需进一步相关研究。
5-FU和顺铂都是目前常用的化疗药物,但毒副作用大,导致病人常常难以耐受。在体外实验中我们发现,去氢骆驼蓬碱与5-FU和顺铂联合作用,后者IC50较单独使用时明显降低,增敏倍数分别为1.47和5.78,与去氢骆驼蓬碱合用时,计算出Q值大于1.15,表明两者合用有协同抗肿瘤作用。肝癌对化疗药物反应不敏感,且容易产生耐药性,今后可以进一步研究协同效应机制,并用荷肝癌动物模型验证,期望临床上联合中药化疗可以减轻毒副作用,提高化疗效果。
[1] Cao MR, Li Q, Liu ZL, et al. Harmine induces apoptosis of HepG2 cells via mitochondrial signaling pathway[J]. Hepatobiliary Pancreat Dis Int, 2011, 10(6):599-604.
[2] 程雪梅,刘玉琴,谢惠定,等.骆驼蓬属植物种子中去氢骆驼蓬碱和骆驼蓬碱的HPLC-荧光检测法测定[J]. 中国药学工业杂志,2008,39(6):443-446.
[3] 赵 婷,王长虹,王峥涛.骆驼蓬属植物中生物碱类化学成分及其药理活性研究进展[J].国际药学研究杂志,2010,37(5):333-338.
[4] 王长虹,程雪梅,刘忠渊,等.骆驼蓬种子提取物及其β咔保啉生物碱对DNA拓扑异构酶II活性的抑制作用[J]. 中国临床药理学杂志,2008,24(5):422-425.
[5] 王锦军,张秀梅,罗 磊.去氢骆驼蓬碱体外抗消化道肿瘤活性和对小鼠脾细胞增殖反应的抑制作用[J]. 中国现代应用药学杂志,2008,25(7):607-608.
[6] 刘俊玲,乌庆超,范传波,等.去氢骆驼蓬碱诱导白血病细胞凋亡的实验研究[J].中国中医药科技,2011,18(3):202-203.
[7] 宋震亚,刘济仁,陆新良,等.去氢骆驼蓬碱诱导人胃腺癌SGC-7901细胞凋亡[J].中药材,2006,29(6):571-573.
[8] 郭 亮,孙 洁,范文玺,等.去氢骆驼蓬碱衍生物的合成和抗肿瘤活性研究[J].中国现代应用药学,2012,29(5):385-388.
[9] Jahaniani F, Ebrahimi SA, Rahbar-Roshandel N, et al. Xanthomicrol is the main cytotoxic component of Dracocephalum kotschyii and a potential anti-cancer agent[J]. Phytochemistry, 2005, 66(13): 1581-1592.
[10] 陈维良,朱爱军,杜昆泽,等.去氢骆驼蓬碱脂质体的制备和体外释放特性[J].抗感染药学,2012,9(4):268-272.
[11] 丁志荣,滕 亮,戴秀勇,等.盐酸去氢骆驼蓬碱乳膏处方筛选及其止痒药效学研究[J]. 中成药,2010,32(5):753-757.
[12] Chau GY, Lui WY, Tsay SH, et al. Postresectional adjuvant intraportal chemotherapy in patients with hepatocellular carcinoma: a case-control study[J]. Ann Surg Oncol, 2006, 13(10): 1329-1337.
[13] 徐小平,陈兴华,卜 瑞.骆驼蓬总碱对孕鼠胚胎期胎鼠生长发育的影响[J]. 陕西中医学院学报,2009,32(2):53-57.
[14] Lah JJ, Cui W, Hu KQ. Effects and mechanisms of silibinin on human hepatoma cell lines[J]. World J Gastroenterol, 2007, 13(40): 5299-5305.
[15] Edderkaoui M, Odinokova I, Ohno I, et al. Ellagic acid induces apoptosis through inhibition of nuclear factor κB in pancreatic cancer cells[J]. World J Gastroenterol, 2008, 14(23): 3672-3680.
[16] 李素芳,林 森,张幼怡,等.p38 MAPK参与千金藤素诱导的心肌细胞凋亡[J].中国病理生理杂志,2011,27(4):638-642.
[17] 蔡清清,林天歆,范新兰,等.13-MTD通过激活MAPK途径和抑制Akt存活途径诱导乳腺癌MCF-7细胞凋亡[J].中国病理生理杂志,2009,25(5):873-876.
HarmineinducesapoptosisofHepG2cellsviaJNKsignalingpathwayandenhancestheirchemosensitivityto5-fluorouracilandcisplatin
LI Qiang1, CAO Ming-rong1, LIU Zhi-long1, JIANG Jian-wei2
(1DepartmentofGeneralSurgery,theFirstAffiliatedHospital,2DepartmentofBiochemistry,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:tcaomr@jnu.edu.cn)
AIM: To investigate the proliferation-inhibitory and apoptosis-inducing effects of harmine on human hepatocarcinoma HepG2 cells.METHODSThe proliferation of HepG2 cells was determined in the absence or presence of a JNK inhibitor SP600125 by Cell Counting Kit-8 (CCK-8) assay and colony formation test. The morphology of HepG2 cells was observed by Hoechst 33258 staining under fluorescence microscope. The cell apoptosis was analyzed by Annexin V-PI staining. The expression of apoptosis-regulated proteins,poly(ADP-ribose) polymerase (PARP),c-Jun N-terminal kinase (JNK) and p-JNK, was detected by Western blotting. The sensitizing effects of harmine on HepG2 cells to chemotherapeutic drugs 5-fluorouracil (5-FU) and cisplatin were determined by CCK-8 assay.RESULTSHarmine inhibited the proliferation of HepG2 cells and induced apoptosis in a dose-dependent manner. After the JNK signaling pathway was blocked by SP600125, the cell apoptotic rate decreased significantly. Hoechst 33258 staining revealed that the nuclear fragmentation, chromosomal condensation, cell shrinkage and attachment loss appeared in the HepG2 cells treated with harmine. The percentage of the sub-G1fraction was increased and the population of early apoptotic cell death was observed. Apoptosis of HepG2 cells with harmine treatment was associated with the activation of JNK. Combined with harmine, the IC50values of 5-FU and cisplatin for the tumor cells were 1.47 and 5.78 times sensitized as compared with the correspon-ding single drug treatment groups, respectively.CONCLUSIONHarmine exhibits an anti-proliferative effect on HepG2 cells by inducing apoptosis. The JNK signaling pathway is involved in the apoptosis of HepG2 cells. Harmine enhances the chemosensitivity of the cells to 5-FU and cisplatin.
Harmine; HepG2 cells; c-Jun N-terminal kinase; Apoptosis
R735.7
A
10.3969/j.issn.1000- 4718.2013.02.017
1000-4718(2013)02-0284-06
2012-10-15
2012-11-19
广东省科技计划(No.2010B031600248);广东省中医药管理局基金资助项目(No.20122114)
△通讯作者 Tel: 020-38688108; E-mail: tcaomr@jnu.edu.cn
