NOD8对LPS诱导巨噬细胞释放NO、TNF-α和IL-1β的影响*
2013-10-24郑媛媛胡巢凤
田 莉, 郑媛媛, 胡巢凤, 颜 亮
(暨南大学医学院病理生理学系,国家中医药管理局重点实验室,广东 广州 510632)
NOD8对LPS诱导巨噬细胞释放NO、TNF-α和IL-1β的影响*
田 莉▲, 郑媛媛▲, 胡巢凤△, 颜 亮
(暨南大学医学院病理生理学系,国家中医药管理局重点实验室,广东 广州 510632)
目的探讨NOD8对脂多糖(LPS)诱导巨噬细胞释放一氧化氮(NO)、肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)的影响。方法pEGFP-C2及pEGFP-NOD8重组质粒分别转染小鼠巨噬细胞RAW264.7,以LPS刺激RAW264.7细胞0、6、12、24 h后,采用Griess reagent法测定观察细胞分泌的NO水平;ELISA法检测IL-1β 和 TNF-α 的含量;荧光法测定活化的caspase-1水平; Western blotting检测NOD8蛋白表达及NF-κB p65亚基的核转位情况。结果(1)与转染pEGFP-C2空质粒组比较,转染pEGFP-NOD8质粒组NOD8蛋白表达明显增加。(2) LPS刺激6、12、24 h后,RAW264.7细胞释放NO、IL-1β及TNF-α均明显增加;而在pEGFP-NOD8+LPS组RAW264.7细胞, NO于12、24 h 的释放显著降低,IL-1β于6、12、24 h的释放也明显降低,TNF-α的释放则无明显变化。(3)在LPS刺激6、12、24 h后, RAW264.7细胞caspase-1活化水平均明显升高,胞浆NF-κB p65亚基表达明显减少,表明p65核转位增加;而pEGFP-NOD8+LPS组可显著抑制caspase-1的活化以及NF-κB p65亚基的核转位,差异有统计学意义。结论NOD8可抑制LPS诱导的巨噬细胞NO与IL-1β释放,其作用机制可能与NOD8抑制caspase-1及NF-κB 的活化有关。
RAW264.7细胞; 脂多糖类; NOD8蛋白; 核因子κB; 一氧化氮; 白细胞介素1β
哺乳动物的免疫系统是由固有免疫和适应性免疫组成,两者之间通过相互影响、相互作用,共同高效率地消除机体感染的病原体微生物[1]。其中,固有免疫是机体抵御病原微生物感染的第一道防线,可以识别病原微生物在漫长的进化过程中共同的、高度保守的结构即病原体相关分子模式,可以识别它们的受体为模式识别受体[2]。NOD样受体(NOD-like receptors, NLRs)为胞浆内的模式识别受体。各种炎症细胞尤其是巨噬细胞通过识别受体释放促炎介质,导致炎症反应[3]。脂多糖(lipopolysaccharide, LPS)刺激巨噬细胞产生的促炎因子在炎症反应中发挥重要作用。白细胞介素-1β(interleukin-1β, IL-1β)是介导炎症反应的一种主要促炎因子;肿瘤坏死因子α(tumor necrosis factor α, TNF-α)是炎症反应过程中最早和初级内源性介质;一氧化氮(nitric oxide,NO)是一种生物信使分子, 其生成依赖于诱导型一氧化化氮合酶(inducible nitric oxide synthase , iNOS), 在抵抗入侵的细菌、真菌等微生物及在炎症反应中起着十分重要的作用[3-4]。众所周知,促炎症介质的释放主要是由NF-κB通路调控,NF-κB在调节炎症和免疫反应时发挥极重要的作用。
目前在人类已发现20多个NLRs家族成员,NLRs家族成员的结构域主要有3个:中央的核苷酸结合区域(nucleotide-binding domain, NBD; 又称为NOD区域)、C末端富含亮氨酸的重复序列(leucine-rich repeats, LRRs)及N末端的介导嗜同种蛋白-蛋白相互作用区域——caspase 募集区域(caspase recruitment domain, CARD)或pyrin区域(pyrin domain, PYD)[5]。NOD8与该家族的其它成员不同的是,由PYD结构域和NOD结构域组成, C末端缺乏作为配体识别区域的LRRs[6-8]。Imamura等[7]构建NOD8及炎症相关因子重组质粒, 共转染HEK293细胞,发现NOD8可抑 制由caspase-1 介 导 的IL-1β分 泌以及凋 亡 相 关斑 点 样 蛋 白(apoptosis-associated speck-like protein containing a CARD, ASC)介导的NF-κB的活化和细胞凋亡 。为进一步探讨NOD8在炎症反应中的作用, 本实验主要研究NOD8对LPS诱导巨噬细胞释放炎症因子的影响及可能机制。
材 料 和 方 法
1材料
质粒pEGFP-C2为本室保存;pEGFP-NOD8真核表达质粒由本课题组构建。小鼠巨噬细胞RAW264.7由南方医科大学惠赠。
2主要试剂
细胞转染所用的阳离子聚合物JetPRIME为Polyplus产品;DMEM细胞培养基、DPBS为Gibco产品;胎牛血清购自HyClone;细胞培养板为Corning Costar产品; BCA蛋白定量试剂盒为上海申能博彩生物公司产品;羊抗多克隆抗体购自Santa Cruz,兔抗多克隆单体购自CST,马抗羊IgG抗体和羊抗兔IgG抗体购自鼎国生物公司;小鼠IL-1β ELISA试剂盒(R&D);小鼠caspase-1检测试剂盒(Biovision);硝酸纤维素膜(Millipore);滤纸(Bio-Rad);考马斯蓝R-250、Tween-20、牛血清白蛋白、脱脂奶粉和SDA-PAGE凝胶配制试剂盒均购自南京碧云天公司;其它生化试剂均为进口分装或国产分析纯。
3主要方法
3.1细胞培养及重组质粒转染细胞 RAW264.7细胞采用含10%胎牛血清的DMEM高糖培养液,加入及1×105U/L青霉素和100 mg/L链霉素,在37 ℃、5% CO2条件下进行细胞培养及传代。RAW264.7细胞按5×107/L分别接种于24孔板内,待细胞生长至60%融合时进行转染。将该JetPRIME/DNA复合物加入培养板,上下轻摇混匀,然后放置于37 ℃、5% CO2培养箱培养。24 h后将培养板置于Olympus BX-51倒置荧光显微镜下,用488 nm波长紫外光激发,发射光波长为507 nm,观察绿色荧光蛋白的表达。
3.2Western blotting检测NOD8蛋白表达 收集转染的或未转染的RAW264.7细胞,用预冷的PBS洗3次,加入含100 g/L PMSF的细胞裂解液,冰上孵育30 min,离心15 min,收集上清。Bradford法检测蛋白浓度,5% 浓缩胶、10% 分离胶分离蛋白后,将蛋白通过电转移的方式转移至硝酸纤维薄膜上,用特异性抗体检测NOD8蛋白的表达,以GAPDH作为标准内参。结果用Bio-Rad图像分析仪进行分析。
3.3Griess reagent 法测定NO2-的浓度 实验分组:(1)阴性对照组(negative control, NC);(2) pEGFP-C2对照组;(3) pEGFP-NOD8+LPS组;(4) pEGFP-C2+ LPS组。根据NO溶解于水后可以形成亚硝酸盐的原理,测定培养基中亚硝酸盐(NO2-)的含量,可以间接反应细胞上清中NO的含量。将RAW264.7细胞以5×104cells/well 密度接种在24孔细胞培养板上,培养过夜后,做转染处理。在LPS刺激的0、6、12和24 h,分别提取各组的细胞上清液,检测细胞上清中NO2-的浓度。检测前将试剂从4 ℃冰箱中取出,置于室温平衡30 min。亚硝酸盐(nitrite)标准品梯度稀释用来绘制标准曲线。稀释的标准品以及待测细胞上清液均设3个复孔,按照操作说明书的步骤,测定酶标仪560 nm波长处吸光度(A)。根据标准曲线计算上清液中NO含量。
3.4ELISA法测定IL-1β和TNF-α含量 培养方法按3.1项,实验分组按3.3项,收集细胞上清液备用。将IL-1β及TNF-α试剂盒从冰箱中取出放置室温下平衡30 min。将标准品瞬时离心5 s,按照说明书,稀释冻干标准品,将标准品成比稀释为所需的浓度。按照IL-1β试剂盒的操作步骤,测量450 nm处的吸光度值;按照TNF-α试剂盒的说明,测量450 nm激发波长、570 nm发射波长处的吸光度值。处理数据,计算每一种样品3个孔A值的平均值,参照标准曲线,计算出各组不同时点细胞培养上清液中IL-1β和TNF-α的含量。
3.5荧光法测定活化的caspase-1水平 培养方法按3.1项,实验分组按3.3项,分别于 0 h、6 h、12 h、24 h消化、离心、收集各组细胞。用50 μL的细胞裂解液重悬细胞,冰上孵育10 min,然后加入96孔板中50 μL/well,依次加入含10 mmol/L DTT的2×Reaction Buffer 50 μL/well,1 mmol/L YVAD-AFC substrate 5 μL/well,然后置于37 ℃温箱孵育1~2 h,荧光酶标仪400 nm激发波长、505 nm发射波长下测定各孔的荧光值,计算每一种样品3个孔A值的平均值,将该值与对照组A值相比,计算出各组细胞样品中活化caspase-1的相对值。
3.6Western blotting检测巨噬细胞胞浆NF-κB亚基p65蛋白表达 按 3.5项分别收集各组不同时点的细胞,提取胞浆蛋白。胰酶消化收集细胞,用预冷的PBS清洗2次,细胞浆提取试剂I,漩涡混匀20 s,在冰上孵育10 min,再加入胞浆提取试剂II,4 ℃、16 000×g离心5 min,取上清,此提取物为胞浆成分,保存于-80 ℃备用,同时BCA测定蛋白浓度;Western blotting后续检测蛋白表达。
4统计学处理
用SPSS 13.0统计软件进行分析处理。计数资料数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1转染前后细胞状态
转染前及转染后24 h,倒置显微镜下观察RAW264.7细胞形态和数量上的变化。与转染前相比,转染后24 h内细胞的形态未发生明显变化,但细胞的数量增多,密度增大,见图1。
Figure 1. The cellular morphology before and after plasmids were transfected into RAW264.7 cells (×200). A: before transfection; B: 24 h after transfection.
图1质粒转染前和转染后24hRAW264.7细胞情况
2NOD8蛋白在RAW264.7细胞中的表达
Western blotting检测结果显示,pEGFP-NOD8转染组(0.0170±0.0019)与pEGFP-C2空质粒转染组(0.0080±0.0007)相比,NOD8 蛋白表达明显增加,差异有统计学意义,见图2。
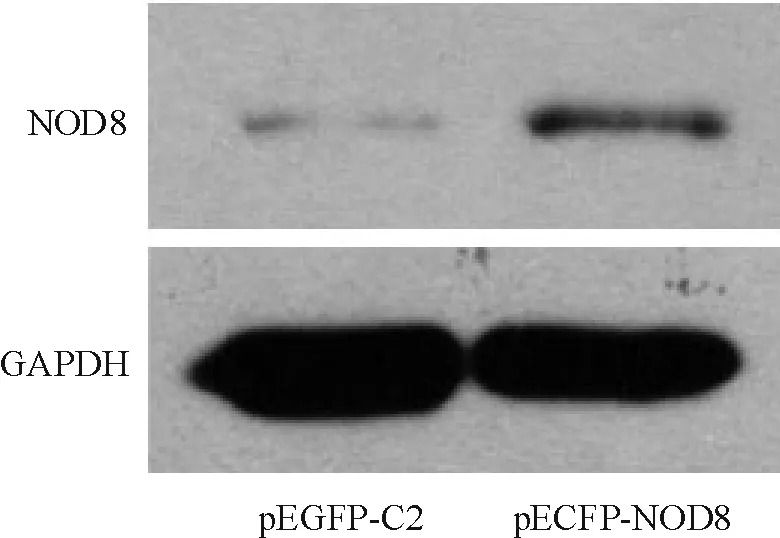
Figure 2. NOD8 protein expression detected by Western blotting analysis.
图2Westernblotting检测NOD8蛋白的表达
3过表达NOD8抑制LPS诱导的RAW264.7细胞NO释放
0、6、12及24 h,阴性对照组和pEGFP-C2对照组有少量NO释放,而pEGFP-C2+LPS组随着时间的延长,NO的释放量逐渐升高,在24 h时NO的释放量可达到(34.14±1.01)μmol/L。与pEGFP-C2+LPS组相比,pEGFP-NOD8+LPS组在6 h NO的释放量无明显变化(P>0.05),在12 h 和24 h NO的释放量明显降低,差别有统计学意义,见图3。

Figure 3. Effect of NOD8 on the release of NO in LPS-stimulated RAW264.7 cells. Mean±SD.n=3.##P<0.01vsNC;**P<0.01vspEGFP-C2+LPS at the same time points.
图3NOD8对LPS诱导RAW264.7细胞释放NO的影响
4过表达NOD8抑制LPS诱导的RAW264.7细胞IL-1β释放
0、6、12、24 h,阴性对照组和pEGFP-C2对照组细胞上清中IL-1β的含量无明显变化,而pEGFP-C2+LPS组随时间的增加,IL-1β的浓度逐渐升高。与pEGFP-C2+LPS组相比,pEGFP-NOD8+LPS组在6 h、12 h 和24 h IL-1β的释放量均明显降低,差别有统计学意义,见图4。
5过表达NOD8对LPS诱导RAW264.7细胞释放TNF-α的影响
随着时间的增加,阴性对照组和pEGFP-C2对照组细胞上清TNF-α的含量并无明显增加,而pEGFP-C2+LPS组在6、12和24 h TNF-α释放量均显著增加, 各时点TNF-α的释放量无明显差异。pEGFP-NOD8+LPS组与pEGFP-C2+LPS组相比,6、12、24 h TNF-α浓度无明显变化,差别无统计学意义(P>0.05),见图5。
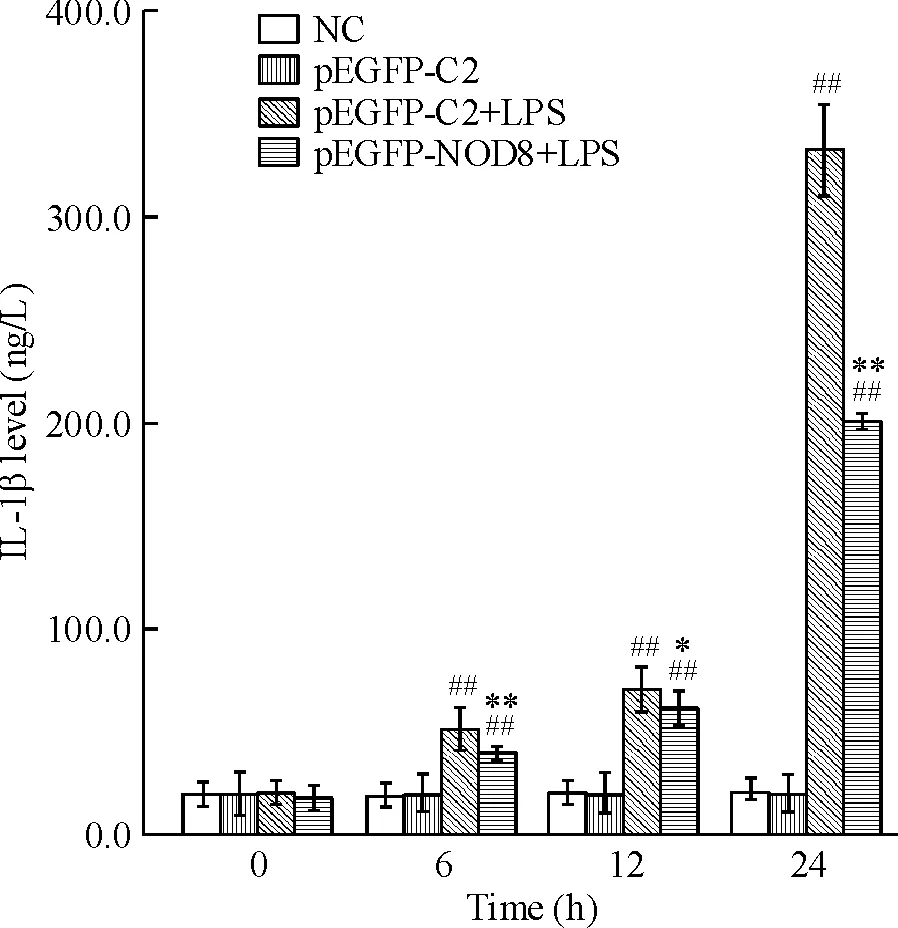
Figure 4. Effect of NOD8 on the production of IL-1β in LPS-stimulated RAW264.7 cells. Mean±SD.n=3.##P<0.01vsNC;*P<0.05,**P<0.01vspEGFP-C2+LPS at the same time points.
图4NOD8对LPS诱导RAW264.7细胞释放IL-1β的影响
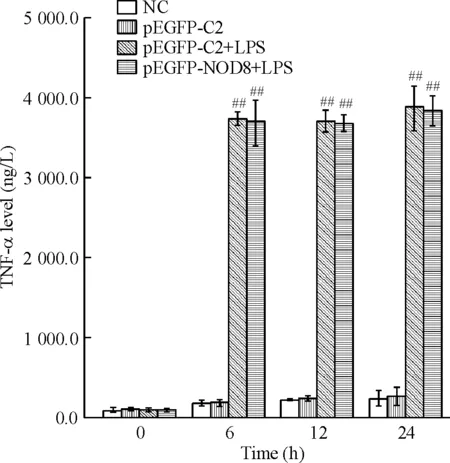
Figure 5. Effect of NOD8 on the release of TNF-α in LPS-stimulated RAW264.7 cells. Mean±SD.n=3.##P<0.01vsNC.
图5NOD8对LPS诱导RAW264.7细胞释放TNF-α的影响
6过表达NOD8抑制LPS诱导的RAW264.7细胞caspase-1的活化
LPS刺激RAW264.7细胞6、12、24 h后caspase-1活化水平均明显升高;与pEGFP-C2+LPS组相比,pEGFP-NOD8+LPS组caspase-1活化水平在各时点均显著下降,且呈时间依赖性。而阴性对照组和pEGFP-C2对照组caspase-1活化水平在各时点无显著差异(P>0.05),见图6。

Figure 6. Effect of NOD8 on the activation of caspase-1 in LPS-induced RAW264.7 cells. Mean±SD.n=3.##P<0.01vsNC at the same time points;*P<0.05,**P<0.01vspEGFP-C2+LPS at the same time points.
图6NOD8对LPS诱导RAW264.7细胞caspase-1活化水平的影响
7过表达NOD8抑制LPS诱导的RAW264.7细胞p65核转位
Western blotting结果表明,正常情况下,p65主要存在于胞浆内; LPS刺激后,胞浆中的p65的蛋白表达在6、12和24 h逐渐减少,且呈时间依赖性。与pEGFP-C2+LPS组相比,pEGFP-NOD8+LPS组胞浆内的p65表达在6、12和24 h不断增加,并呈时间依赖性。这说明NOD8可抑制LPS诱导的RAW264.7细胞 p65核转位(P<0.01),见图7。
讨 论
近年来文献报道有NLRs家族参与固有免疫、抵御病原体感染[9]。NLRs主要分布在胞浆内识别病原体相关分子模式和内源性分子[5, 10-14]。近年发现大部分NLRs可通过识别微生物,激活其信号转导通路,募集吞噬细胞、导致炎症介质的产生以及调控获得性免疫反应。其中NOD1和NOD2分别识别细菌肽聚糖结构和胞壁酰二肽,诱导NF-κB的激活[6]。NLRs家族大部分成员具有促炎作用,但是近年来的研究表明NLRs家族部分成员起抗炎作用[15]。有报道指出,NLRP7可以抑制caspase-1介导的IL-1β加工,NLRP2可以抑制ASC介导的NF-κB的激活[16]。最近有研究表明NOD8转基因小鼠受到鼠伤寒沙门菌感染时,IL-1β的表达并不增加[7]。对NOD8抗炎作用及机制的研究将为炎症性疾病的防治开辟广阔前景。
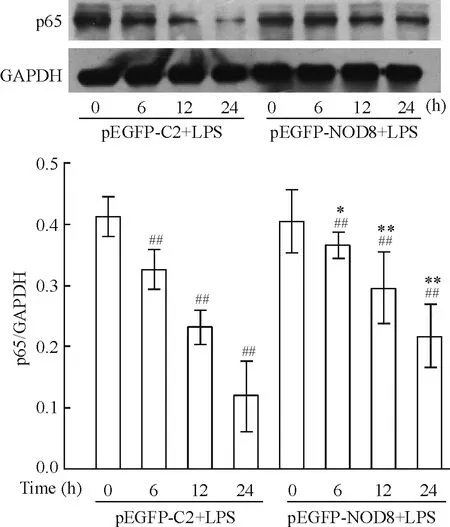
Figure 7. Effect of NOD8 on p65 protein expression in cytoplasm of RAW264.7 cells detected by Western blotting. Mean±SD.n=3.*P<0.05,**P<0.01vspEGFP-C2+LPS at the same time points;##P<0.01vspEGFP-C+LPS (0 h).
图7Westernblotting检测NOD8对LPS诱导RAW264.7细胞胞浆p65表达的影响
LPS作为炎症的强激活剂,可激活巨噬细胞,活化的巨噬细胞可以产生大量炎症细胞因子如IL- 1β和TNF-α,引起iNOS 的表达增加,从而释放大量具有组织损伤毒性的自由基NO等,导致强烈的氧化应激反应最终造成细胞的凋亡和坏死[4]。本研究通过NOD8对LPS诱导巨噬细胞释放炎症因子的影响,来探讨NOD8在炎症中的作用。结果发现,LPS刺激6、12、24 h后,RAW264.7细胞释放NO、IL-1β 及TNF-α 均明显增加;而在pEGFP-NOD8+LPS组, NO于12 h、24 h 的释放显著降低; IL-1β于6、12、24 h的释放也明显减少;而TNF-α 的释放则无明显变化。从上述结果我们可以发现,与pEGFP-C2+LPS组相比,pEGFP-NOD8+LPS组NO于6 h 的分泌量并无降低,分析其原因可能在于NO早期释放较少。NOD8对TNF-α 的表达无显著影响,这一现象可能与NOD8发挥作用的途径有关。
通过构建NOD8和多种炎症因子的质粒共转染HEK293细胞后,发现 NOD8可以抑制caspase-1介导IL-1β的分泌和ASC-介导的NF-κB的活化和细胞凋亡[6]。进一步发现NOD8抑制caspase-1前体的催化活性是通过NOD结构域;NOD结构域通过抑制caspase-1前体的催化活性或caspase-1的自我寡聚化反应,抑制caspase-1的活化。另外,NOD8的PYD结构域可以抑制ASC介导的NF-κB的活化和细胞凋亡以及ASC增强caspase-1介导产生IL-1β的能力;NOD8的PYD结构域是ASC的一种生理抑制剂[17],其可能通过阻止ASC聚集抑制ASC的多种功能[7]。但NOD8不能抑制由星形孢菌素、Fas配体以及TNF-α诱导HEK293T-Y细胞的细胞凋亡[6];因此NOD8可能抑制caspase-1的活性和ASC介导的NF-κB激活及细胞凋亡而发挥抗炎活性。所以,我们接下来利用荧光检测法检测caspase-1的活化水平以及Western blotting检测核因子亚基p65的核转位,进一步探讨NOD8在巨噬细胞炎症中抑制炎症因子的可能相关机制。结果证实NOD8可以抑制LPS诱导的巨噬细胞caspase-1的活化,且呈时间依赖效应。LPS刺激巨噬细胞后,胞浆中的p65蛋白表达在6、12和24 h逐渐减少。而pEGFP-NOD8+LPS组胞浆内的p65表达与pEGFP-C2+LPS组相比,p65核转位在6、12、24 h逐渐减少,并呈时间依赖效应,说明NOD8可抑制LPS诱导RAW264.7细胞 p65核位移。综上所述,说明NOD8可抑制LPS诱导巨噬细胞释放NO和IL-1β,其作用机制可能是通过抑制caspase-1活化以及NF-κB p65亚基核转位,抑制NF-κB活化,从而减少巨噬细胞炎症因子的释放。随着对NOD8抗炎作用的深入研究,NOD8可作为炎症性疾病治疗的新靶点,将有助于预防和治疗炎症性疾病。
[1] Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition[J]. Int Immunol,2009,21(4):317-337.
[2] 席 琼,胡巢凤,张 芸,等. RIP2对大肠杆菌的抗菌作用研究[J]. 中国病理生理杂志,2011,27(5):951-955.
[3] Li F,Fu Y,Liu B, et al. Stevioside suppressed inflammatory cytokine secretion by downregulation of NF-κB and MAPK signaling pathways in LPS-stimulated RAW264.7 cells[J]. Inflammation,2012,35(5):1669-1675.
[4] Liu CL, Cheng L, Ko CH, et al. Bioassay-guided isolation of anti-inflammatory components from the root of Rehmannia glutinosa and its underlying mechanism via inhibition of iNOS pathway[J]. J Ethnopharmacol,2012,143(3):867-875.
[5] Inohara N, Chamaillard M, Mcdonald C, et al. NOD-LRR proteins: role in host-microbial interactions and inflammatory disease[J]. Annu Rev Biochem,2005,74:355-383.
[6] Wang Y, Hasegawa M, Imamura R, et al. PYNOD, a novel Apaf-1/CED4-like protein is an inhibitor of ASC and caspase-1[J]. Int Immunol,2004,16(6):777-786.
[7] Imamura R, Wang Y, Kinoshita T, et al. Anti-inflammatory activity of PYNOD and its mechanism in humans and mice[J]. J Immunol,2010,184(10):5874-5884.
[8] 曾 琪,张 芸,田 莉,等. P53结合位点对NOD8基因的调控[J]. 中国病理生理杂志,2011,27(12):2362-2367.
[9] Lich JD, Ting JP. CATERPILLER (NLR) family members as positive and negative regulators of inflammatory responses[J]. Proc Am Thorac Soc,2007,4(3):263-266.
[10] Fritz JH, Ferrero RL, Philpott DJ, et al. Nod-like proteins in immunity, inflammation and disease[J]. Nat Immunol,2006,7(12):1250-1257.
[11] Kanneganti TD, Lamkanfi M, Nunez G. Intracellular NOD-like receptors in host defense and disease[J]. Immunity,2007,27(4):549-559.
[12] Meylan E, Tschopp J, Karin M. Intracellular pattern recognition receptors in the host response[J]. Nature,2006,442(7098):39-44.
[13] Ting JP, Kastner DL, Hoffman HM. CATERPILLERs, pyrin and hereditary immunological disorders[J]. Nat Rev Immunol,2006,6(3):183-195.
[14] Yu HB, Finlay BB. The caspase-1 inflammasome: a pilot of innate immune responses[J]. Cell Host Microbe,2008,4(3):198-208.
[15] Hinds MG, Norton RS, Vaux DL, et al. Solution structure of a baculoviral inhibitor of apoptosis (IAP) repeat[J]. Nat Struct Biol,1999,6(7):648-651.
[16] Kinoshita T, Wang Y, Hasegawa M, et al. PYPAF3, a PYRIN-containing APAF-1-like protein, is a feedback regulator of caspase-1-dependent interleukin-1beta secretion[J]. J Biol Chem,2005,280(23):21720-21725.
[17] Dowds TA, Masumoto J, Chen FF, et al. Regulation of cryopyrin/Pypaf1 signaling by pyrin, the familial Mediterranean fever gene product[J]. Biochem Biophys Res Commun,2003,302(3):575-580.
EffectofNOD8onproductionofnitricoxide,IL-1βandTNF-αinLPS-treatedmacrophages
TIAN Li, ZHENG Yuan-yuan, HU Chao-feng, YAN Liang
(DepartmentofPathophysiology,KeyLaboratoryforStateAdministrationofTraditionalChineseMedicineofthePeople’sRepublicofChina,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:thcf@jnu.edu.cn)
AIM: To investigate the effect of NOD8 on lipopolysaccharide (LPS)-induced releases of nitric oxide (NO), tumor necrosis factor α (TNF-α) and interleukin-1β (IL-1β) in RAW264.7 cells.METHODSThe plasmids of pEGFP-C2 and pEGFP-NOD8 were transfected into RAW264.7 cells respectively. The transfected and non-transfected cells were stimulated by LPS for 0, 6, 12 and 24 h. NO production was evaluated by Griess reagent assay, and the levels of IL-1β and TNF-α were measured by ELISA. The protein expression of NOD8 and the nuclear translocation of nuclear factor κB (NF-κB) p65 subunit were detected by Western blotting. The level of activated caspase-1 was determined by fluorimetric method.RESULTSCompared with pEGFP-C2 group, the protein expression of NOD8 was significantly elevated in pEGFP-NOD8+LPS group. The releases of NO, IL-1β and TNF-α were obviously increased after RAW264.7 cells were treated with LPS for 6 h, 12 h and 24 h, and while the secretion of NO was significantly reduced in the cells transfected with pEGFP-NOD8 and induced by LPS for 12 h and 24 h, and the release of IL-1β was also significantly reduced at 6 h, 12 h and 24 h. However, no significant difference of TNF-α release was observed between pEGFP-C2+LPS group and pEGFP-NOD8+LPS group. The activation of caspase-1 in RAW264.7 cells stimulated with LPS for 6 h, 12 h and 24 h was markedly increased, and the expression of NF-κB p65 subunit in the cytoplasm was significantly decreased, indicating that p65 nuclear translocation was increased. In addition, the activation of caspase-1 and the nuclear translocation of p65 were significantly inhibited in pEGFP-NOD8+LPS group.CONCLUSIONNOD8 suppresses the releases of LPS-induced NO and IL-1β in RAW264.7 cells by inhibiting the activation of caspase-1 and NF-κB.
RAW264.7 cells; Lipopolysaccharides; NOD8 protein; Nuclear factor-kappa B; Nitric oxide; Interleukin-1β
R329.21
A
10.3969/j.issn.1000- 4718.2013.05.021
1000- 4718(2013)05- 0889- 06
2013- 01- 02
2013- 04- 10
广东省自然科学基金资助项目(No.S2012010008161);暨南大学“211工程”三期预研项目;广东省高等学校自然科学重点研究项目(No.05Z002)
△通讯作者 Tel: 020-85228079; E-mail: thcf@jnu.edu.cn
▲并列第1作者
