藤黄酸对弥漫性大B淋巴瘤细胞株OCI-LY-1增殖和凋亡的影响及其分子学机制*
2013-10-24师宪平蓝晓莹王文文温创宇黄美近刘焕亮
师宪平, 蓝晓莹, 陈 鑫, 王文文, 温创宇, 黄美近, 刘焕亮△
(1广州医学院免疫研究所,广东 广州 510182; 2中山大学附属第三医院血液内科,广东 广州 510630;中山大学 3胃肠病学研究所, 4附属第六医院,广东 广州 510655)
藤黄酸对弥漫性大B淋巴瘤细胞株OCI-LY-1增殖和凋亡的影响及其分子学机制*
师宪平1△, 蓝晓莹1, 陈 鑫1, 王文文2, 温创宇3,4, 黄美近4, 刘焕亮3,4△
(1广州医学院免疫研究所,广东 广州 510182;2中山大学附属第三医院血液内科,广东 广州 510630;中山大学3胃肠病学研究所,4附属第六医院,广东 广州 510655)
目的探讨藤黄酸对弥漫性大B淋巴瘤细胞增殖与凋亡的影响及其分子学机制,研究藤黄酸治疗弥漫性大B细胞淋巴瘤的潜在应用价值。方法用藤黄酸处理细胞,采用MTS法对淋巴瘤细胞进行细胞活力及增殖抑制测定;碘化丙啶(PI)单染荧光显微镜观察细胞形态改变;采用AnnexinⅤ-FTIC/PI流式细胞术检测细胞凋亡;利用Western blotting检测蛋白酶体系统相关蛋白(Ubs、Bax、HSP90和IκB-α)、凋亡相关蛋白(PARP、pro-caspase-3和caspase-8)及细胞增殖信号通路相关蛋白(ERK和STAT5)的变化情况。结果藤黄酸明显抑制OCI-LY-1细胞的增殖活性,诱导OCI-LY-1细胞呈凋亡趋势;随藤黄酸浓度升高,Ubs、Bax和HSP90表达升高;随藤黄酸浓度升高与作用时间延长,PARP切割、pro-caspase-3、pro-caspase-8、ERK、p-ERK、STAT5及p-STAT5表达下降。结论藤黄酸抑制弥漫性大B淋巴瘤细胞株的蛋白酶体活性,抑制细胞增殖,促进细胞凋亡。
弥漫性大B淋巴瘤; 藤黄酸; 蛋白酶体; 细胞增殖; 细胞凋亡
非霍奇金淋巴瘤(non-Hodgkin′s lymphoma, NHL)是目前发病率增长最快的淋巴瘤,其中弥漫性大B淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是最常见的NHL。DLBCL是大B型淋巴细胞弥漫性恶性增生性疾病,在最近的10~20年间发病率逐渐增加。DLBCL在西方国家占成人非霍奇金淋巴瘤30%~40%,在发展中国家高达60%。目前R-CHOP(美罗华,联合环磷酰胺,阿霉素度,长春新碱,强的松)被国际上公认为治疗侵袭性NHL的经典疗法,在治疗低度恶性NHL取得了良好的效果,然而在用药过程中产生了极大的耐药复发问题及并发症(支气管痉挛、心律失常、肝功能衰竭、低血药呼吸困难等),严重影响了治疗效果,迫切需要筛选出作用机制各异的活性化合物能够有效治疗NHL。
临床实验表明,蛋白酶体抑制剂对难治性和复发性淋巴造血系统恶性肿瘤有较好的疗效。蛋白酶体抑制剂是一种新型抗肿瘤药物,具有抑制肿瘤细胞生长,促进细胞凋亡,干扰细胞周期进程,提高肿瘤细胞对化疗和放疗的敏感性等作用。目前,已开发出多种蛋白酶体抑制剂,包括肽基醛类MG132、二肽硼酸类PS-341(bortezomib/velcade)等[1-2],均可抑制26S蛋白酶体活性,调节泛素-蛋白酶体系统(ubiquitin-proteasome system, Ups)功能。已有文献报道,PS-341联合化疗药物可提高某些不同亚型弥漫性大B细胞淋巴瘤对药物的反应[3]。
藤黄酸(gambogic acid,GA)是中药藤黄的主要活性成份,大量研究表明藤黄酸是一种多靶点的抗肿瘤药物,其在胃癌、肺癌、胰腺癌、肝癌、神经胶质瘤等实体肿瘤和血液系统恶性肿瘤中表现出强大的抗癌活性[4]。已有文献报道,藤黄酸与其它蛋白酶体抑制剂具有协同抑制蛋白酶体活性的作用[5]。研究表明,NK/T细胞淋巴瘤及NK/T淋巴瘤株HANK1细胞强表达泛素活化酶E1(ubiquitin activating enzyme 1, UBE1)[6],提示Ups功能亢进可能与NK/T细胞淋巴瘤的发生和发展有关。为此,我们对其它亚型的淋巴瘤细胞进行筛选,发现藤黄酸对弥漫性大B细胞淋巴瘤OCI-LY-1细胞的蛋白酶体活性有明显的抑制作用。本研究以弥漫性大B细胞淋巴瘤OCI-LY-1细胞株为研究模型,探讨藤黄酸对其Ups系统的调控作用,检测藤黄酸对细胞增殖和凋亡通路的影响,进而探讨藤黄酸治疗弥漫性大B细胞淋巴瘤的潜在应用价值。
材 料 和 方 法
1材料
弥漫性大B细胞淋巴瘤OCI-LY-1细胞由本实验室保存。RPMI-1640高糖培养基和胎牛血清Gibco。藤黄酸、MTS、碘化丙啶和细胞凋亡双染检测试剂盒,Tween-20与DMSO购自Sigma-Aldrich,抗pro-caspase-8、pro-caspase-3、p-ERK、ERK、Bax、热休克蛋白90(heat-shock protein 90,HSP90)及IκB-α为Cell Signaling产品,抗PRAP为BD产品,抗XIAP、Mcl-1、ubiquitin proteins(Ubs)抗体购自Santa Cruz,抗GAPDH、p-STAT5和STAT5抗体购自Upstate Technology,HRP-抗鼠/兔Ig抗体为Pierce Biotechnology产品。
2主要方法
2.1细胞培养 OCI-LY-1细胞用RPMI-1640(含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素)于37 ℃、5% CO2、饱和湿度条件下培养,实验所用的细胞均处于对数生长期。
2.2细胞活力检测实验 用MTS法测细胞活力抑制情况,设空白对照组、对照组和实验组;取对数生长期的OCI-LY-1细胞接种于96孔板,对照组和实验组每孔接种50 μL细胞悬液,共15 000个细胞,空白对照组加入100 μL不含细胞培养基,实验组每孔再加入50 μL含藤黄酸培养基,使加入终浓度为0.16、0.3125、0.625、1.25、2.5及5.0 μmol/L,对照组加入50 μL含血清的培养基,空白对照组不加,每组3个重复孔。不同剂量的藤黄酸作用44 h后于实验各孔分别加MTS试剂20 μL,37 ℃继续孵育4 h,于酶联免疫检测仪490 nm测定各孔的吸光度(A),细胞活力(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组),以浓度为横坐标,细胞活力为纵坐标绘制藤黄酸对OCI-LY-1细胞生长活力抑制率柱状图。
2.3PI单染法观察细胞学形态 取对数生长期细胞接种于24孔板,每孔接种1 mL细胞悬液,共2×105细胞,实验组加入终浓度为0.25、0.5及0.75 μmol/L藤黄酸,对照组不加药,置于37 ℃、5% CO2、饱和湿度细胞培养箱中培养,5 h后加入已过滤的PI染液(1∶100),在加药24 h后显微镜TRITC荧光通道拍照记录PI阳性细胞。当已死亡或濒临死亡的细胞膜完整性被破坏时,PI可以进入细胞核内与DNA双链结合,受激发后发出红色荧光,此类细胞记为阳性细胞。
2.4Annexin V/PI双标记法流式细胞术测定细胞凋亡 实验设有不同藤黄酸浓度处理组。计数细胞,2×108cells/L,收集细胞,1×binding buffer洗涤细胞后,Annexin V工作液100 μL室温避光孵育15 min,检测前每管加PI 1 μL上机。在双染流式细胞计数仪的散点图上,取右下象限和右上象限的总和(即Annexin V阳性细胞群)计为凋亡细胞。实验完全按照Sigma-Aldrich公司提供的试剂说明书操作,重复3次。
2.5Western blotting 不同时点和不同浓度的藤黄酸处理OCI-LY-1细胞后收集细胞,加入蛋白裂解液充分裂解细胞提取蛋白,Bio-Rad蛋白浓度试剂盒紫外分光750 nm波长定量蛋白浓度。100~130 V恒压电泳约90 min,100 V恒压转膜约90 min,5%牛奶室温封闭1 h,特异性Ⅰ抗4℃过夜次日曝光。
3统计学处理
用GraphPad Prism 4.0软件对数据进行分析,组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1GA对OCI-LY-1细胞活力及细胞形态学的影响
一定浓度的GA对OCI-LY-1细胞的生长有抑制作用,随着GA浓度增大,细胞出现空泡、破碎等形态学改变,同时细胞增长缓慢,可见大量死亡细胞。GA处理细胞44 h后,当GA剂量达0.08 μmol/L时细胞活力明显受到抑制(P<0.05),且GA对OCI-LY-1细胞的增殖抑制作用呈剂量依赖效应,见图1,GA对OCI-LY-1细胞生长的半数抑制浓度是0.20 μmol/L。不同剂量的GA处理24 h后对OCI-LY-1细胞具有明显的诱导死亡作用,见图2。
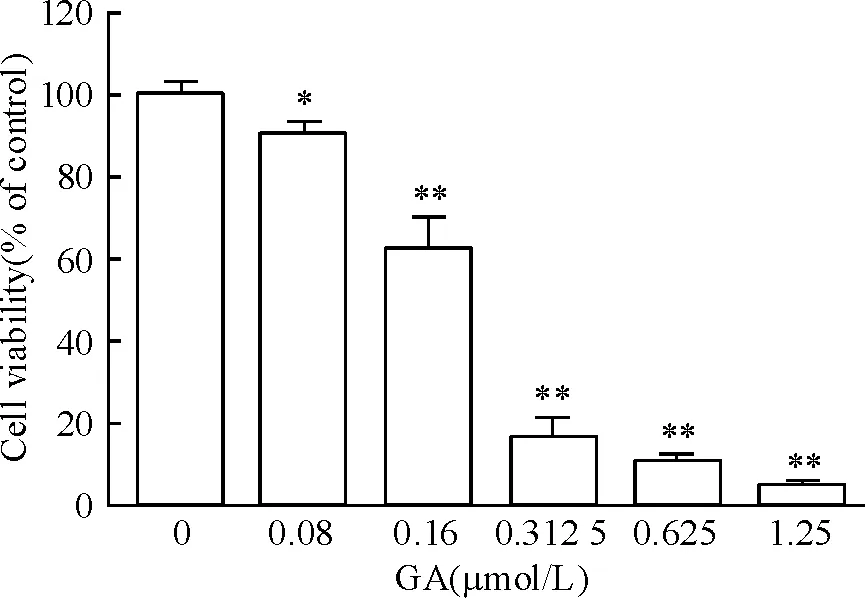
Figure 1. Effect of GA on cell viability of OCI-LY-1 cells.Mean±SD.n=6.*P<0.05,**P<0.01vs0 μmo/L.
图1GA对弥漫性大B淋巴瘤细胞株OCI-LY-1活力的影响

Figure 2. OCI-LY-1 cell death induced by GA for 24 h.
图2GA诱导24h后弥漫性大B淋巴瘤细胞株OCI-LY-1死亡
2GA对OCI-LY-1细胞凋亡的诱导
经不同浓度GA处理24 h后,当GA浓度达0.25 μmol/L时OCI-LY-1细胞凋亡率明显升高,GA诱导OCI-LY-1细胞凋亡作用呈剂量依赖效应,见图3,表明GA可以诱导OCI-LY-1细胞发生凋亡。
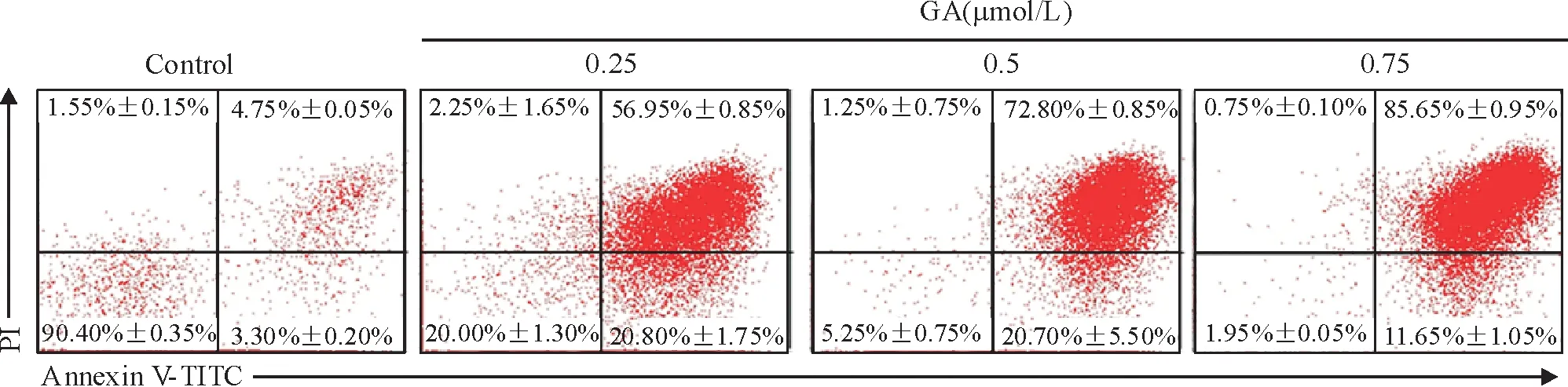
Figure 3. Apoptosis of OCI-LY-1 cells induced by GA for 24 h.
图3GA诱导24h后弥漫性大B淋巴瘤细胞株OCI-LY-1凋亡
3GA抑制OCI-LY-1细胞中泛素蛋白酶体系统的活性
图4显示,当GA浓度达0.25 μmol/L时,内源性泛素化蛋白Ubs表达增加(P<0.05),其底物蛋白HSP90的表达亦出现相应程度的提高(P<0.05),而当GA浓度达0.5 μmol/L时,Ubs的另一底物蛋白Bax表达也出现增加(P<0.01),GA诱导这些蛋白的表达增加呈剂量依赖效应。GA不影响Ubs的其中一底物蛋白IκB-α的表达。
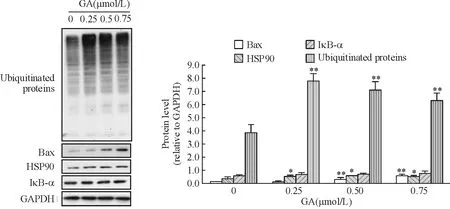
Figure 4. The expression of Ubs and the subtracts of OCI-LY-1 cells induced by GA for 6 h.Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L.
图4GA处理6h后上调弥漫性大B淋巴瘤细胞株OCI-LY-1泛素化蛋白及其底物的表达
4GA对凋亡相关蛋白表达的影响
图5结果显示,用不同浓度GA处理细胞24 h,当GA浓度达0.25 μmol/L时,PARP前体减少,出现切割带,同时引起caspase家族相关蛋白caspase-3及caspase-8前体减少,出现caspase-8切割带,且呈现GA浓度依赖性(P<0.01)。用0.75 μmol/L GA分别处理细胞6 h、12 h和24 h,于6 h时便出现PARP切割带,同时caspase-3及caspase-8前体减少,蛋白变化呈现时间依赖性(P<0.01)。
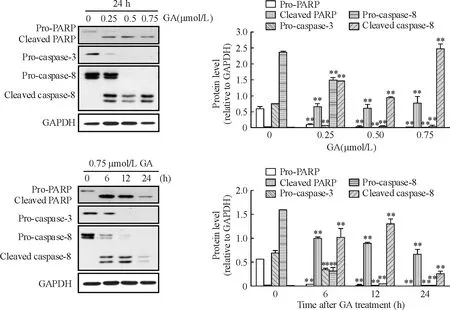
Figure 5. Effects of GA on the expression of apoptosis-related proteins PARP, pro-caspase-3 and pro-caspase-8 in OCI-LY-1 cells.Mean±SD.n= 3.**P<0.01vs0 μmol/L or 0 h.
图5GA对弥漫性大B淋巴瘤细胞株OCI-LY-1凋亡相关蛋白PARP、pro-caspase-3和pro-casepase-8表达的影响
5GA对细胞增殖信号通路的影响
图6显示,用不同浓度GA处理细胞24 h,当GA浓度达0.25 μmol/L时增殖相关蛋白ERK和STAT5磷酸化形式蛋白表达明显下降(P<0.01),而其总蛋白形式也有下降(P<0.05),且均呈现GA浓度依赖性。用0.75 μmol/L GA分别处理细胞6 h、12 h和24 h,于6 h时出现ERK和STAT5磷酸化形式蛋白表达明显下降(P<0.01),而其总蛋白形式也下降(P<0.05),且均呈现GA时间依赖性。
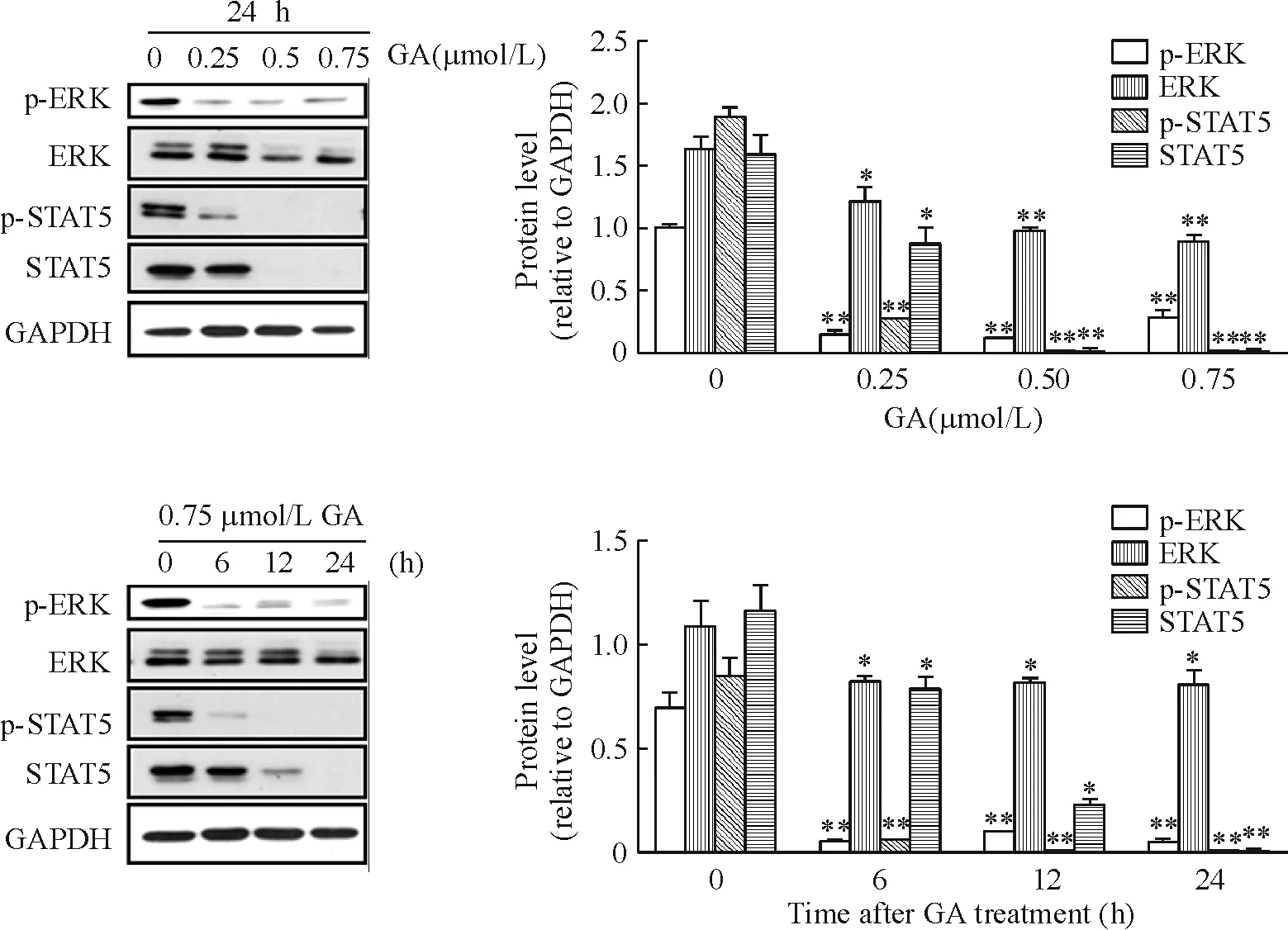
Figure 6. Effects of GA on the expression of proliferation-related proteins p-ERK, ERK, p-STAT5 and STAT5 in OCI-LY-1 cells.Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L or 0 h.
图6GA对弥漫性大B淋巴瘤细胞株OCI-LY-1增殖相关蛋白p-ERK、ERK、p-STAT5和STAT5表达的影响
讨 论
随着对肿瘤调控机制的深入研究,肿瘤治疗分子靶点的寻找已成为当今的发展方向[7]。近年发现,许多肿瘤和遗传性疾病的发生都与泛素蛋白酶体功能失调有关[8-10]。蛋白酶体抑制剂通过抑制肿瘤细胞内蛋白酶体活性来调节细胞周期,促进细胞凋亡。蛋白酶体抑制剂通过改变蛋白酶体的酶切位点抑制蛋白酶体活性,目前已成为免疫学、炎症及肿瘤学等领域的研究热点。已有不少文献报道,蛋白酶体抑制剂对恶性肿瘤具有治疗效果[11]。现已证实小分子蛋白酶体抑制剂PS-341对某些恶性血液系统疾病病具有良好的治疗效果,其中包括多发性骨髓瘤和淋巴瘤[12]。同时,蛋白酶体抑制剂对套细胞淋巴瘤的治疗亦有相当意义,尽管临床上作为化疗药物的使用仍未成功[13]。本文选取了弥漫性大B淋巴瘤细胞株OCI-LY-1为研究对象,探讨小分子化合物GA诱导细胞凋亡、抑制细胞增殖及其相关分子学机制。实验结果表明,GA能够诱导细胞凋亡,这可能与抑制细胞蛋白酶体系统的活性,诱导PARP切割,激活cspase-3和caspase-8相关。同时,GA的抑制细胞增殖效果可能是通过抑制JAKs/STATs和MEK/ERK信号转导通路的活化而产生。
实验证实GA明显抑制OCI-LY-1细胞生长并诱导细胞凋亡。MTS法显示,随着GA浓度增加,OCI-LY-1细胞的生长抑制率明显增加;Annexin V/PI双标记流式细胞术检测结果显示GA呈剂量依赖性诱导细胞凋亡;Western blotting检测显示内源性泛素化蛋白Ubs及其底物蛋白Bax、HSP90呈不同程度的增加;caspase-8与caspase-3前体pro-caspase-8与pro-caspase-3的表达均随GA浓度和作用时间的增加而减少,PARP也呈剂量与时间依赖性的切割,显示了caspase级联通路的活化。上述结果表明,GA能诱导弥漫性大B淋巴瘤细胞的凋亡,其可能机制是抑制了细胞蛋白酶体活性,使某些促凋亡蛋白例如Bax的表达水平增加,同时活化了caspase级联反应。JAKs/STATs和MEK/ERK信号转导通路与细胞的增殖、分化及凋亡关系密切,这些通路异常活化可导致细胞异常增殖和恶性转化[14],我们的结果显示,ERK和STAT5总体及磷酸化形式的蛋白表达水平均下调,提示了这些信号通路的活化受到GA的抑制,进而导致细胞增殖抑制。蛋白酶体系统的活性抑制如何激活caspase级联通路以及蛋白酶体系统的活性是否直接调控细胞增殖通路,是我们需要进一步探索的科学问题。
总之,GA可能通过调控蛋白酶体系统活性,下调凋亡相关蛋白表达及JAKs/STATs和MEK/ERK信号转导通路,从而明显抑制弥漫性大B淋巴瘤OCI-LY-1细胞生长,诱导其凋亡,对弥漫性大B淋巴瘤具有重要的治疗前景。
[1] Goy A, Younes A, Mclaughlin P, et al. Phase II study of proteasome inhibitor bortezomib in relapsed or refractory B-cell non-Hodgkin’s lymphoma[J]. J Clin Oncol,2005,23(4):667-675.
[2] 张志刚,莫祥兰,苏祖兰,等. 蛋白酶体抑制剂MG132对NK/T淋巴瘤细胞增殖、凋亡和细胞周期的影响[J]. 中国病理生理杂志,2009,25(12):2362-2365.
[3] Koprivnikar JL, Cheson BD. Bortezomib: a proteasome inhibitor with an evolving role in select subtypes of B-cell non-Hodgkin’s lymphoma[J]. Future Oncol,2012,8(4):359-371.
[4] Yang LJ, Chen Y, He J, et al. Effects of gambogic acid on the activation of caspase-3 and downregulation of SIRT1 in RPMI-8226 multiple myeloma cells via the accumulation of ROS[J]. Oncol Lett,2012,3(5):1159-1165.
[5] Huang H, Chen D, Li S, et al. Gambogic acid enhances proteasome inhibitor-induced anticancer activity[J]. Cancer Lett,2011,301(2):221-228.
[6] Su ZL, Mo XL, Feng ZY, et al.UBE1 expression in extranodal NK/T cell lymphoma, nasal type[J]. Leuk Lymphoma,2008,49(9):1821-1822.
[7] Weinstein IB, Begemann M, Zhou P, et al. Disorders in cell circuitry associated with multistage carcinogenesis: exploitable targets for cancer prevention and therapy[J]. Clin Cancer Res,1997,3(12 Pt 2):2696-2702.
[8] Mani A, Gelmann EP. The ubiquitin-proteasome pathway and its role in cancer[J]. J Clin Oncol,2005,23(21):4776-4789.
[9] 蔡同建,陈景元,李 妍,等. 蛋白酶体抑制剂MG132对PC12细胞的增殖抑制作用[J]. 第四军医大学学报,2006,27(12):1137-1139.
[10] 张卫国,吴清明,于皆平,等. 阻断泛素-蛋白酶体通路对食管癌细胞生长及端粒酶活性的影响[J]. 中国病理生理杂志,2004,20(7):1208-1212.
[11] 费正华,姜 藻. 蛋白酶体抑制剂药理基础与临床应用进展[J]. 中华现代内科学杂志,2006,3(11):1244-1246.
[12] Kuhn DJ, Orlowski RZ. The immunoproteasome as a target in hematologic malignancies[J]. Semin Hematol,2012,49(3):258-262.
[13] Holkova B, Grant S. Proteasome inhibitors in mantle cell lymphoma[J]. Best Pract Res Clin Haematol,2012,25(2):133-141.
[14] Rauch J, Moran-Jones K, Albrecht V, et al. c-Myc regulates RNA splicing of the A-Raf kinase and its activation of the ERK pathway[J]. Cancer Res,2011,71(13):4664-4674.
EffectofgambogicacidonproliferationandapoptosisofhumandiffuselargeB-celllymphomacelllineOCI-LY-1
SHI Xian-ping1, LAN Xiao-ying1, CHEN Xin1, WANG Wen-wen2, WEN Chuang-yu3, 4, HUANG Mei-jin4, LIU Huan-liang3,4
(1InstituteofImmunology,GuangzhouMedicalUniversity,Guangzhou510182,China;2DepartmentofHematology,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China;3InstituteofGastroenterology,4TheSixthAffiliatedHospital,SunYat-senUniversity,Guangzhou510655,China.E-mail:xianping_shi@gzhmc.edu.cn;huanliang.liu@gmail.com)
AIM: To investigate the effects of gambogic acid (GA) on the proliferation and apoptosis of human diffuse large B-cell lymphoma cells.METHODSDiffuse large B-cell lymphoma cell line OCI-LY-19 was treated with GA. The cell viability and proliferation were evaluated by MTS assay. The morphological changes of the cells were observed under inverted microscope and fluorescence microscope with PI staining. The cell apoptosis was detected by flow cytometry. The changes of proteasome-related proteins Ubs, Bax, HSP90 and IκB-α, the apoptosis-related proteins PARP, pro-caspase-3 and caspase-8, and the proliferation-associated molecules ERK and STAT5 were detected by Western blotting.RESULTSThe proliferation of OCI-LY-19 cells was inhibited and the apoptosis was induced by GA. The expression of Ubs, Bax and HSP90 was up-regulated by GA treatment in a dose-dependent manner. The PARP protein was cleaved. The levels of apoptosis-related proteins pro-caspase-3 and pro-caspase-8, and proliferation-associated molecules p-Akt, p-ERK and p-STAT5 were down-regulated by GA treatment in a dose- and time-dependent manner.CONCLUSIONGambogic acid down-regulates the activity of proteasome, inhibits cell proliferation and promotes cell apoptosis of diffuse large B cell lymphoma.
Diffuse large B-cell lymphoma; Gambogic acid; Proteasome; Cell proliferation; Apoptosis
R733.4
A
10.3969/j.issn.1000- 4718.2013.05.008
1000- 4718(2013)05- 0815- 06
2012- 12- 31
2013- 04- 08
国家自然科学基金资助项目(No. 81100378);广州市科信局应用基础研究专项重点项目(No. 2012J4100014);广东省医学科研基金(No. B2012159)
△通讯作者 师宪平Tel: 020-81340313; E-mail: xianping_shi@gzhmc.edu.cn;刘焕亮 Tel: 020-39443272; E-mail: huanliang.liu@gmail.com
