3-MA对急性坏死性胰腺炎大鼠肺损伤的保护作用
2013-10-19袁小凌刘洁陈卫昌
袁小凌 刘洁 陈卫昌
·短篇论著·
3-MA对急性坏死性胰腺炎大鼠肺损伤的保护作用
袁小凌 刘洁 陈卫昌
重症急性胰腺炎(severe acute pancreatitis,SAP)早期就可引起全身炎症反应综合征(SIRS),胰腺坏死进而并发多器官功能障碍(MODS)[1-2]。急性肺损伤(acute lung injury,ALI)是其中最常见的并发症,可迅速恶化演变为急性呼吸窘迫综合征(ARDS),成为SAP早期病死的主要原因。自噬在急性胰腺炎中的作用是近年来胰腺炎研究的新领域。然而在哺乳动物中关于自噬发生的机制尚不明确,其在急性胰腺炎肺损伤中的作用机制也不明确。本研究采用大鼠急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)模型观察自噬抑制剂3-甲基腺嘌呤(3-MA)对ANP并发的肺损伤的保护作用。
一、材料和方法
1.实验动物及分组:健康雄性Sprague-Dawley大鼠54只,体重200~250 g,购自苏州大学动物实验中心。按数字表法随机分成假手术组、ANP组、3-MA干预组,每组18只。采用改良的Aho法[3]制备ANP模型,即以0.1 ml/min的速度向胰胆管内逆行注入5%牛磺胆酸钠。3-MA组在建模前30 min腹腔注射3-MA 15 mg/kg体重(Sigma公司)。假手术组开腹翻动胰腺后即关腹。各组分别于术后3、6、12 h腹主动脉抽血,分离血清置-80℃保存,将大鼠处死,留取胰腺、肺组织,40 g/L甲醛固定。
2.血淀粉酶、IL-1β测定:血淀粉酶采用全自动生化分析仪检测。血IL-1β采用ELISA方法检测,试剂盒购自杭州联科生物公司,按试剂盒说明书操作。
3.胰腺、肺组织病理学检查:取固定的各组胰腺、肺组织标本,石蜡包埋,切片,HE染色,采用盲法由专科医师在光镜下阅片。
4.胰腺、肺组织Beclin-1检测:采用免疫组织化学法检测。兔抗鼠Beclin1抗体购自SANTA CRUZ公司,1∶200稀释,羊抗兔IgG-HRP购自北京博奥森生物公司。最后DAB显色、苏木素复染、脱水、透明、中性封片,显微镜观察。以胞质出现棕黄色颗粒细胞为阳性细胞,随机观察5个高倍视野,根据阳性细胞百分比和染色深度进行评估。阳性细胞:<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色深度:无染色0分,淡黄色1分,黄色2分,棕黄色3分。两分值相加为总评分。
5.统计学处理:使用SPSS17.0统计软件处理。数据以表示,多组间比较采用单因素方差分析(One Way ANOVA),与假手术组比较采用LSD-t检验。P<0.05为差异具有统计学意义。
二、结果
1.胰腺、肺组织病理学改变:假手术组大鼠胰腺、肺组织无明显变化。ANP组3 h时胰腺轻度充血水肿,点片状坏死及少量血性腹水,6 h时病理改变加重,12 h时胰腺大片坏死,出现大量皂化斑及血性腹水;镜下见胰腺腺泡水肿、腺泡结构破坏、消失,叶间隔、小叶间隔及腺泡间隔显著增宽,腺泡细胞不同程度变性坏死,周围出血,随时间的延长,病变呈进行性加重。ANP组大鼠均有不同程度肺水肿,肺表面散在出血点,胸腔少量积水,12 h有局部小片状紫褐色肺不张;镜下见肺泡及肺间质水肿,间质内红细胞和炎性细胞渗出,随时间延长加重,肺泡壁破裂,肺泡塌陷实变,大量炎性细胞浸润。3-MA处理组胰腺、肺组织病理变化较ANP组明显减轻(图1)。
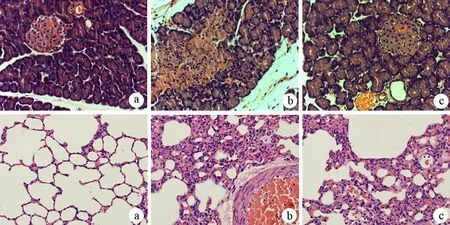
图1假手术组(a)、ANP组(b)、3-MA组(c)大鼠术后12 h的胰腺(上)、肺组织(下)病理学改变(HE ×400)
2.血淀粉酶、IL-1β水平变化:ANP组血淀粉酶、IL-1β水平随时间延长显著增高,较假手术组均显著升高。3-MA组血淀粉酶在6、12 h,IL-1β在3、6、12 h均较ANP显著降低,但仍显著高于假手术组(表1)。
3.胰腺及肺组织Beclin-1蛋白表达的变化: 假手术组胰腺组织仅少量腺泡细胞表达Beclin-1,肺组织仅少量肺泡间质细胞表达Beclin-1。ANP组各时点胰腺及肺组织Beclin-1蛋白表达明显升高(t值分别为10.805、10.009、15.513、9.311、12.124、16.658,P值均<0.01)。3-MA组各时点Beclin-1蛋白表达显著低于ANP组(t值分别为5.853、6.892、9.390、7.129、8.660、10.805,P值均<0.01),但仍显著高于假手术组(t值分别为2.791、3.468、4.497、1.391、2.673、3.464,P值均<0.05,表2,图2)。
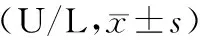
表1 各组大鼠血淀粉酶、IL-1β水平的变化
注:与假手术组比较,aP<0.05;与ANP组比较,bP<0.015

表2 各组大鼠肺、胰腺组织Beclin-1的表达分值
注:与假手术组比较,aP值均<0.01;与ANP组比较,bP值均<0.05

图2假手术组(a)、ANP组(b)、3-MA组(c)大鼠术后12 h的胰腺(上)、肺组织(下)Beclin-1蛋白表达(免疫组化 ×400)
讨论自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,是真核细胞特有的生命现象,主要通过对长寿命蛋白以及细胞器的降解和再利用,对细胞进行调节[4]。自噬在急性胰腺炎中作用是近年来胰腺炎研究的新领域。Beclin-1是酵母ATG6的同系物,也是哺乳动物参与自噬的特异性基因[5],通过与Ⅲ型磷脂酰肌醇三磷酸激酶(ClassⅢPI3K)形成复合物参与自噬体的形成,从而使磷脂肌醇磷酸化,产生PI3P,在自噬前体复合物的形成及自噬小体膜的来源中发挥重要作用[6-7]。3-MA是磷脂酰肌醇-3-激酶(PI3K)的抑制剂,自噬体的形成依赖于ClassⅢPI3K,ClassⅢPI3K可磷酸化磷脂酰肌醇(PtdIns),生成3-磷酸磷脂酰肌醇(PtdIns3P)。PtdIns3P募集胞质中含-FYVE-或-PX-基序的蛋白质,用于自噬体膜的形成。因此,3-MA是目前应用较成熟的自噬抑制剂。
Takahashi等[8]和Ohmuraya等[9]将小鼠的自噬相关基因Atg5敲除后,应用雨蛙素诱导出急性胰腺炎,结果Atg5-/-小鼠胰腺腺泡细胞中自噬减少,胰蛋白酶原激活减少,急性胰腺炎的严重程度大大减轻,提示自噬或者某些相关蛋白与胰蛋白酶原激活有关[10]。本研究结果显示,ANP大鼠胰腺和肺组织中自噬相关蛋白Beclin-1的表达随时间延长明显升高,与病理变化、炎症因子IL-1β的变化一致。3-MA干预后胰腺和肺组织的Beclin-1蛋白表达下降,病理改变减轻,同时血清淀粉酶、炎症因子IL-1β水平降低,但仍高于假手术组,提示3-MA可能通过PI3K/Akt途径抑制自噬,在一定程度上缓解ANP并发急性肺损伤的严重程度。
虽然自噬激活在一定程度上减轻ANP并发的肺损伤,但盲目抑制或阻断自噬可能会对机体造成不可预料的损伤。因此,进一步深入研究自噬信号转导通路及如何调控自噬,对改善急性胰腺炎肺损伤的临床治疗效果有非常重要的意义。
[1] 李永渝.重症急性胰腺炎发病机制研究进展.中华外科杂志,2009,47:1478-1480.
[2] Kylänpää ML,Repo H,Puolakkainen PA.Inflammation and immunosuppression in severe acute pancreatitis.World J Gastroenterol,2010,16:2867-2872.
[3] 张明钧,姚玮艳,袁耀宗,等.肠壁穿刺逆行胰胆管注射牛磺胆酸钠重症急性胰腺炎造模.上海交通大学学报(医学版),2006,19:5720-5728.
[4] Ladero Quesada JM.Role of the peritoneum in the pathogenesis of acute pancreatitis-associated lung injury.Rev Esp Enferm Dig,2004,96:521-526.
[5] Duprez L,Wirawa E,Vanden Berghe T,et al.Major cell death pathways at a glance.Microbes Infect, 2009,11:1050-1062.
[6] Meijer AJ,Codogno P.Regulation and role of autophagy in mammalian cells.Int J Biochem Cell Biol, 2004,36:2445-2462.
[7] Friedman LS, Ostermeyer EA, Lynch ED,et al.The search for BRCA1. Cancer Res, 1994,54: 6374-6382.
[8] Takahashi Y, Coppola D, Matsushita N. Bif-1 interacts with Beclin 1 through UVRAG and regulates autophagy and tumorigenesis. Nat Cell Biol, 2007, 9: 1142-1151.
[9] Ohmuraya M ,Yamamura K.Autophagy and acute panereatids:a novel autophagy theory for trypsinogen activation.Autophagy,2008,4:1060-1062.
[10] Hashimoto D,Ohmuraya M,Hirota M,et al.Involvement of autophagy in trypsinogen activation within the pancreatic aeinar cells.J Cell Biol,2008,181:1065-1072.
2012-10-23)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.02.017
215006 苏州,苏州大学附属第一医院消化内科
陈卫昌,Email:weichangchen@126.com
