溶藻弧菌SR1热修饰性外膜蛋白的分离纯化及抗原性分析*
2013-10-16王先平唐小千
王先平,唐小千,周 丽
(中国海洋大学海水养殖教育部重点实验室,山东 青岛266003)
溶藻弧菌(Vibrio alginolyticus)是一种革兰氏阴性嗜盐菌,广泛分布于海水和海产品中,是海水养殖动物如鱼、虾、贝类等的致病菌[1],可引起多种海水养殖动物发病,如点带石斑鱼[2-3]、大菱鲆[4]、金头鲷[5]、褐牙鲆[6]、南美白对虾[7]、杂色鲍[8]、刺参[9]等都可被感染。外膜蛋白(Outer membrane proteins,OMPs)是革兰氏阴性菌外膜的一个重要组成部分,具有良好的免疫原性,容易诱导宿主产生免疫防御应答反应,是一类良好的免疫保护性抗原[10],它主要包括较高拷贝数的主要蛋白及若干种小分子蛋白[11]。热修饰性蛋白(Heatmodifiable protein,HMP),是主要外膜蛋白的重要组分之一,该蛋白的电泳迁移性会随着不同温度处理而发生变化[12],由靠近胞浆的C-端部分和暴露于细菌表面的由多个β片层折叠而成的 N-端部分构成[13-14],当受热变性时,β片层结构更进一步地伸展,蛋白分子的不对称性增加,结构变得松散膨大,从而导致迁移性减慢[15-16]。热修饰性蛋白为跨膜蛋白,在维持外膜结构上具有重要的作用[17],同时它在细菌间的结合[18],噬菌体的附着[19],孔道蛋白活动[20]以及对动物机体血清的抵抗方面[21]扮演着重要的角色。
近年来,通过对热修饰性蛋白结构特点及功能的研究,探究细菌传染机理、菌间结合的作用原理[18,21-22],以及对其免疫原性、抗原保守性的研究,分析其作为亚单位疫苗材料的可能性方面已成为研究重点。Schweizer等[18]研究发现大肠杆菌K-12的热修饰性蛋白ProteinⅡ在菌间的结合过程中起抑制作用;Tagawa等[23]通过对睡眠嗜血菌(Haemophilus somnus)的一个主要热修饰性外膜蛋白28kDa的研究发现,其在同血清型细菌间及其它种属间具有较高的抗原保守性;同类研究中,多杀巴斯德氏菌(Pasteurella multocida)的热修饰蛋白单抗MAb MT4.1可以与近100株不同血清型的多杀巴斯德氏菌菌株及其它巴斯德氏菌属的细菌发生免疫交叉反应,证明了该热修饰性蛋白具有较高的抗 原 保 守 性[24]。Lutwyche 等[25]以 杀 鲑 气 单 胞 菌(Aeromonas salmonicida)的热修饰性外膜蛋白28 kDa免疫虹鳟后,针对病原菌的人工感染显著降低了虹鳟的死亡率,对鱼体起到了良好的保护效果,证实了杀鲑气单胞菌28kDa热修饰性外膜蛋白具有较好的免疫原性,是一种良好的保护性抗原。
尽管热修饰性蛋白在许多革兰氏阴性菌中得到鉴定,并对其免疫保护效果开展了研究,但在海洋弧菌中的研究却鲜见报道。本研究应用十二烷基肌氨酸钠(Sarkosyl)抽提并结合超速离心的方法提取了溶藻弧菌SR1的主要外膜蛋白,通过对样品热处理结合电泳及免疫学手段,筛选、鉴定溶藻弧菌外膜蛋白中的热修饰性蛋白,并比较分析其抗原保守性,为深入了解海洋弧菌热修饰性外膜蛋白特性及弧菌亚单位疫苗开发提供参考。
1 材料和方法
1.1 实验菌株与培养条件
实验用9株弧菌菌株:溶藻弧菌(V.alginolyticus)SR1、RB、RH2、283、284、副溶血弧菌(V.parahaemolyticus)458、哈维氏弧菌(V.harveyi)295、鳗弧菌(V.anguillarum)72、创伤弧菌(V.vulnificus)310。SPF大鼠购于青岛药检所。
各冻存菌株划线接种于2216E固体培养基,28℃培养24h,挑取单菌落,鳗弧菌接种于营养琼脂液体培养基中,其余弧菌皆接种于2216E液体培养基中,28℃摇床培养(200r/min)8h后分别续接于10倍体积的上述液体培养基中,28℃摇床培养(200r/min)24h。
1.2 实验方法
1.2.1 外膜蛋白提取 外膜蛋白的提取采用改进的Sarkosyl法进行,具体程序参照文献[25]进行。
1.2.2 聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用解离非连续缓冲系统SDS-PAGE垂直板凝胶电泳,浓缩胶浓度为4.8%,分离胶浓度为13%,具体方法参照Lutwyche[25]进行,略有改动。蛋白样品溶解于等体积的电泳上样缓冲液 (0.1mol/L Tris-HC1,4%SDS,12%疏基乙醇,20%甘油,5μg/mL 溴酚蓝),煮沸5min,冷却后加样,30mA恒流跑至分离胶后,调至60mA恒流跑至结束,取出凝胶经考马斯亮蓝R-250(Sigma)染色后用全自动凝胶成像系统扫描,Gel-Pro Analyzer软件分析各样品的蛋白分子量。
1.2.3 菌株SR1热修饰性蛋白的筛选 根据热修饰性蛋白经60℃或更低温度处理时呈现较低的分子量,而经更高温度处理时分子量增加的特性对菌株SR1的热修饰性蛋白进行筛选,具体方法参照文献[23-24]进行。菌株SR1外膜蛋白样品与等体积电泳上样缓冲液混匀后,分别于28、37、50、60、70、100 ℃温度条件下处理5min后上样,行SDS-PAGE,所得凝胶经考马斯亮蓝染色拍照后,以Gel-Pro Analyzer软件分析比较各梯度温度处理样品中蛋白条带分子量的变化情况。
1.2.4 热修饰性蛋白的分离纯化 外膜蛋白与等体积电泳上样缓冲液混合后,28℃处理5min后上样,4℃条件下行SDS-PAGE,80mA恒流跑至结束,取出凝胶放入锌-咪唑染液(75mmol/L ZnSO4,75mmol/L Imidazole,200mmol/L NaCl)中,振荡染色,直至在黑背景光照条件下观察到蛋白带,根据标准蛋白Marker找到并切下30kDa蛋白条带。将切取的蛋白条带放入饱和EDTA溶液中振荡脱色,待蛋白条带颜色消失后,再以20%乙醇冲洗3次。把切取的凝胶切碎后,以电洗脱仪电泳洗脱回收目的蛋白(Model 422,Bio-Rad),洗脱样品以双蒸水透析过夜,冷冻干燥后以0.01mol/L PBS重悬,用Bradford法检测样品的蛋白浓度并将其调整至1mg/mL,-20℃冻存备用。取适量纯化样品调整蛋白浓度至0.1mg/mL,混合等体积电泳上样缓冲液后分别于28和100℃温度条件下处理5min后行SDS-PAGE,凝胶用考马斯亮蓝R-250染色拍照。
1.2.5 鼠抗溶藻弧菌SR1的30kDa外膜蛋白血清制备
将上述电泳洗脱纯化的30kDa外膜蛋白分4次免疫SPF级大鼠,具体程序如下:基础免疫以蛋白悬液与弗氏完全佐剂2∶1混匀,背部皮下4点注射,每点注射0.2mL;2周后进行第1次加强免疫,蛋白悬液与弗氏不完全佐剂2∶1混匀,方法同基础免疫;接下来2周,每周再加强免疫1次,尾静脉注射蛋白悬液0.2mL,无佐剂;最后一次加强免疫后第7天心脏一次性采血,室温倾斜放置2h,放置4℃过夜;次日5 000×g离心20min得抗血清。以间接ELISA方法测得鼠抗溶藻弧菌SR1的30kDa外膜蛋白血清效价为3 200。
1.2.6 免疫印迹分析(Western blotting) 外膜蛋白样品 经 SDS-PAGE 后,用 Mini-Protean H cell系 统(Bio-Rad)电转移至孔径为0.45μm的NC膜上(30V,5h),NC膜以含4%脱脂奶粉的PBS缓冲液4℃封闭过夜,PBST(含有0.05%Tween-20的PBS缓冲液)洗涤3次,每次5min,然后将NC膜置于PBS稀释500倍的鼠抗SR1菌株30kDa外膜蛋白血清中37℃温育1h,PBST洗3次,每次5min,取出后置于PBS稀释5 000倍的碱性磷酸酶标记的羊抗鼠IgG(Sigma)中37℃温育45min,PBST洗3次,每次5min。最后将膜浸于含有66μL NBT贮液(0.5g NBT溶于10mL 70%二甲基亚砜)、33μL BCIP贮液(0.5g BCIP溶于10mL100%二甲基亚砜)的10mL NBT/BCIP缓冲液中发色,待有条带发出颜色,快速拿出置于超纯水中洗涤以终止发色,晾干后观察。
1.2.7 间接ELISA法检测30kDa外膜蛋白的抗原保守性 9株不同弧菌菌株外膜蛋白样品经包被缓冲液 (35mmol/L NaHCO3,5mmol/L Na2CO3,pH =9.6)稀释后(蛋白浓度20μg/mL),取酶标板每孔包被100μL,设4个重复,4℃包被过夜,以PBST洗涤3次,每次5min,每孔加入200μL含4%BSA的PBS溶液,37℃封闭1h,PBST洗涤3次;每孔加入100μL PBS稀释1 000倍的鼠抗SR1菌株的30kDa外膜蛋白血清,37℃孵育1h,以PBST同上洗3次;加入100μL PBS稀释5 000倍的碱性磷酸酶标记的羊抗鼠IgG,37℃温育45min,PBST洗3次;每孔加入pNPP发色液(1mg/mL pNPP,35mmol/L NaHCO3,5mmol/L Na2CO3,0.5mmol/L MgC12·6H2O,pH=9.8)100μL发色30min,2mol/L NaOH 终止发色,用酶标仪在405nm波长处测量OD值,以PBS代替抗血清作为阴性对照。OD值P/N>2.1为阳性结果判定标准。
2 实验结果
2.1 菌株SR1热修饰性蛋白的筛选
菌株SR1外膜蛋白样品分别经28、37、50、60、70和100℃温度处理后行SDS-PAGE,所得凝胶经考马斯亮蓝染色拍照,同时,平行电泳样品转膜后以抗菌株SR130kDa外膜蛋白血清行Western blotting。
SDS-PAGE图谱显示:菌株SR1外膜蛋白经28、37和50℃温度处理,30kDa蛋白丰度无显著变化,为外膜蛋白样品的主要高丰度蛋白,但经60、70和100℃处理后,该蛋白丰度显著降低,并伴有4条新的蛋白条带出现,分子量分别为45、36、34和22kDa(见图1a);Western blotting结果显示,制备的鼠抗血清可与各梯度温度处理样品中的30kDa外膜蛋白发生不同程度的免疫印迹反应,还可与50℃处理样品中的37.5kDa蛋白及60、70和100℃处理样品中的36和37.5kDa蛋白发生免疫印迹反应(见图1b)。
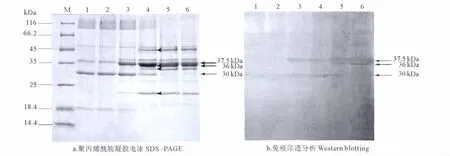
图1 不同温度处理的SR1外膜蛋白SDS-PAGE及其Western blotting图谱Fig.1 SDS-PAGE of SR1OMPs solubilized at different temperatures and its Western blot reacted with mouse antiserum raised against the 30kDa protein
2.2 菌株SR1 30kDa热修饰性蛋白的分离纯化及热修饰性分析
全菌外膜蛋白于28℃处理后经电泳、切胶、电洗脱获得30kDa纯化蛋白样品,经28℃处理行SDSPAGE,发现只有极少量蛋白呈现为30kDa,大部分呈现为36和37.5kDa,而经100℃处理呈现相同的电泳迁移率变化(见图2)。
2.3 菌株SR1 30kDa外膜蛋白的抗原保守性分析
2.3.1 免疫印迹分析(Western blotting) 9株弧菌的外膜蛋白一组经28℃温度处理5min,另一组经100℃温度处理5min,分别行SDS-PAGE,所得凝胶经考马斯亮蓝染色拍照,同时,平行电泳样品转膜后以抗菌株SR1的30kDa外膜蛋白血清行Western blotting。
28℃温度处理样品SDS-PAGE结果显示,溶藻弧菌SR1、283、284、RB、RH2在30kDa处,副溶血弧菌458在29.5kDa处,哈维氏弧菌295在30.5kDa处均有一条较高丰度的外膜蛋白,鳗弧菌72和创伤弧菌310在此分子量附近均无高丰度蛋白(见图3a)。Western blotting结果显示,鼠抗血清能与溶藻弧菌各菌株的30kDa外膜蛋白、副溶血弧菌458的29.5kDa外膜蛋白发生免疫印迹反应,而未与哈维氏弧菌295、鳗弧菌72和创伤弧菌310的外膜蛋白发生免疫印迹反应(见图3b)。
100℃温度处理样品SDS-PAGE结果显示,溶藻弧菌各菌株的30kDa外膜蛋白、副溶血弧菌458的29.5kDa外膜蛋白以及哈维氏弧菌295的30.5kDa外膜蛋白丰度显著降低(如箭头所示),同时在分子量33~46kDa范围内出现了5~6条高丰度蛋白条带(见图3c)。Western blotting结果显示,鼠抗血清能与溶藻弧菌各菌株的36和30kDa蛋白、副溶血弧菌458的35和29.5kDa蛋白发生免疫印迹反应,而未与哈维氏弧菌295及鳗弧菌72、创伤弧菌310的外膜蛋白发生任何免疫印迹反应(见图3d)。

图2 经不同温度处理的纯化30kDa热修饰性蛋白与SR1全菌外膜蛋白SDS-PAGE图谱Fig.2 SDS-PAGE of 30kDa HMP and SR1OMPs solubilized at different temperatures
2.3.2 酶联免疫吸附测定(ELISA) 间接ELISA法检测结果显示,鼠抗血清与溶藻弧菌SR1、283、284、RB、RH2及副溶血弧菌458的外膜蛋白反应均为阳性,P/N值分别为6.8、4.9、3.4、4.1、6.5、2.3,与其他3种弧菌的外膜蛋白反应均为阴性(P/N<2.1)。
3 讨论
热修饰性蛋白是细菌主要外膜蛋白的重要组成部分,具有良好的免疫原性,容易诱导宿主产生免疫防御应答反应,是一类良好的免疫保护性抗原[25]。通过筛选致病菌的热修饰性蛋白,分析其免疫原性及抗原保守性,已成为细菌病疫苗候选材料筛选的一条新的研究途径,而对热修饰性蛋白的筛选是研究的第一步。从细菌外膜蛋白中筛选鉴定热修饰性蛋白普遍采用的方法是将蛋白样品溶解于电泳上样缓冲液中,经不同温度处理后行SDS-PAGE,此蛋白的分子量会随处理温度的不同而发生改变,当在60℃或更低温度下处理时,热修饰性蛋白会呈现较低的分子量,而在100℃处理时分子量会增加[23-24]。Marandi等[24]对多杀巴斯德氏菌外膜蛋白的热修饰性研究中发现一个经60℃处理时分子量为28kDa的主要外膜蛋白在经100℃加热处理后分子量增加为37kDa,表现出明显的热修饰特征;Magalashvili等[26]分离纯化了不解糖卟啉单胞菌(Porphyromonas asaccharolytica)的 37kDa Omp-PA,对其于95℃条件下加热处理后发现,该蛋白的大部分蛋白组分迁移至41kDa分子量处,仅有一小部分残留于37kDa处。本实验在对溶藻弧菌SR1外膜蛋白经不同温度处理后的SDS-PAGE分析中发现一条30kDa的高丰度外膜蛋白经28、37和50℃处理蛋白丰度无显著变化,而经60、70和100℃处理后蛋白丰度显著降低,同时伴有36kDa蛋白的出现及37.5kDa蛋白丰度的显著增加,结合 Western blotting结果证实30kDa蛋白与36、37.5kDa蛋白具有交叉免疫反应,推测30kDa蛋白与36、37.5kDa蛋白具有较高的同源性,仅以不同的热修饰性形式存在,说明30kDa蛋白组分具有热修饰性,是一种热修饰性蛋白。
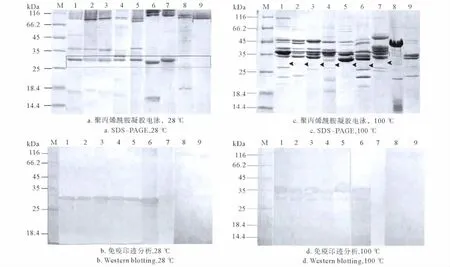
图3 9株弧菌主要外膜蛋白经28℃、100℃处理后的SDS-PAGE及其Western-blotting图谱Fig.3 SDS-PAGE of OMPs of 9strains of Vibrio solubilized at 28 ℃and 100 ℃ respectively and their Western blot reacted with mouse antiserum raised against the 30kDa protein
分离纯化已筛选出的热修饰性蛋白为进一步研究其结构功能特点,排除无关蛋白的干扰提供了方便。本实验将切胶纯化后的30kDa蛋白分别经28℃、100℃温度处理后行SDS-PAGE发现,经28℃处理,原本分子量为30kDa的外膜蛋白大部分却呈现为36、37.5kDa,只有极少部分呈现为30kDa。Sugawara等[20]研究发现在热修饰性蛋白的纯化过程中,因热修饰性蛋白极易变性,在透析液中透析脱盐时,部分蛋白分子慢慢转变成变性的蛋白形式,结构由原来的坚实变得松散,从而导致电泳迁移率减小,呈现出与经加热处理后表现出的相同电泳迁移率变化,其结构变化的机理还不清楚。结合30kDa外膜蛋白的热修饰性可推测:30kDa蛋白内存在3个蛋白质点,经过加热处理后,其中2个蛋白质点因对热较敏感而发生热修饰性作用,在电泳中迁移性减慢,分别迁移至36、37.5kDa分子量处;另外一个蛋白点对热不敏感,100℃时依然保持于30kDa的分子量处。
已经有越来越多的研究证实热修饰性蛋白在种间的抗原保守性较高,且其具有较强的免疫原性,是一种重要的保护性抗原。Lutwyche等[25]使用杀鲑气单胞菌的分子量为28kDa热修饰性外膜蛋白免疫虹鳟的接种实验证实了此热修饰性外膜蛋白具有较好的免疫原性,可对虹鳟提供较好的免疫效果,是一种良好的保护性抗原。Tagawa等[23]使用可特异性识别睡眠嗜血杆菌的热修饰性外膜蛋白的小鼠单抗MAb 27-1,与45株不同血清型的睡眠嗜血杆菌及大肠杆菌K-12的全菌进行免疫印迹分析,发现不同血清型的睡眠嗜血杆菌中的热修饰性蛋白及大肠杆菌的OmpA蛋白均可与之发生阳性的免疫印迹反应,此结果证实了睡眠嗜血杆菌的热修饰性外膜蛋白具有较高的抗原保守性。本实验通过Western blotting、间接ELISA法分析溶藻弧菌SR1热修饰性蛋白30kDa与其他弧菌外膜蛋白间的交叉反应性,结果表明5株溶藻弧菌的30kDa外膜蛋白及副溶血弧菌458的29.5kDa外膜蛋白间具有共同抗原表位,可发生免疫交叉反应,而与其他3种弧菌外膜蛋白的抗原同源性较低。溶藻弧菌SR1的30kDa外膜蛋白在溶藻弧菌种内的抗原保守性较高,而在弧菌属不同种间抗原保守性较低,此结果对于研制溶藻弧菌外膜蛋白亚单位疫苗有一定的参考意义。
[1] 吴后波,潘金培.弧菌属细菌及其所致海水养殖动物疾病 [J].中国水产科学,2001,8(1):89-93.
[2] Lee K K.Pathogenesis studies on Vibrio alginolyticus in the grouper,Epinephelus malabaricus,Bloch et Schneider[J].Microb Pathog,1995,19(1):39-48.
[3] 黄志坚,何建国.斑点石斑鱼细菌病原的分离鉴定和致病性 [J].中山大学学报:自然科学版,2002,41(5):64-67.
[4] 张伟妮,周丽,邢婧,等.养殖大菱鲆腹水症病原菌SR1的分离及鉴定 [J].中国水产科学,2006,13(4):603-609.
[5] Balebona C M,Zorrilla I,Morinigo M A,et al.Survey of bacterial pathologies affecting farmed gilt-head sea bream(Sparus aurata L.)in southwestern Spain from 1990to 1996[J].Aquaculture,1998,166:19-35.
[6] 薛淑霞,冯守明,孙金生.海水工厂化养殖大菱鲆(Scophthalmus maximus)和褐牙鲆(Paralichthys olivaceus)腹水病病原菌的分离与鉴定 [J].海洋与湖沼,2006,37(6):548-554.
[7] 周永灿,张本,陈雪芬,等.养殖对虾细菌性红体病的初步研究[J].海洋科学,2003,27(5):61-65.
[8] 周晶,蔡俊鹏,杨洪志.南方杂色鲍苗大规模死亡病原菌的分离鉴定及其回归感染试验 [J].海洋湖沼通报,2006,3:54-59.
[9] 杨嘉龙,周丽,绳秀珍,等.养殖刺参溃疡病病原茵RH2的鉴定及其生物学特性分析 [J].水产学报,2007,31(4):504-511.
[10] Seltman G,Holst O.The Bacterial Cell Wall[M].Berlin,Heidelberg:Springer,2002.
[11] Hancock R E W.Bacterial outer membranes:evolving concepts[J].ASM American Society for Microbiology News,1991,57:175-182.
[12] Davies R L.Outer membrane protein profiles of Yersinia ruckeri[J].Veterinary Microbiology,1991,26:125-140.
[13] Pautsch A,Schulz G E.Structure of the outer membrane protein A transmembrane domain[J].Nature Structural Bbiology,1998,5(11):1013-1017.
[14] Ried G,Koebnik R,Hindennach I,et al.Membrane topology and assembly of the outer membrane protein OmpA of Escherichia coil K12[J].Mol Gen Genet,1994,243:127-135.
[15] Sugawara E,Steiert M,Rouhani S,et al.Secondary structure of the outer membrane proteins OmpA of Escherichia coli and OprF of Pseudomonas aeruginosa [J].Journal of Bateriolgy,1996,178(20):6067-6069.
[16] Reithmeier R A F,Bragg P D.Molecular characterization of a heat-modifiable protein from the outer membrane of Escherichia coli [J].Archives of Biochemistry and Biophysics,1977,178(2):527-534.
[17] Sonntag I,Schwarz H,Hirota Y,et al.Cell envelope and shape of Escherichia coli:multiple mutants missing the outer membrane lipoprotein and other major outer membrane proteins[J].Journal of Bacteriology,1978,136(1):280-285.
[18] Schweizer M,Henning U.Action of a major outer cell envelope membrane protein in conjugation of Escherichia coli K-12 [J].Journal of Bacteriology,1977,129(3):1651-1652.
[19] Datta D B,Arden B,Henning U.Major proteins of the Escherichia coli outer cell envelope membrane as bacteriophage receptors[J].Journal of Bacteriology,1977,131(3):821-829.
[20] Sugawara E,Nikaido H.Pore-forming activity of OmpA protein of Escherichia coli [J].Journal of Bacteriology,1992,267(4):2507-2511.
[21] Weiser J N,Gotschlich E C.Outer membrane protein A (OmpA)contributes to serum resistance and pathogenicity of Escherichia coli K-1[J].Infection and Immunity,1991,59(7):2252-2258.
[22] Prasadarao N V,Wass C A,Weiser J N,et al.Outer membrane protein A of Escherichia coli contributes to invasion of brain microvascular endothelial cells[J].Infection and Immunity,1996,64(1):146-153.
[23] Tagawa Y,Haritani M,Ishikawa H,et al.Characterization of a Heat-Modifiable Outer Membrane Protein of Haemophilus somnus[J].Infection and Immunity,1993,61(5):1750-1755.
[24] Marandi M V,Mittal K R.Characterization of an outer membrane protein of Pasteurella multocida belonging to the OmpA family[J].Veterinary Microbiology,1996,53:303-314.
[25] Lutwyche P,Exner M M,Hancock R E W.A conserved Aeromonas salmonicida porin provides protective immunity to rainbow trout[J].Infection and Immunity,1995,63(8):3137-3142.
[26] Magalashvili L,Pechatnikova I,Wexler H M,et al.Isolation and characterization of the Omp-PA porin from Porphyromonas asaccharolytica,determination of the omp-PAgene sequence and prediction of Omp-PA protein structure [J].Anaerobe,2007,13:74-82.
