Gd-DTPA对单体素氢质子磁共振波谱的影响研究
2013-10-09王亦强范国光
王亦强 范国光
中国医科大学附属第一医院 辽宁 沈阳 110001
氢质子磁共振波谱(1H Magnetic Resonance Spectroscopy,1H-MRS)是一种非侵入性检测活体组织内化学成分的方法。通过MRS评价脑肿瘤的应用越来越多,它可以提供肿瘤组织的代谢、生化改变等方面的信息,为脑肿瘤定量分析提供了新途径。注射对比剂后对病变区行1H-MRS检查,有助于肿瘤实质区及坏死囊变区的区分,能够在波谱分析时更准确设置体素,为脑肿瘤的诊断、分级诊断及浸润范围等方面提供帮助。本研究旨在探讨对比剂在胶质瘤患者中是否对磁共振波谱构成影响。



资料与方法
研究对象:选取2010年11月~2012年4月期间临床收治的29例脑胶质瘤患者,年龄31-79岁,平均51.5岁,所有病例均经手术病理证实。根据WHO2000年分类标准,其中低级别胶质瘤(low-grade astrocytomas,LGAⅠ-Ⅱ级)12例,高级别胶质瘤(high-grade astrocytomas,HGAⅢ -Ⅳ级)17例。另外,选取10例健康志愿者作为正常对照组,年龄28~67岁,平均40.3岁,其中男6例,女4例。所有患者均获得知情同意后,行MRI平扫和增强检查,并于增强前后分别进行1H-MRS扫描。
检查方法:使用1.5T磁共振成像仪(Signa HD,GE公司),头颅正交线圈,常规轴位SE-T1WI(TR/TE 1800/23),FSE-T2WI(TR/TE 5000/114)及T2 FLAIR序列(TR/TE 9000/134)扫描,参数如下:矩阵512×512,FOV 240mm ×240mm,层厚6mm,层距1mm。平扫结束后行单体素1H-MRS扫描,常规扫描后增强扫描前采用定点分辨磁共振波谱序列(PRESS)扫描,TR 1500ms,TE 35ms,体素厚度20mm。通过自动扫描程序,完成体素的匀场及水抑制。根据病灶特征选定感兴趣区(ROI),ROI的选择既要避开骨骼、气体、脂肪及钙化等区域,又要尽可能涵盖肿瘤实质区。成像时间约为312s。之后,静脉团注Gd-DTPA,行横断位、矢状位及冠状位T1W增强扫描后,立即以相同的成像参数采集增强后MRS,成像时间在注射对比剂后5~10min内。
图像处理及数据分析:测定的代谢物包括氮-乙酰天门冬氨酸(NAA)、胆碱复合物(Cho)、肌酸复合物(Cr)和肌醇(mI)。由机器软件(Functiontool 3.1)自动计算 NAA、Cho、Cr、mI的峰下面积和Cho/Cr、NAA/Cr、mI/Cr比值,对注射对比剂前后的两次1H-MRS的结果进行比较。
统计学分析:应用SPSS13.0统计软件进行数据分析,全部统计数据结果以均数±标准差表示,使用配对t检验比较注入Gd-DTPA增强前后同一感兴趣区各项参数及比值之间的差异。
结 果
增强前、后谱线形态比较相似,Cho波峰高度略下降(图1-4),高级别胶质瘤组增强前代谢物Cho/Cr、NAA/Cr、mI/Cr的平均比值分别为2.57 ±0.61、0.71 ±0.23、0.51 ±0.19;而增强后分别为2.49 ±0.73、0.75 ±0.26、0.44 ±0.24。低级别胶质瘤组增强前代谢物 Cho/Cr、NAA/Cr、mI/Cr的平均比值分别为1.97 ±0.59、0.92 ±0.18、0.57 ±0.21;而增强后分别为 1.83 ±0.51、0.98±0.13、0.61±0.17。结果显示,对比剂对代谢物比值的影响差异无统计学意义,P值均>0.05见表1。
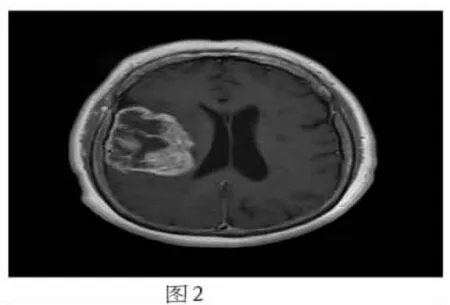
图1-4为1例48岁女性胶质瘤患者MRI与MRS图像。图1、2分别为横轴位T2W波谱定位图和T1W增强图像,显示右颞叶高级别胶质瘤,增强出现明显不规则环样强化。图3、4分别为胶质瘤增强前和增强后的MRS图像,谱线显示Cho峰上升,NAA峰下降,Cr峰变化不大,并分别在1.33ppm和0.9ppm附近出现正向Lac峰和Lip峰。但增强后谱线中Cho峰较增强前略下降。
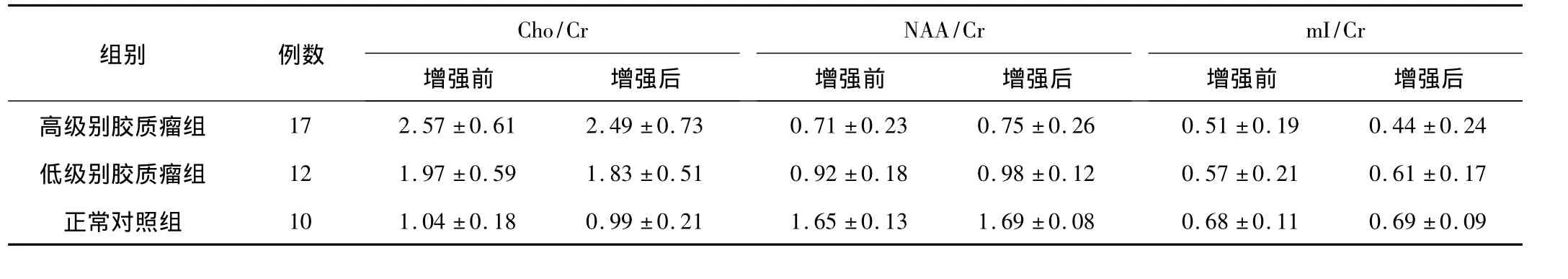
表1 增强前与增强后Cho/Cr、NAA/Cr、mI/Cr比值
讨 论
磁共振波谱形成的原理包括化学位移及J-耦合两种物理现象。由于化学位移会引起共振峰数目和位置的改变,说明化合物中同种原子核所处的化学环境及化合物结构上存在差别,据此可检测化合物的成分组成。通过检测MRS谱线中的化合物改变情况,为颅脑肿瘤与非肿瘤性疾病的诊断提供帮助,尤其在胶质瘤的分级方面具有重要意义[1]。
应用对比剂既能够增加组织与病变之间的对比和图像信噪比,可以对肿瘤的实质区和坏死区进行有效区分,从而指导行MRS检查时VOI的准确放置,可以提高检测各代谢物的含量,将有助于肿瘤的定性诊断及分级诊断。Gd-DTPA作为目前使用最为普遍的造影剂,是一种细胞外间隙的非特异性对比剂,是利用肿瘤组织破坏血脑屏障,使对比剂由血管内渗透到肿瘤组织的细胞外间隙,从而产生肿瘤组织的强化。因为正常脑组织有完整的血脑屏障,注入的对比剂不能够通过完全处于细胞外间隙,在分布上亦无选择性,故不显示增强或无明显增强,而脑肿瘤不但破坏了血脑屏障,而且有异常血管团的形成,使得肿瘤区域出现异常对比增强。应用对比剂可使脑肿瘤的检出率和诊断率大大提高。
一直以来,关于增强对比剂是否对磁共振波谱构成影响说法不一。Sijens等发现注入对比剂后波谱Cho信号值下降40%以内[2],其据此提出1H-MRS应于无对比剂的情况下实行。Murphy等通过体外试验表明[3],Gd-DTPA对驰豫时间的影响由大到小依次为Cho、Cr、NAA。Smith等亦对10例脑肿瘤患者行单体素MRS研究发现,注射对比剂后各代谢峰无明显变化[4]。张凯等对颅内肿瘤性病变在注射对比剂前后MRS结果进行比较研究[5],结果发现 Cho值在增强前后有改变,但 Cho/Cr、Cho、NAA的变化差异却无统计学意义。
本组的研究结果表明增强扫描前较增强扫描后波谱谱线更为尖锐,各代谢物峰间的分界更明显,基线更平稳。尽管从数值上增强前后NAA、Cr、Cho、mI波峰下面积均发生不同的变化,但其变化差异无统计学意义。这可能是由以下原因造成:对比剂产生的顺磁性作用是通过代谢产物内质子与对比剂内不成对电子的偶极-偶极作用和无矢量耦合作用实现的。如果要发生这种作用,对比剂和代谢产物必须得接近到一定程度,即它们的不成对电子应靠近质子3×10~10m之内。Calabi等研究认为Gd-DTPA不能穿过细胞膜[6],故不能与仅存在于细胞内的NAA和Cr作用,而细胞外同样存在胆碱池,能够与对比剂接近到产生耦合作用的距离。另外,由于钆螯合物带有负电荷,易于与带正电荷的Cho相互吸引产生作用。而NAA和Cr均带负电荷,与钆螯合物的相互排斥使之相互作用减少至可检测的阈值以下。而正常对照组,由于血脑屏障完整,对比剂没能进入血管外的组织间隙与氢质子发生作用,所以不会改变各代谢物的信号强度。
综上所述,我们认为对比剂Gd-DTPA对单体素1H-MRS结果分析不产生显著影响。1H-MRS检查可以在增强后进行,将有助于体素位置的选择,从而能更准确表达病变区域组织代谢情况,为颅脑疾病的定性诊断提供帮助。
1 Senft C,Hattingen E,Pilatus U,et al.Diagnostic value of proton magnetic resonance spectroscopy in the noninvasive grading of solid gliomas:comparison of maximum and mean choline values.Neurosurgery,2009,65(5):908-913.
2 Sijens PE,van de Bent MJ,Nowak PJ,etal.1H chemicalshift imaging reveals loss ofbrain tumor choline signalafter administration of Gd-contrast[J].Magn Reson Med,1997,37(2):222 -225.
3 Murphy PS,Leach MO,Rowland IJ.Signalmodulation in 1H magnetic resonance spectroscopy using contrast agents:proton relaxivities of choline,creatine,and N - acetylaspartate.Magn Reson Med,1999(42):1155-1158.
4 Smith JK,Kwock L,CastiuoM.Effect of contrast material single volume proton MR spectroscopy[J].AJNR,2000,21(6):1084 -1089.
5 张凯,李传福,刘影,等.对比剂对3T氢质子MR波谱的影响[J].中华放射学杂志,2006,50(10):1095 -1097.
6 Calabi L,Alfieri G,Biondi L,et al.Application of high - resolution magic-angle spinning NMR spectroscopy to define the cell uptake of mri contrast agents.J Magn Reson,2002(156):222 -229.
