钩吻素子在大鼠体内的药物代谢动力学及组织分布
2013-09-27李苏平苏燕评俞昌喜
许 盈,郑 宓,李苏平,苏燕评,杨 渐,刘 铭,俞昌喜
钩吻素子(Koumine),分子式C20H22N2O,相对分子质量306.3,是我国历史悠久的药用植物钩吻(GelsemiumelegansBenth.)主要活性成分生物碱中含量最高且毒性较低的一种生物碱[1-3],其药理作用及潜在的临床应用价值日益受到关注。有报道,钩吻素子具有镇痛、抗焦虑、抗肿瘤、抗应激和抗银屑病等药理作用,具有创制新型药物的潜能[4-8]。然而,药动学是成药性评价的重要指标,钩吻素子的药动学特征还有待于研究。本研究报道高效液相色谱 (high performance liquid chromatorgraphy,HPLC)测定血液和组织样品钩吻素子的方法,进而研究单次灌胃给予钩吻素子的大鼠体内药动学和组织分布,从而获得口服用药的药动学资料,为钩吻素子深入开展毒理、药效和临床研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 钩吻素子由本实验室自闽产野生钩吻植物中提取,纯度99.1%;甲醇(色谱纯,国药集团化学试剂有限公司);乙酸乙酯(分析纯,国药集团化学试剂有限公司);氨水(汕头市西陇化工厂有限公司)。高效液相色谱仪(LC-20A,日本岛津公司);电子分析天平(BP310S型,北京塞多利斯天平公司);氮气吹干仪(HGC-24A型,天津市恒奥科技发展有限公司);台式高速离心机(TGL-16C型,上海安亭科学仪器厂);旋涡混合仪(WH-2微型,上海沪西分析仪器厂);自动匀浆器(Art-Miccra D-8型,德国 MICCRA公司)。
1.1.2 动物 雄性SD大鼠,6~7周龄,体质量180~200g,清洁级[上海斯莱克实验动物有限公司,动物质量合格证号:SCXK(沪)2007-0005]。实验前禁食12h,不禁水。
1.2 方法
1.2.1 样品采集与预处理 血浆样品采集与预处理:大鼠6只,灌胃给予15mg/kg钩吻素子,于给药后第5,9,12,15,30,45,60,150,240,330和420 min眼眶静脉取血约0.5mL于肝素处理的试管中,4 000r/min离心5min,取100μL 血浆,加5mol/L氢氧化钠溶液10μL调pH至10~12,加1mL乙酸乙酯,涡旋混匀5min,10 000r/min离心10min,取上清60℃氮气挥干,残渣以100μL流动相复溶,0.25μm微孔滤膜过滤,取滤液10μL进样。
组织样品采集与预处理:大鼠18只,随机分成3组,每组6只。大鼠灌胃给予15mg/kg钩吻素子,3组大鼠分别于灌胃给药后第5,15和60min断头处死,取肝、肾、肺、脑、睾丸、骨骼肌、胃、小肠、体脂、心、脾组织,生理盐水冲洗(其中小肠和胃需去除内容物),滤纸吸干,称质量,按1∶1(W/V)加入生理盐水冰浴匀浆,取100μL匀浆液进行预处理,方法同上述血浆样品的预处理。
1.2.2 HPLC色谱条件 色谱柱:Amethyst C18柱(150mm×4.6mm,5μm);柱温:30℃。血液样品检测流动相:甲醇∶水∶氨水=55∶45∶0.05(V/V);组织样品检测流动相:甲醇∶水∶氨水=45∶55∶0.05(V/V);流速1.0mL/min。紫外检测波长:256nm。
1.2.3 方法学确证 为验证HPLC测定血浆样品钩吻素子含量的方法学,进行专属性、线性关系及灵敏度、精密度、回收率和稳定性试验。为验证HPLC测定组织样品钩吻素子含量的方法学,进行专属性、线性关系、精密度和回收率试验。
1.3 统计学处理 数据采用x±s表示。选用Kinetia 4.4药代动力学软件(Thermo Electron公司)计算药动学参数。
2 结 果
2.1 HPLC测定生物样品钩吻素子含量的方法学确证
2.1.1 钩吻素子血浆样品浓度测定方法确证 本色谱条件下钩吻素子的保留时间为9.2min,血浆中的内源性物质对检测无干扰,方法的专属性良好;在0.06~10.00μg/mL范围内线性关系良好(表1),定量限为0.06μg/mL;钩吻素子0.08,2.00和10.00μg/mL的日内和日间精密度 RSD均<9%,钩吻素子0.08,2.00和10.00μg/mL提取回收率为80.03%~83.55%,方法回收率为99.21%~110.36%,钩吻素子0.08,2.00和10.00 μg/mL室温、冻融和长期保存稳定性的测定结果变化均在允许范围内。
2.1.2 钩吻素子组织样品浓度测定方法确证 本色谱条件下钩吻素子的保留时间为19.7min,组织中的内源性物质对检测无干扰,方法的专属性良好;在0.08~5.00μg/mL范围内线性关系良好(表1);钩吻素子0.08,1.00和5.00μg/mL的日内和日间精密度RSD均<8%,钩吻素子0.08,1.00和5.00μg/mL提取回收率为64.20%~76.82%,方法回收率为91.87%~109.25%。
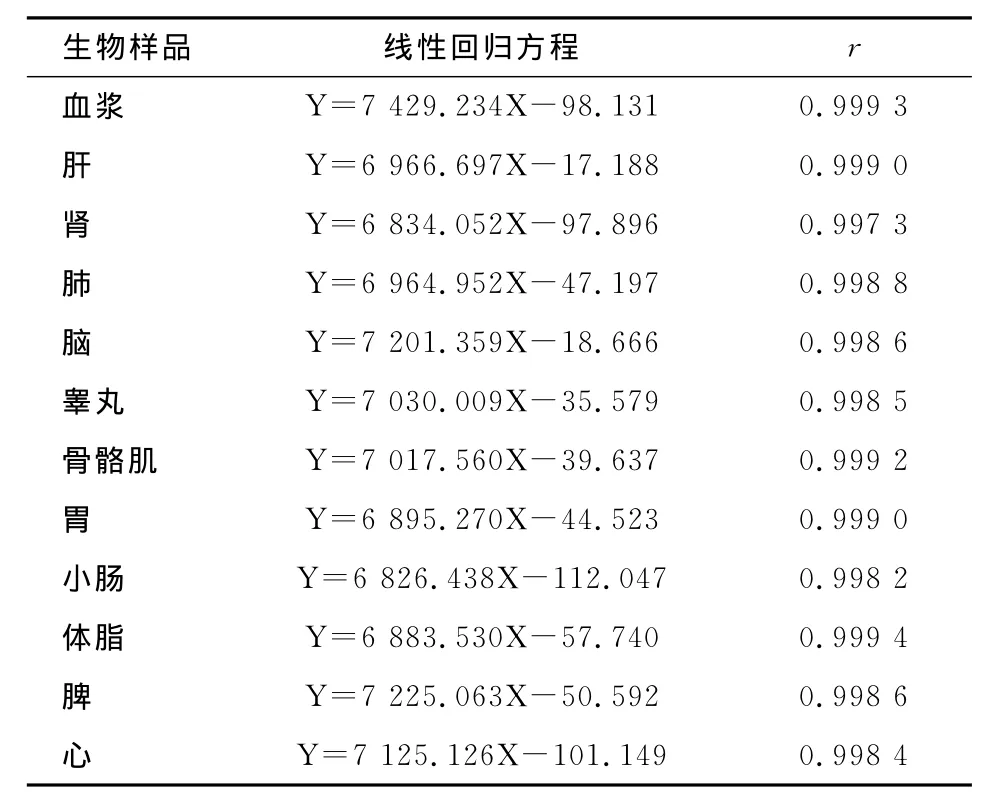
表1 大鼠血浆和组织钩吻素子含量HPLC测定法的标准曲线和相关系数Tab 1 Standard curves and correlation coefficients of Koumine concentrations in rat plasma and tissues measured by HPLC method
2.2 钩吻素子在大鼠体内的药代动力学 钩吻素子的血药浓度-时间曲线见图1。大鼠单次灌胃给予15mg/kg钩吻素子,约15min后钩吻素子血药浓度达峰;随后血药浓度迅速下降,而在灌胃给药1h后血药浓度下降缓慢。经Kinetica 4.4药代动力学软件分析处理,以AIC最小原则为指标,结果表明灌胃给予钩吻素子在大鼠体内药动学符合二室模型(权重 W为1),其主要药物动力学参数如下:计算的达峰时间为(19.95±0.53)min,计算的峰浓度为(0.69±0.03)μg/mL,表观分布容积为(10.45±0.36)L/kg,分 布 相 半 衰 期 为 (7.65±0.47)min,消除相半衰期为(234.11±17.37)min,清除率为(0.031±0.003)L·min-1·kg-1,消除速率常数为(0.011±0.001)min-1,曲线下面积AUC0→t为(142.35±5.86)mg·min·L-1,曲线下面积AUC0→∞为(176.78±7.57)mg·min·L-1。
2.3 钩吻素子在大鼠体内的组织分布 大鼠单次灌胃给予15mg/kg钩吻素子后5,15和60min的组织分布情况见图2。结果显示,钩吻素子组织分布广泛,甚至可分布于脑和睾丸等组织,组织浓度在胃、体脂、肝、肾、脾、小肠较高;分布速度快,给药5min后多数组织浓度已达峰。随后,多数组织中的药物含量随时间推移而下降,但肝脏和小肠含量在给药后15min最高。给药1h后多数组织药物含量较低,特别是骨骼肌和睾丸已低于检测限。

图1 大鼠单次灌胃给予钩吻素子的平均血药浓度-时间曲线Fig 1 Mean plasma concentration-time curve of a single intragastric administration of Koumine in rats

图2 大鼠单次灌胃给予钩吻素子的组织分布图Fig 2 Distribution of Koumine in rats after a single intragastric administration
3 讨 论
钩吻素子生物样品的预处理方法,Chen等采用甲醇沉淀的方法[9],笔者则采用溶剂萃取的方法。为建立适宜的生物样品预处理方法,笔者前期考察了蛋白沉淀剂(甲醇、乙腈和丙酮)、萃取溶剂(正己烷、乙醚、乙酸乙酯和氯仿)和血浆样品pH值(pH=7~9,pH=10~12和pH>13)对提取回收率的影响,发现上述3种常见蛋白沉淀剂的提取回收率较低(39.1%~70.6%),特别是甲醇最低(提取回收率仅39.1%±4.1%,RSD:3.6%);溶剂萃取效率较高,尤以乙酸乙酯为高(提取回收率:80.0%±3.3%,RSD:3.0%),因此样品预处理方法选择溶剂萃取的方式;进而考察了pH值的影响,发现pH=10~12时,萃取效率最高(提取回收率:82.3%±2.0%,RSD:1.7%),从而优选建立1.2.1项下的样品预处理方法。
血浆钩吻素子的含量测定方法,Chen等采用超高效液相色谱-质谱(Ultra-performance liquid chromatography-mass spectrometry,UPLC-MS/MS)法[9],本研究则采用HPLC法,尽管前者保留时间较短(2.6min),本法保留时间相对长些,但9.2min仍可接受;前者检测限稍低(0.025μg/mL),本法(0.06μg/mL)虽高于前者,但仍在同一数量级,而且对于初步血药浓度检测已满足;本法线性(范围:0.06~10μg/mL,相关系数:0.999 3)与前者(范围:0.025~15μg/mL,相关系数:0.999 7)相当,但本法精密度(日内和日间精密度RSD分别为3.8%~4.2%和5.0%~8.8%)优于前者(日内和日间精 密度 RSD 分 别 为4.8%~8.7%和6.7%~14.1%),本法提取回收率(80.0%~83.6%)也优于前者(70.0%~78.9%);前者对仪器要求高,需要有UPLC和MS仪器,设备和耗材昂贵,而本法所需HPLC色谱仪-紫外检测器属常规仪器,因此本法易于广泛应用。
组织钩吻素子的含量测定方法,本研究系在血浆样品测定方法上优化而来。用血浆样品的色谱条件检测组织样品,发现组织内源性物质可干扰钩吻素子的检测,通过降低甲醇的比例,流动相从甲醇∶水∶氨水=55∶45∶0.05(V/V)改为甲醇∶水∶氨水=45∶55∶0.05(V/V),可提高钩吻素子的分离度,避免内源性杂质的干扰。杨樱等报道HPLC测定大鼠肝微粒体中钩吻素子含量的方法,但该方法保留时间约为40min,等待时间长,所用流动相为乙腈∶0.1%三乙胺=20∶80(V/V),其中乙腈毒性较高,三乙胺虽可以作为扫尾剂减少峰拖尾,但也增加了分析方法的复杂性和损伤色谱柱的可能性[10-11]。本法保留时间约20min,时间短,流动相为甲醇∶水∶氨水=45∶55∶0.05(V/V),毒性较低,且本法可用于测定机体大多数组织钩吻素子的含量,因此本法更优。
利用本研究建立的血浆钩吻素子含量HPLC检测法,进行钩吻素子单次灌胃给予大鼠的体内药动学研究,观察到钩吻素子在大鼠体内药动学符合二室模型,达峰时间短,提示钩吻素子的吸收迅速,起效快;表观分布容积大,提示钩吻素子广泛分布,与实际组织分布测定的结果相吻合;消除半衰期约为4h,与笔者所在课题组观察到钩吻素子单次用药对神经病理性疼痛模型大鼠的镇痛持效时间5.5h相接近(另文报道)。本研究报道的单次灌胃给予大鼠15mg/kg钩吻素子的药动学参数与Chen等单次静脉注射给予大鼠20mg/kg钩吻素子的药动学参数比较[9],Ke较接近,但半衰期和表观分布容积数据有差异,本研究为(234.11±17.37)min和(10.45±0.36)L/kg,Chen等为(42.9±18.9)min和(3.646±1.950)L/kg。数值差异原因推测可能有以下几个方面:(1)动物来源不同;(2)给药剂量不同;(3)拟合模型不同,本研究采用二室模型,Chen等采用非房室模型。利用本研究测得灌胃给药钩吻素子的AUC0→∞(176.78mg·min·L-1)和Chen等测得静脉注射钩吻素子的 AUC0→∞(352.071mg·min·L-1),按绝对生物利用度(F)的计算公式:F=(AUC口服×静脉注射剂量)÷(AUC静脉×口服剂量)×100%,估算钩吻素子口服给药的生物利用度为66.95%,提示钩吻素子可能具有首过消除。
利用本研究建立的组织钩吻素子含量HPLC检测法,进行钩吻素子单次灌胃给予大鼠的组织分布研究,结果显示钩吻素子分布迅速且广泛,这与大多数生物碱表观分布容积较大的特点是相符的[12]。组织分布量以胃、小肠、肝和脾为高,即消化系统的分布较高,这可能是钩吻素子对消化道肿瘤有较好治疗作用的药动学基础[6,13]。特别注意到脑组织有钩吻素子的分布且消除相对较慢,提示钩吻素子可以透过血脑屏障,而且在中枢浓度可以维持较恒定,提示钩吻素子可能具有中枢性作用,这与本课题组报道钩吻素子具有显著的抗神经病理性疼痛、抗焦虑效应是相吻合的[4-5]。钩吻素子在其他组织消除快,提示钩吻素子可能不易产生在组织中的蓄积中毒。
综上所述,本研究报道了HPLC法测定生物样品钩吻素子含量的方法,该方法稳定、可靠、易于广泛应用;在此基础上观测获得钩吻素子口服药动学参数和组织分布研究资料,为可能的钩吻素子新药创制提供科学依据。
:
[1] 刘 浩,俞昌喜.钩吻的研究进展[J].福建医科大学学报,2008,42(5):469-472.
[2] 苏燕评,郑 宓,俞昌喜.pH区带精制逆流色谱制备钩吻素子工艺参数的研究[J].福建医科大学学报,2011,45(4):254-256,260.
[3] Su Y P,Shen J,Xu Y,etal.Preparative separation of alkaloids fromGelsemiumelegansBenth.using pH-zone-refining counter-current chromatography[J].JChromatogrA,2011,1218(23):3695-3698.
[4] Xu Y,Qiu H Q,Liu H,etal.Effects of koumine,an alkaloid ofGelsemiumelegansBenth.,on inflammatory and neuropathic pain models and possible mechanism with allopregnanolone[J].PharmacolBiochemBehav,2012,101(3):504-514.
[5] Liu M,Huang H H,Yang J,etal.The active alkaloids ofGelsemiumelegansBenth.are potent anxiolytics[J].Psychopharmacology(Berl),2013,225(4):839-851.
[6] 黄 静,苏燕评,俞昌喜,等.钩吻生物碱化合物体外抗消化系统肿瘤的活性[J].海峡药学,2010,22(3):197-200.
[7] Dutt V,Thakur S,Dhar V J,etal.The genusgelsemium:an update[J].PhcogRev,2010,4(8):185-194.
[8] 蔡 晶,王万山,雷林生,等.钩吻素子对小鼠抗应激作用的实验研究[J].广州中医药大学学报,2007,24(4):317-319.
[9] Chen J Z,Li Y,Xiao J P,etal.Development of a sensitive and rapid UPLC-MS/MS method for the determination of koumine in rat plasma:application to a pharmacokinetic study[J].BiomedChromatogr,2013,27(6):736-740.
[10] 苏 坦.三乙胺对色谱柱的影响及解决方案[J].中国中医药咨讯,2010,2(1):109.
[11] 杨 樱,陈建忠,吴水生,等.钩吻素子在猪及大鼠肝微粒体中代谢表征的研究[J].福建中医药大学学报,2012,22(2):47-49.
[12] 郭 涛.新编药物动力学[M].北京:中国科学技术出版社,2005:345-346.
[13] 蔡 晶,雷林生,迟德彪.钩吻素子对小鼠H22实体瘤抑制作用的实验研究[J].南方医科大学学报,2009,29(9):1851-1852,1856.
