胃癌细胞系SGC-7901肿瘤干细胞样细胞的分离和鉴定
2013-09-27许扬梅龚福生陈雪芳郑秋红
许扬梅,龚福生,陈雪芳,郑秋红
近年研究表明,肿瘤是一种干细胞疾病,在多种实体瘤及其衍生肿瘤细胞系中已经发现了肿瘤干细胞的存在,胃癌干细胞的研究虽进展缓慢但逐渐受到重视[1]。Li和She等运用Side Population(SP)法证明了不同胃癌细胞系中SP细胞的干细胞特性[2-3]。Chen等发现CD44阳性胃癌细胞具有干细胞特性[4]。Jiang等发现CD90胃癌细胞能形成悬浮细胞球,有成瘤能力,并对靶向药物曲妥珠单抗敏感[5]。Liu发现胃癌悬浮细胞球具有肿瘤干细胞特征[6]。上述研究提示胃癌干细胞的存在。本实验采用悬浮细胞法和SP 2种方法来证明胃癌干细胞特性,并采用基因芯片技术筛选胃癌干细胞相关标志物,3种方法相互支持、验证,为胃癌干细胞的研究提供依据。
1 材料与方法
1.1 材料
1.1.1 试剂 1640培养基及B27(美国Gibico公司)、10%胎牛血清(FBS)、DMEM/F12培养基(美国Hyclone公司),碱性成纤维细胞生长因子(bFGF,美国Peprotech公司)、表皮生长因子(EGF,美国Peprotech公司),胰岛素及胰酶(美国Sigma公司),琼脂粉(北京邦定生物公司),RFQ-PCR实验试剂E.Coli polyA polymerase(NEB)、M-MLV Reverse Transcriptase(美国Promega公司),SYBR?Premix Ex TaqTMII(日本Takara公司),华联表达谱基因芯片(上海康成生物工程)。
1.1.2 动物 雌性NOD/SCID鼠[上海实验动物中心,许可证号SYXK(闽)2008-0001],鼠龄4~5周,体质量20~23g,自由饮食。
1.1.3 细胞株和细胞培养 人胃癌细胞系SGC-7901(上海细胞所)复苏后用含10%的小牛血清1640培养基培养,3d换液1次,在37℃、体积分数为0.05的CO2培养箱中培养。细胞达80%融合时以0.25%胰酶消化、传代。按照bFGF 10ng/mL、EGF 20ng/mL、B27 10μL/mL和胰岛素5μg/mL的剂量,将各种生长因子加入到经过滤除菌的DMEM/F12培养基中配成无血清培养基。胰酶消化的单细胞离心洗涤,重悬于无血清培养基进行悬浮细胞球的培养。
1.2 方法
1.2.1 流式细胞术检测SP侧群细胞 取对数生长期的贴壁细胞和悬浮细胞球,分别制备成浓度为1×106mL-1的单细胞悬液,实验组加入5μg/mL的荧光染料 Hoechst33342,对照组5μg/mL加入Hoechst33342和 50μmol/L维拉帕米(Verapamil),置于37℃水浴锅孵育90min,每隔30min震荡混匀1次。1 200r/min低速离心,弃上清,2mL PBS重悬,400目筛网过滤,检测前加碘化丙啶染色标记死亡细胞。采用Moflo XDP高端流式细胞仪,紫外激发光检测。Hoechst33342阴性或弱阳性为SP 细 胞,Hoechst33342 阳 性 为 Non-SP(NSP)细胞。
1.2.2 悬浮细胞球自我更新能力 以贴壁细胞作为对照组,用0.25%胰酶分别消化悬浮细胞球和贴SGC-7901细胞成单个细胞,台盼蓝染色作活细胞记数后,用无血清培养基分别稀释瘤细胞悬液至103mL-1。混匀后,用移液枪将两种细胞悬液分别转移到96孔板内,每组各20孔,每孔100μL即平均每孔含100个细胞。每孔分别再添加100μL的无血清培养基,静置培养。每隔2d添加25μL培养基,7d后记数每孔形成细胞球数。
1.2.3 NOD/SCID鼠皮下成瘤实验 0.25%胰酶消化处于对数生长期的贴壁细胞和悬浮细胞球,台盼蓝染色作活细胞记数。离心后重悬于生理盐水中并计数,配成浓度为5×102,5×103,5×104,5×105mL-1的细胞悬液。同一批次购买的NOD/SCID鼠20只,每1个细胞浓度注射5只,在其左右腋窝皮下分别注射贴壁细胞和悬浮细胞悬液各0.2mL。观察小鼠的生活状况及局部肿瘤生长情况。6周后颈部脱臼处死,解剖并观察肿瘤的数目和大小。10%福尔马林固定肿瘤块24h。石蜡包埋,常规切片并H-E染色。
1.2.4 基因芯片检测 悬浮球和贴壁细胞分别提取总RNA,质检合格的RNA按华联表达谱基因芯片操作要求进行标本预杂交、探针标记、杂交和洗片。用ScanArray 4000扫描仪扫描图像,GenePix-Pro 3.0图像软件进行处理,数据按筛选标准进行均一化处理,计算出各基因点贴壁细胞与悬浮细胞球的差异表达Ratio值=cy5cy3,以Ratio<0.5为表达下调,0.5~2.0为非差异表达,>2.0为表达上调。
1.2.5 实时荧光定量PCR分析 将质检合格的贴壁细胞和悬浮细胞球总RNA分别逆转录合成cDNA,再将两样品的目的基因以及管家基因进行扩增,其产物进行梯度稀释作标准曲线,后将标准曲线样品和待测样品加入到含SYBR Green荧光染料反应体系中,在 Rotor-Gene 3000Real-time PCR仪上进行实时定量扩增。检测结果用管家基因进行校正。引物序列和反应温度见表1。

表1 引物序列和反应温度Tab 1 Primer sequence and annealing temperature
1.3 统计学处理 计量资料采用±s表示,SPSS 11.5统计软件处理数据。P<0.05为差别具有统计学意义。
2 结 果
2.1 无血清培养基培养胃癌SGC-7901细胞SGC-7901细胞用无血清培养基培养7d后,大部分细胞死亡,小部分细胞继续贴壁生长,(8.00±0.54)%的单个细胞可以悬浮生长并增殖形成细胞球(图1)。
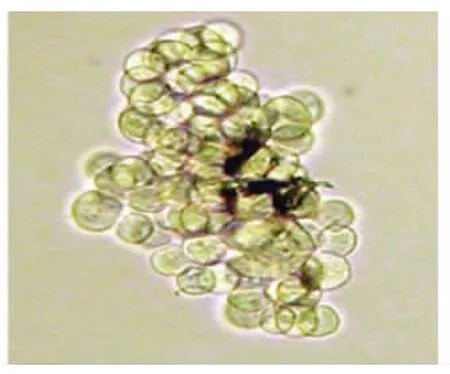
图1 单个细胞形成的悬浮细胞球(SP ×400)Fig 1 A floating sphere formed from a single(SP ×400)
2.2 SP侧群细胞检测 流式细胞仪检测结果显示染料Hoechst33342加拮抗剂Verapamil组SP细胞含量明显下降,细胞外排染料的能力被Verapamil阻滞。悬浮细胞球中SP细胞占(12.34±1.01)%,而贴壁细胞中SP占(0.62±0.05)%,即悬浮球比贴壁细胞富集SP细胞(图2)。
2.3 悬浮球细胞自我更新 100个贴壁细胞在无血清培养基中可形成(9.75±1.85)个细胞球,而100个悬浮细胞球细胞形成的细胞球数则是(31.42±6.13),明显多于贴壁细胞组,差别有统计学意义(P<0.05)。
2.4 NOD/SCID小鼠成瘤实验 悬浮细胞球组在1×103个细胞的注射剂量能使3只小鼠致瘤,而贴壁细胞不能致瘤。在1×105个细胞的注射剂量时,悬浮细胞球组能使5只小鼠全部致瘤,而贴壁细胞只能使2只小鼠致瘤。悬浮细胞球比贴壁细胞具有更强的肿瘤形成能力(表2)。

表2 NOD/SCID鼠成瘤情况Tab 2 NOD/SCID mice tumor formation
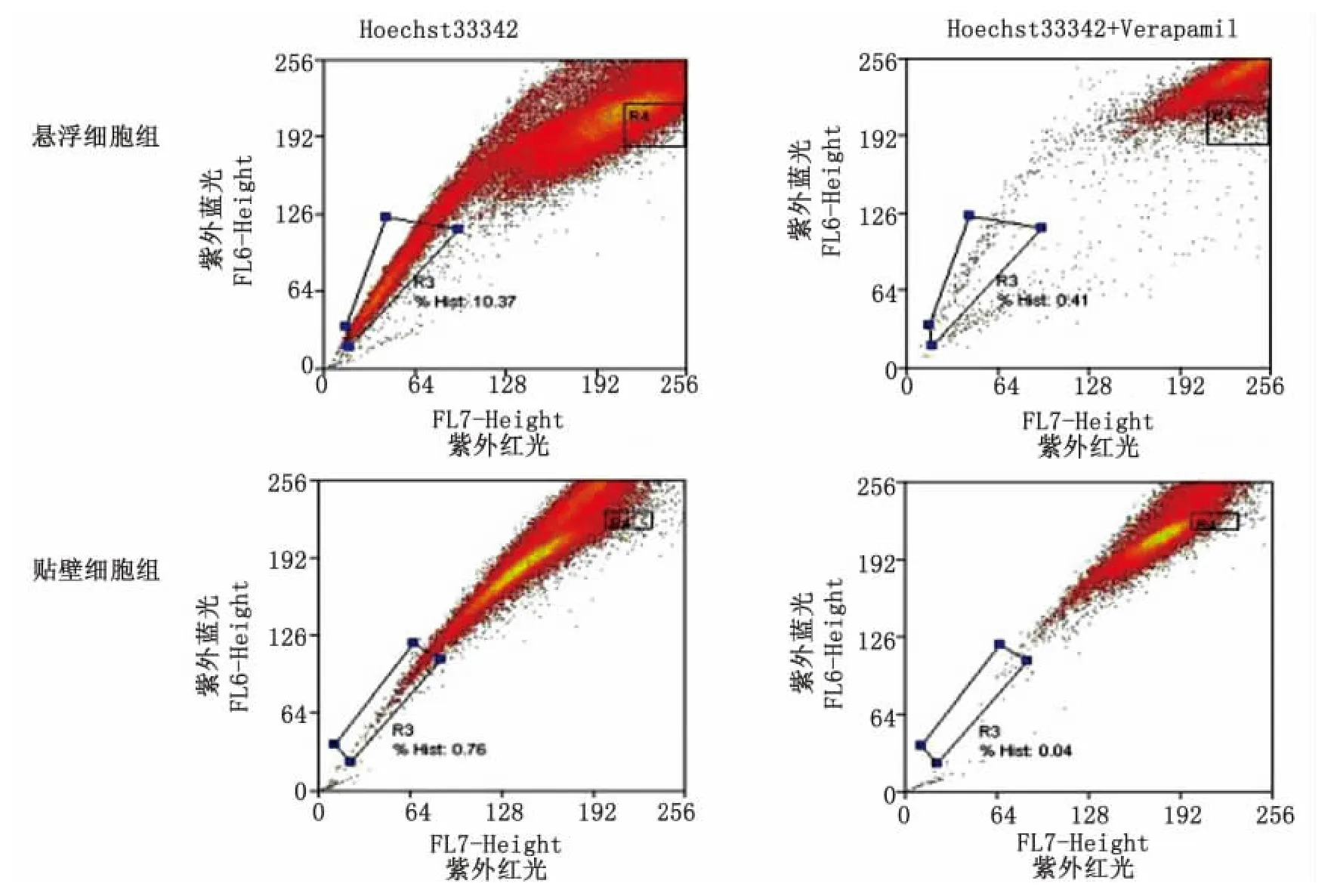
图2 悬浮细胞球与贴壁细胞组SP含量检测Fig 2 SP test by flow cytometry
2.5 H-E染色结果 贴壁细胞和悬浮细胞球在NOD/SCID鼠形成的肿瘤其形态学无明显差异,两者都可见形态异常的肿瘤细胞,核大、深染,可见病理性核分裂相。肿瘤分化程度底,但仍可见少许腺体结构(图3)。
2.6 基因芯片检测结果 本实验使用的全人类基因组芯片共包含30 968个基因探针。结果显示:悬浮细胞球组表达上调2倍以上的基因共有358个,但是已知基因只有297个(图4)。运用David生物信息学系统分析,发现这297个基因大部分与代谢过程、蛋白黏附以及细胞器等有关。悬浮细胞球高表达3个干细胞相关基因,分别是ABCG2、HES1和KRT15(表3)。
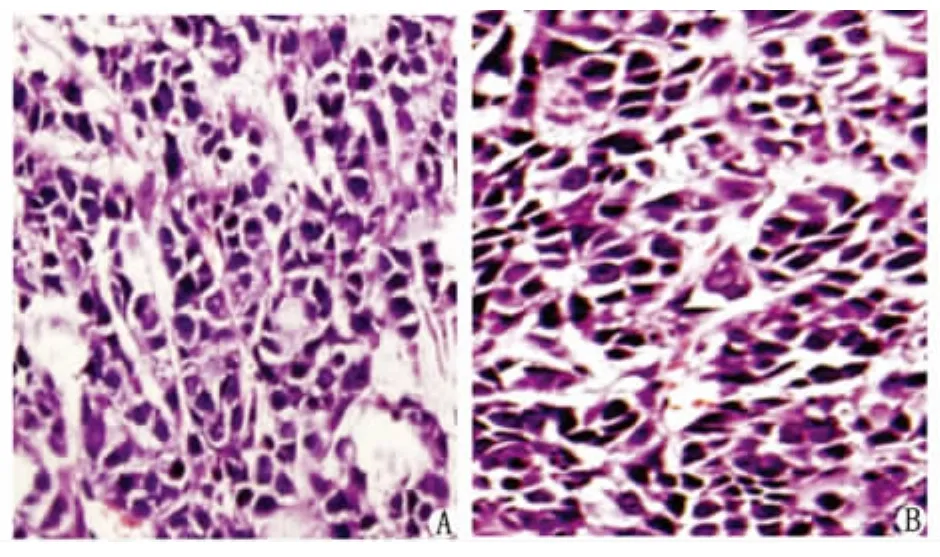
图3 NOD/SCID鼠肿瘤标本H-E染色(SP ×400)Fig 3 H-E staining of tumor formed in NOD/SCID mice(SP ×400)

表3 悬浮细胞球组表达上调2倍以上的干细胞相关基因Tab 3 Up-regulated genes in floating spheres
2.7 实时荧光定量PCR检测结果 在基因芯片检测结果的基础上,挑选出ABCG2、HES1、KRT15和CD44共4个基因进行实时荧光定量PCR检测。采用实时荧光定量PCR相对定量法,最终得到的是样品待测基因的相对含量(表4)。结果可见ABCG2、HES1、KRT15在悬浮细胞球中高表达,CD44表达无差异。实时荧光定量PCR与基因芯片结果基本一致。
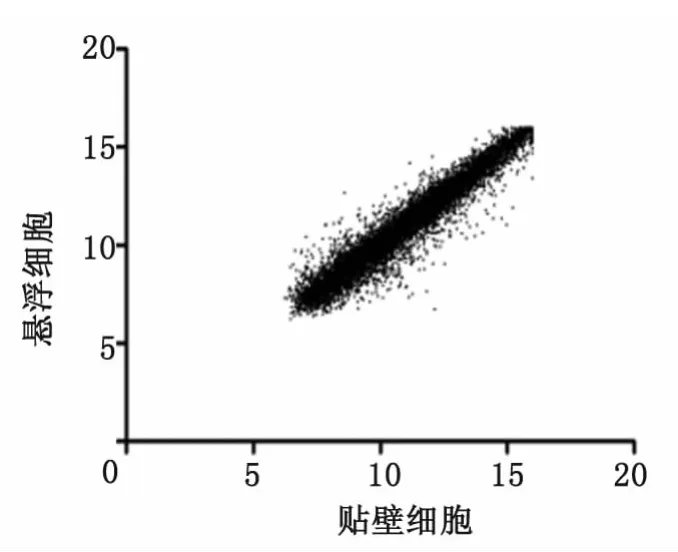
图4 悬浮球与贴壁细胞基因表达相关性散点图Fig 4 Scatter picture of log2(fluorescence signal)of floating spheres and adherent cells

表4 实时荧光定量PCR检测结果Tab 4 RFQ-PCR data
3 讨 论
运用特定的细胞表面标志物和悬浮细胞球培养法,许多学者已经证明了胃癌干细胞的存在[1-6]。但其来源还有待进一步的研究证实。研究提示,胃癌干细胞可能来源于胃干细胞或是骨髓干细胞[1]。本实验运用无血清培养基体外悬浮法和SP侧群细胞2种方法在胃癌细胞系SGC-7901证明了具有胃癌干细胞特性的细胞,因没有证明其全能性和多向分化能力,故称为胃癌干细胞样细胞。无血清培养基体外悬浮法是肿瘤干细胞培养的主要方法,应用在神经、乳腺等多种干细胞和相应的肿瘤干细胞的培养。在胃癌干细胞的培养中也是常用的方法。本实验中,(8.00±0.54)%的SGC-7901细胞能形成悬浮细胞球,为了证明悬浮细胞球细胞是否具有肿瘤干细胞的特性,进而检测悬浮细胞球中SP细胞的含量。
SP细胞被认为是具有肿瘤干细胞特性的细胞,在多种肿瘤中已经证实SP细胞的存在。但是不同的学者对于SP细胞的干细胞特性意见不同。Zhang研究结果表明并不是所有的胃肠道肿瘤的SP细胞都富集干细胞[7]。SP法的原理依赖细胞膜表面ABC转运子蛋白将染料泵出细胞外,所以保持恒定的细胞生理功能至关重要。细微的实验条件改变会引起细胞生理功能的改变,包括孵育时间、震荡间隔、实验细胞的培养天数和染料的浓度等均会影响SP含量,这可能是导致实验结果不一致的原因之一[8]。在严谨的实验条件下,结果显示悬浮细胞球SP含量远高于贴壁细胞组。
利用细胞膜表面标记物来分离和鉴定肿瘤干细胞是一个重要的研究方法。为寻找可以作为胃癌干细胞的标记物,本实验利用基因芯片技术检测悬浮和贴壁细胞的基因表达谱,寻找差异表达基因。实验结果经实时荧光定量PCR检测验证,发现悬浮细胞高表达干细胞相关的基因ABCG2、HES1和KRT153。其中只有ABCG2是膜表面蛋白,属于ABC(ATP Binding Cassette)超家族成员,是一种多药耐药相关的膜转运蛋白。ABCG2/BCRP1具有将Hoechst33342泵出细胞外的特性,SP表型与ABCG2有关。She和Jiang等的研究认为在胃癌中ABCG2与细胞分化、化疗抵抗有关,具有干细胞特性[3,9]。悬浮细胞球具有干细胞的特性,而且悬浮细胞球又富含SP细胞,两者都高表达ABCG2,因此笔者认为ABCG2可以作为胃癌干细胞的潜在标志之一。CD44是胃癌干细胞的标志,但在本实验中表达没有差异。采用流式细胞仪检测悬浮细胞球和贴壁细胞CD44的表达,发现CD44表达都>90%。笔者认为,这种情况与SGC-7901细胞系本身的特性相关,说明该细胞系具有高转移潜能,并不能否定CD44作为胃癌干细胞标志的可能性。
本研究发现悬浮细胞球富集SP细胞,自我更新能力强,具有高致瘤性且高表达干细胞相关标志,从而证明了SGC-7901中胃癌干细胞样细胞的存在。但是不足之处在于采用的是细胞系而非肿瘤组织。在后续实验中,拟采用胃癌组织标本进行悬浮培养以及干细胞标志物ABCG2和CD44等的检测,希望可以为胃癌干细胞的研究提供参考依据。
:
[1] Han M E,Oh S O.Gastric stem cells and gastric cancer stem cells[J].AnatCellBiol,2013,46(1):8-18.
[2] Li R,Wu X,Wei H,etal.Characterization of side population cells isolated from the gastric cancer cell line SGC-7901[J].OncolLett,2013,5(3):877-883.
[3] She J J,Zhang P G,Wang X,etal.Side population cells isolated from KATO III human gastric cancer cell line have cancer stem cell-like characteristics[J].WorldJGastroenterol,2012,18(33):4610-4617.
[4] Chen T,Yang K,Yu J,etal.Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients[J].CellRes,2012,22:248-258.
[5] Jiang J,Zhang Y,Chuai S,etal.Trastuzumab(herceptin)targets gastric cancer stem cells characterized by CD90phenotype[J].Oncogene,2012,31:671-682.
[6] Liu J,Ma L,Xu J,etal.Spheroid body-forming cells in the human gastric cancer cell line MKN-45possess cancer stem cell properties[J].IntJOncol,2013,42(2):453-459.
[7] Zhang H,Xi H,Cai A,etal.Not all side population cells contain cancer stem-like cells in human gastric cancer cell lines[J].DigDisSci,2013,58(1):132-139.
[8] Mo S L,Li J,Loh Y S,etal.Factors influencing the abundance of the side population in a human myeloma cell line[J].BoneMarrowRes,2011,52:2148-2157.
[9] Jiang Y,He Y,Li H,etal.Expressions of putative cancer stem cell markers ABCB1,ABCG2,and CD133are correlated with the degree of differentiation of gastric cancer[J].Gastric Cancer,2012,15(4):440-450.
