伏立康唑片在中国健康男性体内的生物等效性研究
2013-09-27邱学文向荣凤熊丽蓉欧阳净蔡永青王显凤陈勇川重庆市西南医院药剂科重庆400038
邱学文,杨 波,向荣凤,戴 青,熊丽蓉,欧阳净,蔡永青,刘 芳,王显凤,陈勇川(重庆市西南医院药剂科,重庆400038)
伏立康唑(voriconazole)是第二代三唑类抗真菌药,为氟康唑的衍生物,具有抗菌谱广、生物利用度高、安全且可通过血脑屏障等特点。临床上主要用于治疗急性或慢性深部真菌感染、侵袭性去霉菌病、新型隐球菌性脑膜炎,对氟康唑耐药的严重侵入性念珠菌病感染(包括克鲁斯念珠菌)以及由足放线菌属和镰刀菌属引起的严重真菌感染[1-3],还可以用于预防侵入性真菌感染免疫功能低下的患者[4-5]。伏立康唑的抗菌机制为抑制真菌细胞色素P450介导的14α-甾醇的去甲基作用,从而抑制真菌麦角甾醇的合成,导致真菌细胞膜合成不足[6-7]。
伏立康唑口服吸收迅速,达峰时间为1 ~ 2 h,生物利用度96%,食物可影响其吸收,在餐前1 h或餐后2 h服用,药物的吸收增加。体内代谢呈非线性药动学特性,即本品药动学的个体差异很大。随给药剂量增加,药物曲线下面积(AUC)成比例增加,但在儿童体内,伏立康唑代谢表现为线性药动学特性,即如果要达到相同的药物浓度,需服用较高剂量[8]。伏立康唑主要在肝脏通过细胞色素P450同工酶CYP2C19进行代谢。代谢物主要经尿液排泄,小于5%的药物以原型随尿液排出。伏立康唑的蛋白结合率约为58%,肝肾功能不全对伏立康唑的蛋白结合率无影响[8]。本试验主要研究国产伏立康唑片与进口伏立康唑片在中国健康成年男性志愿者中的药动学参数和相对生物利用度,以评价两者的生物等效性,为临床合理用药提供理论依据。
1 仪器与试剂
液相色谱系统包括紫外检测器,四元输液泵,自动进样器,切换阀及数据采集和处理系统(美国Agilent公司);高速离心机(美国Abbott公司);超纯水器(MiLLi-Q plus,USA,MiLLipore公司);KQ-400KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司);振荡器(IKA-VORTEX)。
伏立康唑对照品(批号:100862-200701,中国药品生物制品检定所);卡马西平对照品(内标,批号:100142-201004,中国药品生物制品检定所);受试制剂:伏立康唑片(200 mg/片,批号:100302,成都华神集团股份有限公司制药厂);参比制剂:伏立康唑片(200 mg/片,批号:B10002040,美国辉瑞公司);甲醇、乙腈为色谱纯;三乙胺(分析纯,成都化学试剂厂);冰醋酸(分析纯,重庆川东化工(集团)有限公司);空白血浆由西南医院血库提供。
2 方法与结果
2.1 色谱条件
色谱柱为Diamonsil C18(2)柱(250 mm×4.6 mm,5 μm);柱温:35 ℃;流动相为乙腈-水-冰醋酸-三乙胺 = 42∶58∶0.1∶0.05;流速:1.4 mL·min-1;检测波长:256 nm;进样量:20 μL。
2.2 受试者选择
健康男性志愿者20名,试验过程中1名受试者主动退出,共19名受试者完成此次试验。受试者年龄(22.6±2.3)岁,身高(170.8±4.7) cm,体重(58.1±10.6) kg,试验前进行体格检查,血尿常规、肝肾功能、心率、血压和心电图等检查均正常;试验者既往体健,无药物过敏史,无吸烟、嗜酒及经常用药史。2周内未服用任何可能影响本品吸收、代谢的药物。试验期间统一清淡饮食,不使用除受试制剂和参比制剂以外的任何药物,不接受烟、酒及含咖啡的饮料,避免剧烈运动。受试者试验前签署知情同意书,本试验方案经重庆西南医院医学伦理委员会审核批准。
2.3 试验方案
参照《化学药物制剂人体生物利用度和生物等效性研究技术指导原则》,采用双周期自身随机交叉试验设计,每组受试者每次试验时分别服用伏立康唑片受试制剂或参比制剂。受试者于试验前1 d晚餐后,禁食不禁水12 h,次日清晨空腹分别单剂量口服含伏立康唑200 mg的受试制剂或参比制剂,以200 mL温开水送服,并作记录。服药2 h后可自由饮水,服药4 h后进统一标准餐。试验期间由医护人员进行监护。间隔7 d后交叉给药,重复上述试验。分别于服药前0 h和服药后0.25、0.5、0.75、1、1.5、2、3、4、6、8、12、24、36 h由前臂肘静脉取血4 mL。血样置于肝素化的离心管中,3000 r·min-1离心5 min,分离出血浆,置- 30 ℃冰箱中保存备用。
2.4 标准溶液的制备
精密称取伏立康唑对照品10.0 mg,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度获得浓度为1 mg·mL-1的储备液,- 30 ℃冰箱内保存备用。精密称取卡马西平对照品10.0 mg,置于10 mL容量瓶中,用甲醇溶解并稀释至刻度获得浓度为1 mg·mL-1的内标储备液,在- 30 ℃冰箱内保存备用,用时配成20 μg·mL-1工作液。
2.5 血浆样品处理
取待测血浆0.8 mL,加入20 μL内标标准溶液(20 μg·mL-1),混匀30 s,再加入100 μL 1.0 mol·L-1NaOH,混匀30 s,再加入3.2 mL乙酸乙酯:正己烷(4∶1),混匀3 min,3000 r·min-1离心5 min,取上层有机相于60 ℃水浴N2吹干,残渣用200 μL流动相溶解,混匀1 min,13 000 r·min-1离心5 min,取上清液20 μL进样分析。
2.6 专属性考察
分别取6份来自不同个体的空白血浆0.8 mL,除不加标准溶液外,其余按“血浆样品处理”项下操作,进行HPLC分析得空白血浆样品的色谱图1A,将一定浓度的标准溶液加入空白血浆中,同法操作得相应的色谱图1B,结果表明,空白血浆中的内源性物质不干扰伏立康唑和卡马西平的测定。
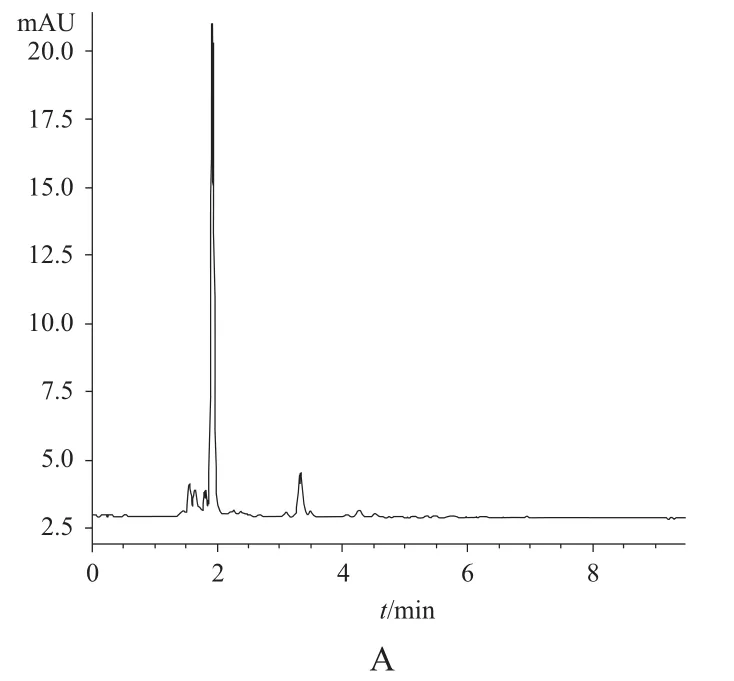

图1 典型的高效液相色谱图
2.7 标准曲线
取7份空白血浆,加入伏立康唑标准溶液(1 mg·mL-1)适量,使浓度为20 μg·mL-1,再依次用空白血浆稀释成2000,1000,500,200,100,50,20 ng·mL-1,按上述样品处理方法操作,记录色谱图。以待测物浓度为横坐标,待测物与内标的峰面积比值为纵坐标,进行回归运算,得直线回归方程y= 0.670 1x- 0.000 9,r=0.999 8,表明本方法在20 ~ 2000 ng·mL-1范围内线性关系良好。本方法最低定量限20 ng·mL-1。
2.8 精密度与回收率实验
按“标准曲线和定量下限”项下的方法配制低(50 ng·mL-1)、中(200 ng·mL-1)、高(1600 ng·mL-1)三个浓度的伏立康唑样品,按样品处理方法处理,在一日内每一浓度进行5样本分析,计算本法的日内精密度与相对回收率;同时,每一浓度进行5样本分析,连续测定3 d,计算本法的日间精密度;根据血浆中伏立康唑、卡马西平的峰面积与相同浓度标准溶液直接进样测得的伏立康唑、卡马西平的峰面积之比计算其绝对回收率。具体结果见表1。

表1 精密度及回收率实验结果Tab 1 Results of precision and recovery test
2.9 数据处理
受试制剂与参比制剂的Cmax和tmax均以实测值表示;AUC0-t以梯形法计算;AUC0-∞按公式计算:AUC0-∞= AUC0-t+Ct/λz(t为最后一次可实测血药浓度的采样时间;Ct为末次可测样本药物浓度;λz为对数药-时曲线末端直线部分求得的末端消除速率常数);t1/2= 0.693/λz。以各个受试者服用受试制剂与参比制剂的AUC0-t分别计算其相对生物利用度,F=AUC受试制剂/AUC参比制剂×100%。主要药动学参数经对数转换后以多因素方差分析(ANOVA)进行显著性检验,然后用双单侧t检验和计算90%置信区间的统计分析方法来评价和判断药物间的生物等效性。药动学基本参数的计算与统计学检验分析借助DAS Ver 3.0软件完成。
2.10 血药浓度测定结果及药动学参数
19名受试者口服伏立康唑片受试制剂或参比制剂200 mg后的平均药-时曲线见图2,主要药动学参数见表2。对同一受试者服用两种制剂的药动学参数进行配对t检验,差异均无统计学意义(P> 0.05)。以参比制剂为对照,受试制剂的相对生物利用度为(100.5±3.4)%。

图2 19名健康志愿者单剂量口服伏立康唑片受试制剂或参比制剂后的平均药-时曲线Fig 2 Mean plasma concentration-time curves of voriconazole in 19 healthy volunteers after single oral dose of voriconazole tablets
2.11 生物等效性评价
受试制剂和参比制剂的Cmax、AUC经对数转换后进行方差分析,并进一步采用双单侧t检验和(1-2α)置信区间法进行生物等效性评价,tmax采用非参数检验法。伏立康唑的AUC0-t、AUC0-∞和Cmax均拒绝生物不等效假设(P> 0.05);受试制剂的Cmax、AUC0-t、AUC0-∞的90%置信区间分别为参比制剂相应参数的73.7% ~ 109.5%、92.4% ~ 116.5%和93.3% ~ 115.6%;非参数检验结果显示,两种制剂的tmax差异无统计学意义(P> 0.05)。以上结果表明两种制剂具有生物等效性。

表2 19名健康志愿者单剂量口服伏立康唑片受试制剂或参比制剂后的主要药动学参数Tab 2 Main pharmacokinetic parameters of voriconazole in 19 healthy volunteers after single oral dose of voriconazole tablets
2.12 不良事件
整个试验过程由经《药物临床试验管理规范》(GCP)培训的临床医师和护士进行观察,19名受试者在服用含伏立康唑200 mg的受试制剂或参比制剂后均无不适主诉,亦未观察到不良事件。
3 讨论
本试验中,19例健康男性受试者双周期随机交叉单剂量口服试验制剂和参比制剂, 服药剂量均为200 mg。试验结果表明,口服给药后,试验制剂和参比制剂在健康志愿者的体内过程非常接近,主要药动学参数差异无统计学意义(P> 0.05),单次口服试验制剂的伏立康唑片平均相对生物利用度为(102.9±15.3)%,双单侧t检验和(1-2α)置信区间检验表明两种制剂具有生物等效性。
本次研究结果与高洪志等[9]的研究比较,参比试剂和受试制剂的达峰时间tmax和半衰期值相近,Cmax和AUC0-∞相差约1.7倍。分析差异的原因可能是由于本次研究的受试者年龄为(22.6±2.3)岁,而高洪志等研究中受试人群相比年龄较小,故受试者代谢快,Cmax和AUC0-∞较小;另外,高洪志等的研究采用的是中国北方的受试者,而本次研究招募的是西南地区的受试者,地域分布的原因也可能使Cmax和AUC0-∞较小。Driscoll等[10]研究发现青少年人群达到成年人群相同药物浓度需给予更大的伏立康唑剂量。由于该试验的研究对象均为健康男性,且为单剂量给药,人群范围窄,年龄均较年轻化,故结果不能代表或推断出儿童、老年人群的给药指数。如进一步确认国内人群伏立康唑药动学参数的差异,需增加受试者的病例数,并且考察伏立康唑代谢酶基因型分布及多态性对伏立康唑代谢的影响。
在整个试验过程中,由负责医生于给药前及给药后24 h测量受试者的血压、体温、呼吸、脉博,并在试验结束后进行血液生化、血常规及尿常规检查,结果受试者无不良反应发生,检查指标未见异常,表明试验药物在试验剂量下具有较好的安全性。
[1] Walsh TJ, Anaissie EJ, Denning DW,et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America[J]. Clin Infect Dis, 2008, 46(3): 327-360.
[2] Pappas PG, Kauffman CA, Andes D,et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009,48(5): 503-535.
[3] Lortholary O, Obenga G, Biswas P,et al. International retrospective analysis of 73 cases of invasive fusariosis treated with voriconazole[J]. Antimicrob Agents Chemother, 2010,54(10): 4446-4450.
[4] Marks DI, Pagliuca A, Kibbler CC,et al. Voriconazole versus itraconazole for antifungal prophylaxis following allogeneic haematopoietic stem-cell transplantation[J]. Br J Haematol, 2011,155(3): 318-327.
[5] Wingard JR, Carter SL, Walsh TJ,et al. Randomized, doubleblind trial of fluconazole versus voriconazole for prevention of invasive fungal infection after allogeneic hematopoietic cell transplantation[J]. Blood, 2010, 116(24): 5111-5118.
[6] 申兰慧,石涛,张岩,等. 新一代广谱抗真菌药伏立康唑[J].东南大学学报:医学版,2004,23(1):62-67.
[7] 沈银忠. 伏立康唑的临床合理应用[J]. 世界临床药物,2009,30(12):715-720.
[8] Leveque D, Nivoix Y, Jehl F,et al. Clinical pharmacokinetics of voriconazole[J]. Int J Antimicrob Agents, 2006, 27(4): 274-284.
[9] 高洪志,梁宇光,林丽娜,等. 2种伏立康唑片剂的人体生物等效性研究[J]. 中国新药杂志,2007,16(14):1133-1136.
[10] Driscoll TA, Yu LC, Frangoul H,et al. Comparison of pharmacokinetics and safety of voriconazole intravenous-to-oral switch in immunocompromised children and healthy adults[J].Antimicrob Agents Chemother, 2011, 55(12): 5770-5779.
