HPLC法同时测定感冒清热颗粒中葛根素与胡薄荷酮的含量
2013-09-27郭兴道解放军总医院药品保障中心药检室北京00853河北北方学院河北张家口075000
白 林,郭兴道,任 韡(. 解放军总医院药品保障中心药检室,北京 00853;. 河北北方学院,河北 张家口 075000)
感冒清热颗粒是2010年版《中国药典》收录的品种,主要由荆芥穗、防风、柴胡、葛根等11味中药材组成[1]。对于感冒清热颗粒中葛根素的含量测定,中国药典已有规定,但其中荆芥穗和薄荷中总胡薄荷酮的鉴别及含量测定均未收载,尚无质量控制标准。目前,已有文献[2]报道了测定感冒清热颗粒中荆芥穗、薄荷中总胡薄荷酮的方法。薄荷和荆芥穗是感冒清热颗粒中具有抗病原微生物[3],解热、抗炎、镇痛作用[4]的成分,我们采用HPLC法同时测定感冒清热颗粒中葛根的主要有效成分葛根素、薄荷与荆芥穗中总胡薄荷酮的含量,获得满意效果。
1 仪器与试药
CX-300型超声波清洗机(北京市天海双龙医疗器械有限责任公司);Agilent1200高效液相色谱仪(美国安捷伦科技有限公司,含自动脱气机、VWD检测器、四元梯度泵和化学工作站);UV-2550型紫外分光光度仪(日本岛津)。
葛根素对照品(中国食品药品检定研究院,批号:110752-200209);胡薄荷酮对照品(中国食品药品检定研究院,批号:111706-201004);甲醇为色谱纯;水为重蒸水。
感冒清热颗粒(厂家1,批号:1001171;厂家2,批号:0111428;厂家3,批号:EOF003;厂家4,批号:1001005;厂家5,批号:120103;厂家6,批号:101004;厂家7,批号:100861。规格均为每袋12 g)。
2 方法与结果
2.1 色谱条件
色谱柱Diamonsil C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水梯度洗脱(0 ~ 10 min,甲醇浓度由20%递升至40%;10 ~ 15 min,甲醇浓度由40%递升至75%,15 ~ 20 min甲醇浓度由75%递减至65%,20 ~ 30 min甲醇浓度递减至20%),检测波长252 nm;柱温为40 ℃;流速1.0 mL·min-1;进样量为10 μL。理论塔板数按胡薄荷酮峰计算不低于3000。
2.2 溶液的制备
2.2.1 对照品溶液 取胡薄荷酮对照品约3.929 mg,精密称定,置50 mL容量瓶中,加甲醇溶解并稀释至刻度[5],摇匀,即得胡薄荷酮储备液(78.6 μg·mL-1);取葛根素对照品约0.013 83 g,精密称定,用30%乙醇溶解稀释至25 mL[6],摇匀,即得葛根素储备液(553.2 μg·mL-1)。再取胡薄荷酮储备液、葛根素储备液各8 mL,置50 mL量瓶中,加甲醇至刻度,得到含胡薄荷酮12.573 μg·mL-1、葛根素88.512 μg·mL-1的对照品溶液。
2.2.2 供试品溶液 取感冒清热颗粒适量,研细,取粉末约1 g,精密称定,置具塞锥形瓶中,精密加入20 mL甲醇,称定重量,超声处理30 min,冷却至室温,再称定重量,用甲醇补足减失的重量,摇匀,经0.22 μm有机系微孔滤膜滤过,即得。
2.2.3 阴性对照液 按处方比例称取除葛根、荆芥穗、薄荷以外的其余药味,按感冒清热颗粒制备工艺制成阴性样品,按供试品溶液制备方法制成阴性对照液。
2.3 系统适用性实验
取对照品溶液、供试品溶液、阴性对照液各10 μL,注入液相色谱仪,按“2.1”项下色谱条件测定,典型的色谱图见图1。
2.4 线性关系考察
分别精密吸取对照品溶液并以甲醇为溶剂稀释,得系列标准溶液。含葛根素分别为5.532、11.064、22.128、44.256、88.512 μg·mL-1;含胡薄荷酮分别为0.786、1.572、3.143、6.286、12.573 μg·mL-1,取10 μL注入液相色谱仪,记录色谱图。以峰面积值为纵坐标(Y),进样量为横坐标(X)绘制标准曲线,计算回归方程。葛根素Y= 38.445X+ 13.473,r= 1.000 0;胡薄荷酮Y= 29.912X- 1.808,r= 0.999 9。结果表明,葛根素在5.532 ~ 88.512 μg·mL-1、胡薄荷酮在0.786 ~12.573 μg·mL-1的范围内与峰面积呈良好线性关系。
2.5 精密度实验
按上述色谱条件,精密吸取含葛根素为22.128 μg·mL-1、胡薄荷酮为3.143 μg·mL-1的对照品溶液10 μL,连续重复进样5次,记录葛根素峰面积值分别为874.4,871.6,870.6,872.6,879.5,平均值为873.7,RSD为0.40%(n= 5);胡薄荷酮峰面积值分别为81.5,81.5,81.7,80.8,82.8,平均值为81.7,RSD为0.89%(n= 5)。说明仪器的精密度良好。
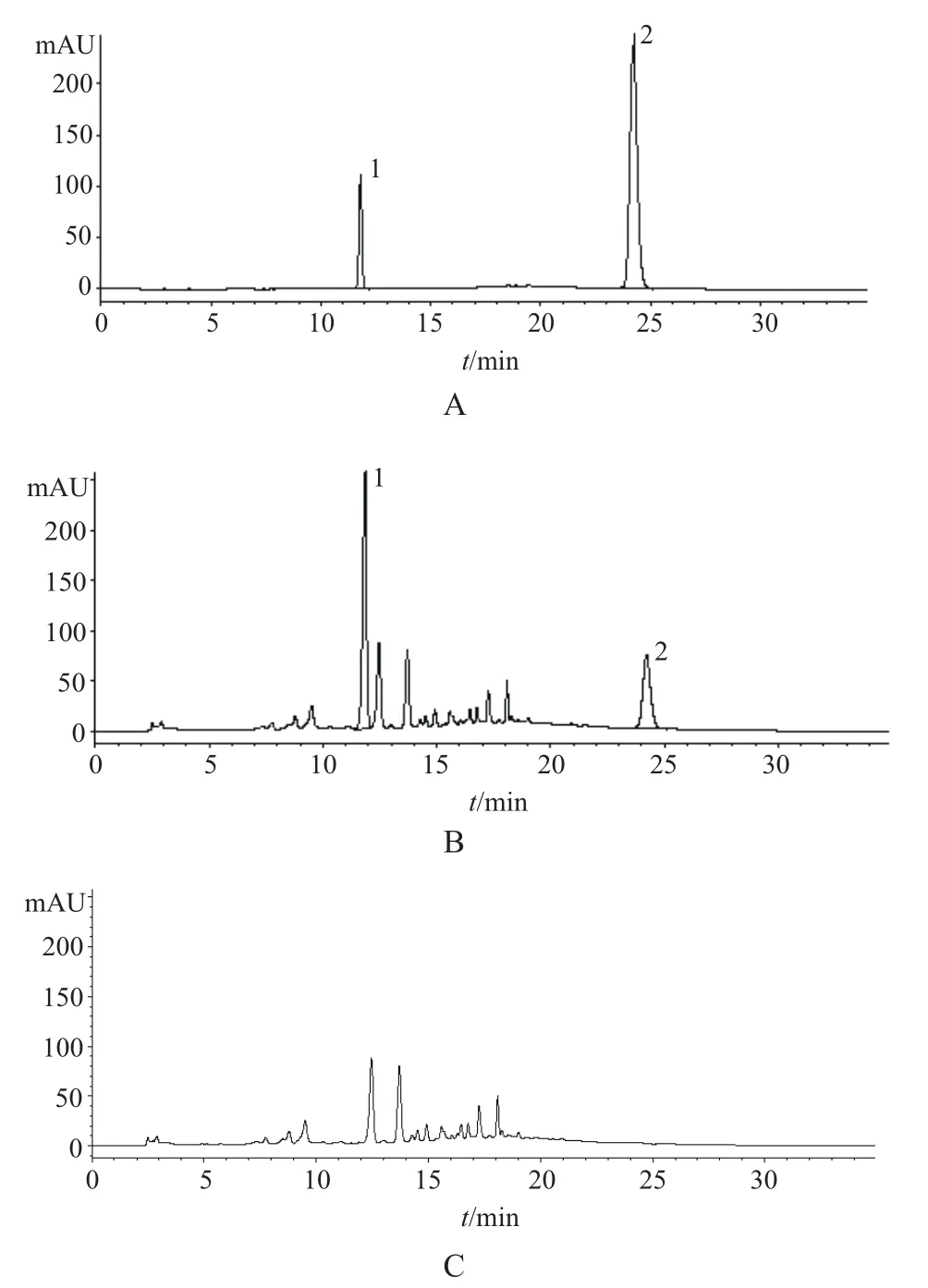
图1 感冒清热颗粒中葛根素和胡薄荷酮的色谱图
2.6 重复性实验
取本品(批号0111428)粉末,按“2.2.2”项下方法制备供试品溶液,按色谱条件检测,精密吸取供试品溶液10 μL,注入色谱仪,共进样5次,记录葛根素峰面积值分别为1 845.6,1 882.2,1 855.7,1 804.5,1 801.1,平均值为1 837.8,RSD为1.89%(n= 5);胡薄荷酮峰面积值分别为124.6,123.4,123.8,123.6,124.1,平均值为123.9,RSD为0.38%(n= 5)。结果表明,本方法重复性良好。
2.7 稳定性实验
取本品(批号0111428)粉末,按“2.2.2”项下方法制备供试品溶液,按色谱条件,精密吸取供试品溶液10 μL,分别在0,4,8,12,16,24 h进样。记录葛根素峰面积值分别为1 845.6,1 855.7,1 804.5,1 801.1,1 825.0,1 807.5,平均值为1 823.2,RSD为1.26%(n=6);胡薄荷酮峰面积值分别为124.6,123.8,123.6,124.1,123.6,123.5,平均值为123.9,RSD为0.34%(n= 6)。结果表明,供试品溶液在24 h内基本稳定。
2.8 回收率实验
2.8.1 葛根素回收率 取6份已知含量的感冒清热颗粒(批号0111428)内容物适量,研细,每份约0.1 g,精密称定,分别加入编号1 ~ 6的具塞锥形瓶中,分别精密加入0.4 mL葛根素对照品储备液(浓度553.2 μg·mL-1),再精密加入19.6 mL甲醇,按供试品溶液制备方法,依色谱条件测定,记录色谱图及峰面积,计算回收率。结果平均回收率为100.73%,RSD为0.62%(n= 6)。具体见表1。
2.8.2 胡薄荷酮回收率 取6份已知含量的感冒清热颗粒(批号0111428)内容物适量,研细,每份约1.3 g,精密称定,分别加入编号1 ~ 6的具塞锥形瓶中,分别精密加胡薄荷酮对照品储备液(浓度0.078 58 mg·mL-1)0.4 mL,再精密加入19.6 mL甲醇,按供试品溶液制备方法,依色谱条件测定,记录色谱图及峰面积,计算回收率。结果平均回收率为99.78%,RSD为0.75%(n= 6)。具体结果见表2。
2.9 样品含量测定
分别取7个不同厂家的感冒清热颗粒约1 g,精密称定,用“2.2.2”方法制备,用“2.1”方法测定感冒清热颗粒中葛根素和胡薄荷酮的含量;同时,采用本试验方法进行感冒清热颗粒中葛根素含量测定并与药典[1]方法进行比较,结果见表3。
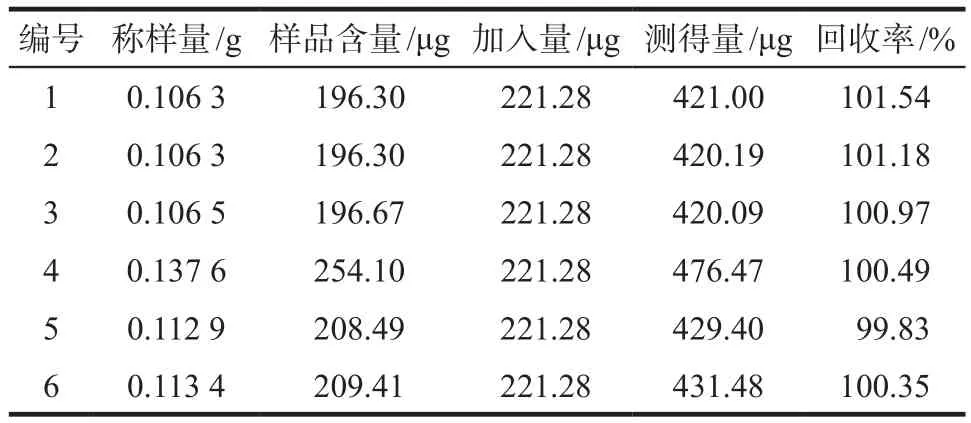
表1 葛根素回收率实验测定结果. n = 6Tab 1 Results of recovery test for puerarin. n = 6
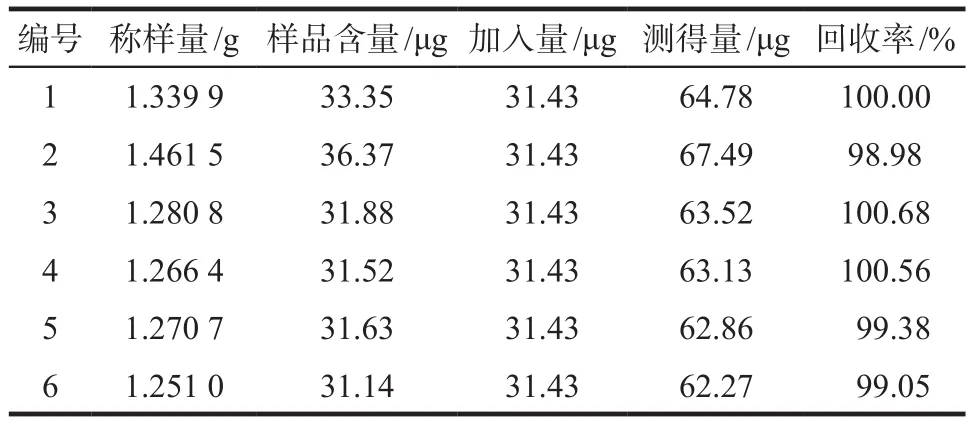
表2 胡薄荷酮回收率实验测定结果. n = 6Tab 2 Results of recovery test for pulegone. n = 6

表3 不同测定方法下7个厂家感冒清热颗粒中葛根素和胡薄荷酮的含量测定结果Tab 3 Contents of puerarin and pulegone in ganmao qingre granules from seven pharmaceutical factories by different methods
3 讨论
3.1 溶剂的选择
2010年版《中华人民共和国药典》中葛根素含量测定的提取溶剂为30%乙醇[1],本实验供试品的提取溶剂分别采用30%乙醇和甲醇,并进行比较,结果葛根素含量无明显差异,考虑到胡薄荷酮在甲醇中溶解性好,故本实验供试品提取溶剂、胡薄荷酮对照品溶液以甲醇作为溶剂。
3.2 检测波长的选择
取对照品溶液,在200 ~ 400 nm范围内扫描,胡薄荷酮和葛根素的最大吸收波长分别为252 nm和250 nm。由于感冒清热颗粒中胡薄荷酮的含量比葛根素低,故采用252 nm作为测定波长。
3.3 流动相的选择
我们对甲醇-水的比例分别为25∶75[7]、30∶70[8]、40∶60、50∶50[2]、65∶35、70∶30的流动相进行考察,结果甲醇浓度较高时,葛根素出峰时间在2 min左右,与杂质峰不能分离;甲醇浓度低时,胡薄荷酮在有效时间不出峰。综合考虑,采用梯度洗脱,流动相中甲醇的浓度先低后高,使葛根素、胡薄荷酮出峰时间分别在10 min和20 min左右,分离度好,灵敏度高。
3.4 葛根素和胡薄荷酮的含量
不同厂家的感冒清热颗粒中葛根素与胡薄荷酮的含量差异显著。2010年版《中华人民共和国药典》规定感冒清热颗粒中的葛根以葛根素计,每袋不得少于10.0 mg。但本文结果中,不同厂家的葛根素含量为每袋10.553 5 ~ 26.162 0 mg,相差一倍以上;7个厂家中只有一个厂家的感冒清热颗粒中有胡薄荷酮的成分。葛根素与胡薄荷酮的含量受产地、采收季节、储存时间、加工工艺等多因素影响,可能导致不同厂家生产的药品有效成分含量差异显著。成分含量的差异会导致不同厂家的产品之间临床疗效的差异。而现行标准对于胡薄荷酮既无鉴别又无含量测定方法,也是导致质量差异较大的原因。因此,应逐步完善和加强质量控制标准。
本试验方法同时测定了葛根中的葛根素和薄荷与荆芥中的胡薄荷酮的含量,作为检测感冒清热颗粒的质量标准,具有较好的临床意义。经比较,本法与药典方法测定葛根素含量的差异不大,为感冒清热颗粒的质量检测提供了一种简便、有效的方法。
[1] 国家药典委员会.中华人民共和国药典(二部)[S]. 北京:中国医药科技出版社,2010:1185-1186.
[2] 刘兰军,宋伟峰. RP-HPLC法测定感冒清热颗粒荆芥穗、薄荷中总胡薄荷酮的含量[J]. 中国医药导报,2011,8(20):94-95.
[3] 房海灵,李维林,任冰如,等. 薄荷属植物的化学成分及药理学研究进展[J]. 中国药业,2010,19(10):13-17.
[4] 钱雯,单鸣秋,丁安伟. 荆芥的研究进展[J]. 中国药业,2010,19(22):17-20.
[5] 王方升. HPLC法测定黄连上清片中胡薄荷酮的含量[J]. 安徽医药,2008,12(5):423-424.
[6] 苏文政,唐汉华. HPLC法测定感冒清热颗粒中葛根素的含量[J]. 中医药导报,2009,15(7):80-81.
[7] 白林,王琪,任韡. 高效液相色谱法测定脊痛宁胶囊中葛根素的含量[J]. 解放军药学学报,2011,27(3):236-237.
[8] 张良,刘永俊. HPLC法测感冒清热颗粒中葛根素含量[J]. 齐鲁药事,2010,29(9):531-532.
