氮源和磷源对金铁锁毛状根悬浮培养的影响
2013-09-22刘军,陈显化,金朝霞,王冰,张宗申
刘 军, 陈 显 化, 金 朝 霞, 王 冰, 张 宗 申
( 1.大连工业大学 辽宁省发酵工程重点实验室, 辽宁 大连 116034;2.周口师范学院 生命科学学院, 河南 周口 466000 )
0 引 言
金铁锁PsammosilenetunicoidesW.C. WuetC.Y.Wu是我国中成药保密品种“云南白药”的重要成分之一,属于珍贵濒危中药材。1999年作为国家二级保护植物被列入《国家重点保护野生植物名录(第一批)》[1]。
发根农杆菌是根瘤菌科农杆菌属的一种革兰氏阴性好氧土壤细菌,能感染大多数双子叶植物和少数单子叶植物及个别裸子植物形成毛状根。毛状根具有生长速度快、遗传稳定性高、次级代谢能力强等生长优势[2-3]。随着大量珍贵中药材处于濒危灭绝和品种退化,利用发根农杆菌Ri质粒转化形成毛状根并建立毛状根液体悬浮培养体系成为当代植物生物技术的研究热点[4-5]。研究表明,在植物根系生长过程中,氮源的供应形式和浓度对根系建成、发育有很大影响,磷源和氮源之间也有协同作用。本实验研究了氮源和磷源对金铁锁毛状根在液体条件下的生长发育以及次生代谢成分积累的影响,研究结果对工业化生产金铁锁毛状根从而解决其药用资源紧缺问题具有重要意义。
1 材料和方法
1.1 材 料
发根农杆菌为本实验室保存的ACCC10060,购于中科院菌种保藏中心;金铁锁无菌苗为大连工业大学珍稀濒危药用植物细胞工程实验室培养。
1.2 方 法
1.2.1 菌种的活化及毛状根的诱导和培养
实验方法见参考文献[6]。
1.2.2 金铁锁的毛状根液体培养基的选择
选用B5、N6、MS、1/2MS、1/4MS不同的空白培养基对毛状根液体培养,半个月后观察结果。
1.2.3 金铁锁毛状根生长曲线的绘制
取优质毛状根根尖转入空白的1/2MS液体培养基中悬浮培养,向30 mL培养液(100 mL的锥形瓶)中转入0.5 g毛状根,平行5个样,每周测1次毛状根鲜重,取平均值,绘制毛状根生长曲线。
1.2.4 氮源对毛状根生长与次级代谢的影响
1.2.5 硝态氮和磷源在液体培养基的培养周期
取0.5 g优质毛状根根尖接种于100 mL锥形瓶中,内装30 mL“1.24”中选出的液体培养基,pH为6.0、75 r/min、(25±1) ℃下暗培养,每隔5 d测培养基中的硝态氮和无机磷浓度,至浓度不再变化,做3个平行样,结果取平均值,分别绘制硝态氮浓度、无机磷浓度与培养时间关系曲线。

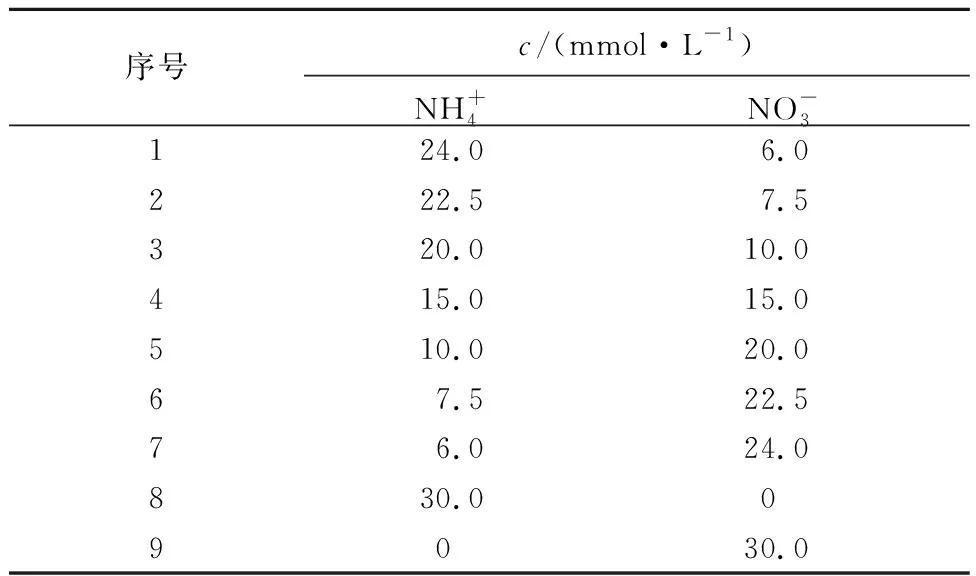
表1 硝态氮和铵态氮浓度比Tab.1 The ratio of nitrate nitrogen and ammonium nitrogen
1.2.6 磷源浓度对毛状根生长与次级代谢影响
以1/2MS液体培养基为基本培养基,KH2PO4浓度分别为0、2.5、5、6.25、 8.75、 12.5、25、50 mmol/L。28 d后观察其对毛状根生长和皂苷积累的影响,每种比例做3个平行样,每瓶接种毛状根0.5 g,选择100 mL锥形瓶,装液量30 mL,计算结果取平均值。
1.2.7 金铁锁毛状根的测量指标
增长率=(最终收获干重-接种干重)/接种干重
皂苷产量=收获干重×皂苷质量分数
2 结果与讨论
2.1 金铁锁毛状根的诱导
被感染的金铁锁叶片在2~3 d内出现菌斑,将出现菌斑的叶片放入加入头孢噻肟钠的MS培养集中除菌,菌除净后转入光照条件下培养,10 d后金铁锁叶片上长出白色的细丝状根,如图1所示,将白色根进行卡那霉素抗性实验,具有卡那霉素抗性的为金铁锁毛状根。
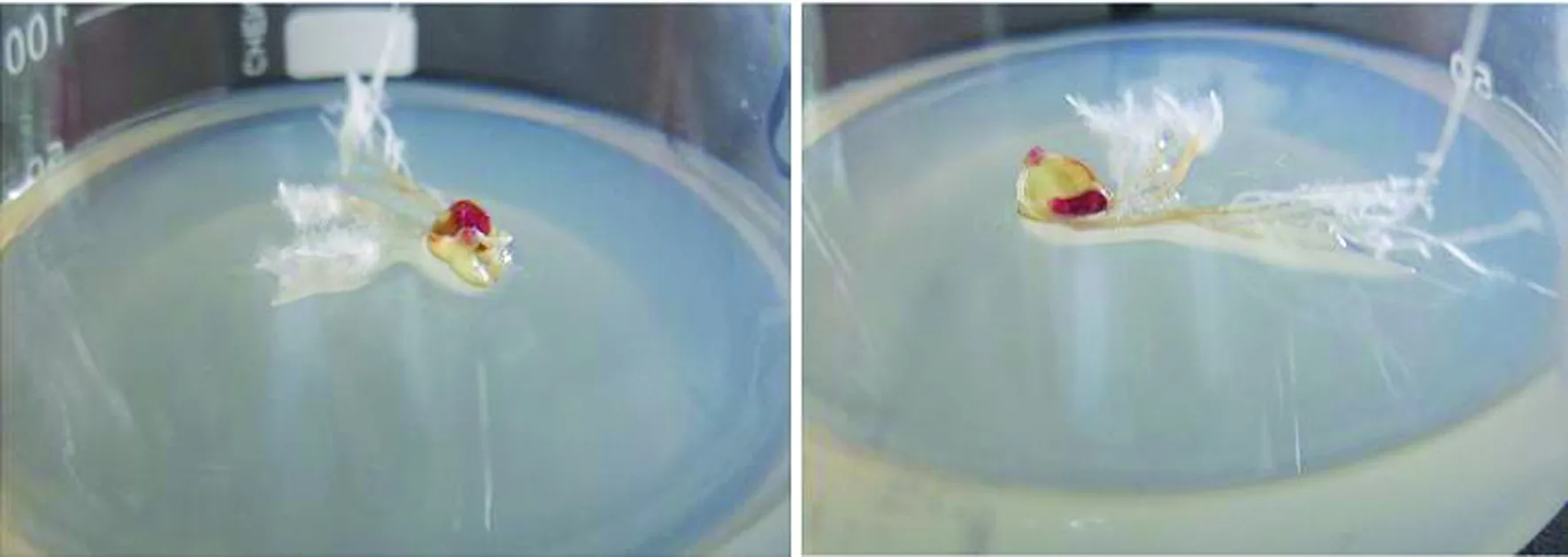
图1 从金铁锁叶片诱导的毛状根Fig.1 Hairy roots induced from Psammosilene tunicoides leaf
2.2 毛状根培养基的选择
观察B5培养基中毛状根,虽然生长速度快却容易褐化,MS培养基也会在一定程度上导致毛状根褐化,N6和1/4MS培养基生长速度都很慢,1/2MS培养基上生长的毛状根各方面性质都很好,所以选择1/2MS为预培养的培养基。
2.3 金铁锁毛状根生长周期
将新鲜的毛状根根尖部位转入空白的1/2MS 液体培养基中培养,其生物量积累与培养时间的关系如图2所示。
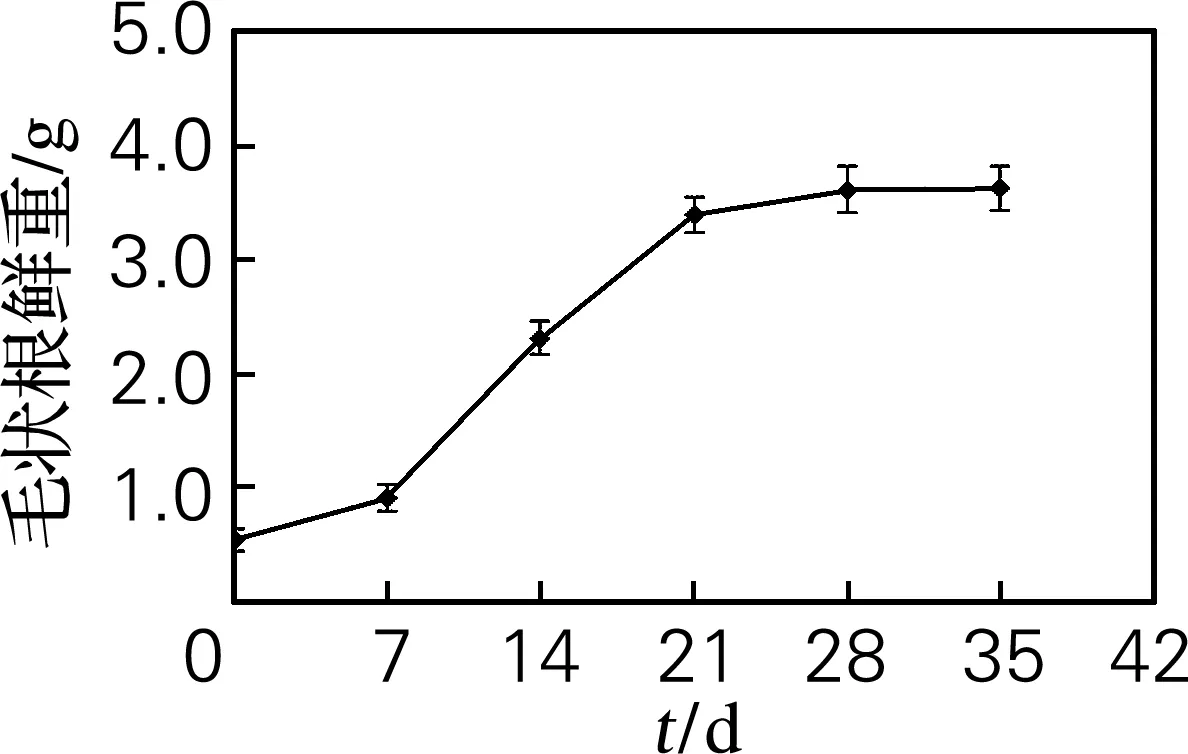
图2 金铁锁毛状根液体培养生长曲线Fig.2 Growth curve of Psammosilene tunicoides hairy roots in liquid culture medium
2.4 氮源浓度对金铁锁毛状根生长及次级代谢的影响


图3 氮源浓度对金铁锁毛状根生长的影响Fig.3 Effects of nitrogen concentration on the growth of Psammosilene tunicoides hairy roots


表2 氮源浓度对毛状根的生长速度和次级代谢的影响Tab.2 Effects of nitrogen concentration on the growth and secondary metabolism of hairy roots

2.5 毛状根对培养基中的吸收与利用
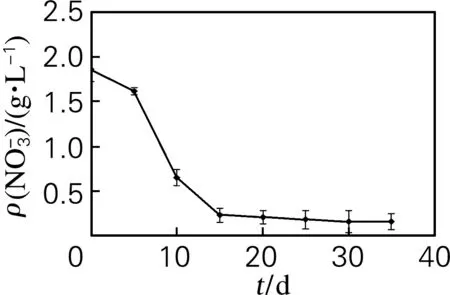
图4 培养液中质量浓度的变化Fig.4 Change of content in the medium
2.6 磷源浓度对毛状根生长和次级代谢的影响
由图5可知,毛状根生长与培养基中磷浓度关系密切。低磷浓度时毛状根生长缓慢,如1号毛状根明显是由于磷源不足而发生卷曲现象,从2号开始毛状根生长舒展,随着无机磷浓度的升高生长速度加快,从6号开始毛状根出现褐化现象,虽然早期生长速度很快,但随着褐化逐渐严重,毛状根生长受到抑制;随着磷浓度的升高,褐化越来越重,褐化时间也越来越早。为了避免褐化对毛状根生长的不利影响,无机磷的浓度不能超过6号样中的无机磷浓度即无机磷浓度要低于12.5 mmol/L。
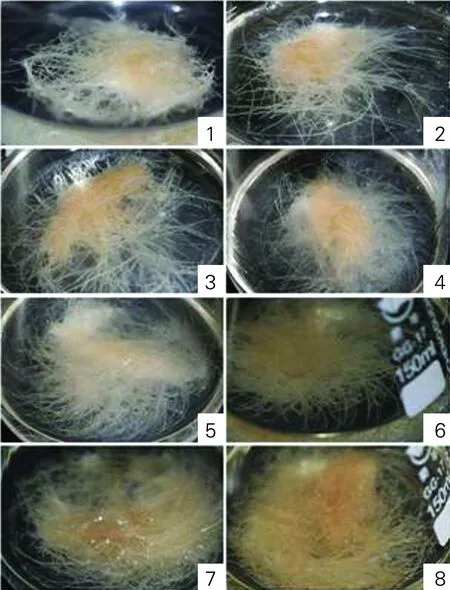
图5 不同浓度磷源对毛状根生长的影响Fig.5 Effects of different concentration of phosphorus sources on the growth of hairy roots
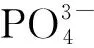

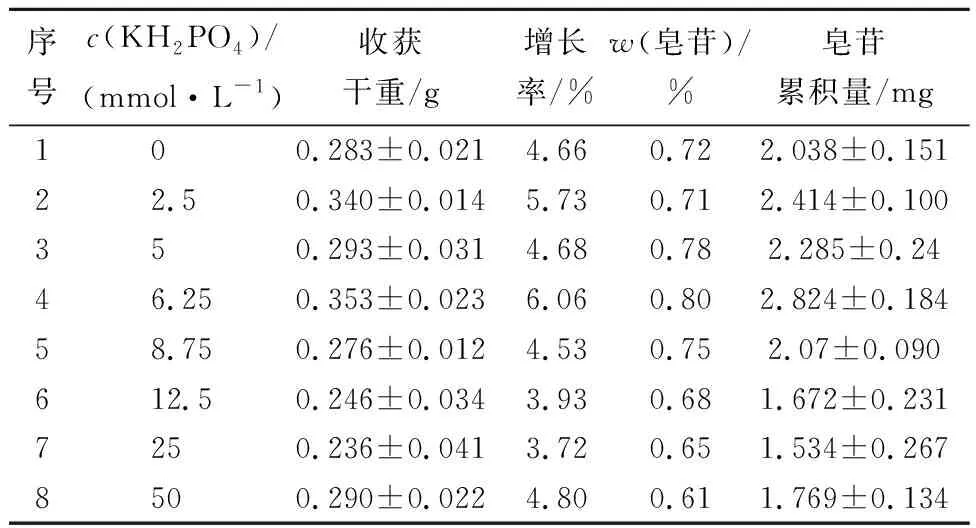
表3 磷源浓度对毛状根生长和次级代谢的影响Tab.3 Effects of phosphate sources on the growth and secondary metabolism of hairy roots
2.7 磷源的消耗速度和培养周期
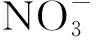
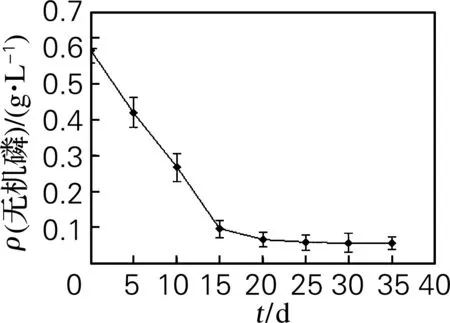
图6 培养液中无机磷质量浓度的变化Fig.6 Change of phosphorus content in the medium
3 结 论

[1] 屈燕,虞泓,周湘玲. 珍稀濒危药用植物金铁锁研究进展[J]. 中华中医药杂志, 2011, 26(8):1795-1796.
[2] 刘晓艳,王清玲,李学俊. 农杆菌Ri诱导丹参毛状根培养体系的优化[J]. 西北农业学报, 2009, 18(6):183-186.
[3] 杨慧洁,杨世海. 发根农杆菌介导的药用植物遗传转化研究[J]. 生物技术通报, 2009(1):16-21.
[4] 黄建安,刘仲华. 毛状根培养与植物此生代谢物的生产[J]. 微生物学杂志, 2003, 23(5):35-39.
[5] 张韧,秦玉明,陈文庆,等. 悬浮培养技术在生物制药中的应用和展望[J]. 中国兽药杂志, 2011, 45(3):56-60.
[6] 李景滨,刘同祥,王培忠,等. 金铁锁毛状根诱导及培养体系的建立[J]. 中国中药杂志, 2011, 36(5):547-550.
[7] 欧少云,施和平,曾宝强. 南美蟛蜞菊毛状根诱导及其离体培养[J]. 生物工程学报, 2010, 26(3):378-385.
[8] 张宗申,王子茜. 培养基成分和培养条件对黄芪愈伤组织中黄芪皂苷积累的影响[J]. 大连工业大学学报, 2009, 28(3):174-177.
(ZHANG Zong-shen, WANG Zi-qian. Effects of culture conditions on the saponin accumulation inAstragalusmembranaceuscallus[J]. Journal of Dalian Polytechnic University, 2009, 28(3):174-177.)
