人参果多酚氧化酶的酶学特性及纯化
2013-09-22祁立波,褚津,郑皎皎,姜鹏飞,朱蓓薇
祁 立 波, 褚 津, 郑 皎 皎, 姜 鹏 飞, 朱 蓓 薇
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连魁氏食品有限公司, 辽宁 大连 116101 )
0 引 言
人参果(Solanummuricatum)是多年生茄科草本植物,其果实爽甜多汁、风味独特、清香宜人,是制作果汁的良好原料。人参果具有低糖、低脂、高蛋白的特点,并含有丰富的维生素及矿物质元素,硒和钙的含量尤其高,在我国蔬菜和水果品种中是非常少见的[1]。研究认为长期食用人参果可增强人体的免疫功能,延缓衰老,保护眼组织、皮肤、心脏和肝脏[2],被誉为“生命火种”、“抗癌大王”。因此,对人参果进行进一步的加工利用有重要的现实意义。此外,多酚氧化酶引起的酶促褐变会对果肉和果汁的色泽产生较大影响[3],这种情况同样影响了人参果的加工。多酚氧化酶(Polyphenol Oxidase,简称PPO)是一种自然界普遍存在的以铜为辅基的氧化还原酶,能催化酚类物质氧化成醌,醌类物质再进一步氧化合成黑色素[4]。不同来源的PPO的酶学特性有所差异。目前国内外对果蔬中PPO等酶类的研究已有不少报道,如花椰菜[5]、草莓[6]和香蕉[7]等,但对人参果PPO酶学特性的研究却鲜见报道。作者从人参果果肉中提取得到PPO,并对其酶学特性加以研究,以探明其引起酶促褐变的反应条件,从而为加工过程中人参果褐变的有效控制提供支撑。
1 实 验
1.1 材料与仪器
人参果:购自大连市双兴批发市场,4 ℃贮藏。实验所用试剂均为国产分析纯。
T25数显匀浆机,德国艾卡集团;T6新世纪型紫外可见分光光度计,北京普析通用仪器有限责任公司;Z323K型冷冻离心机,德国哈默机床有限公司;HH-S型数显水浴锅,巩义市予华仪器有限责任公司;JJ200型电子天平,常熟市双杰测试仪器厂;XW-80A旋涡混合器,上海青浦沪西仪器厂;YC-1层析实验冷柜,北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 PPO粗酶液的提取
人参果洗净去皮后,取果肉100 g,立即加入预冷丙酮(-20 ℃)150 mL,匀浆2 min,用布氏漏斗抽滤。滤饼用100 mL预冷丙酮进行再次提取和抽滤后即得PPO丙酮粉[8]。取丙酮粉5 g溶于50 mL pH 6.8的预冷(4 ℃)磷酸盐缓冲液中,用磁力搅拌器搅拌15 min后12 000 r/min离心20 min,过滤取上清液,即为人参果PPO粗酶液[8]。
1.2.2 PPO活性的测定
在比色皿中分别加入pH 6.0的磷酸盐缓冲液1 mL、0.1 mol/L邻苯二酚溶液1 mL和PPO粗酶液0.4 mL,立即混匀后测OD400nm。酶液加入时开始计时,每15 s记录1次OD值,每组测量3次,取平均值,以最初直线段斜率(OD/t)表示酶活力。一个酶活力单位(U)定义为:在上述条件下,每分钟引起吸光度改变0.001所需的酶量[9-10]。
1.2.3 pH对PPO活性的影响
按“1.2.2”所述方法,分别选择具有不同pH的缓冲液,包括柠檬酸缓冲液(0.2 mol/L,pH 3.6~5.6)和磷酸二氢钾缓冲液(0.2 mol/L,pH 6.0~8.0),考察pH对PPO活性的影响[8]。
1.2.4 温度对PPO活性的影响
在比色皿中分别加入pH 6.0的磷酸盐缓冲液1 mL和0.1 mol/L的邻苯二酚溶液1 mL,在一定温度(20~70 ℃)下保温5 min,然后加入相同温度下保温5 min的粗酶液0.4 mL,立即测定OD400nm,考察温度对PPO活性的影响。
1.2.5 PPO米氏常数(Km)的测定
在比色皿中分别加入用pH 6.0的磷酸盐缓冲液配制的不同浓度邻苯二酚溶液(2.0、4.0、6.0、8.0和10.0 mmol/L)2.6 mL和粗酶液0.4 mL,立即测定酶活性。用Lineweaver-Burk双倒数作图法绘出动力学曲线,计算Km。
1.2.6 PPO粗酶液的纯化
参考文献[11]的方法,分别采用丙酮沉淀法和硫酸铵沉淀法对PPO粗酶液进行纯化。采用福林酚法测定其蛋白含量,并按照方法“1.2.2”测定纯化后酶液的酶活力。
2 结果与讨论
2.1 PPO的酶活力
人参果PPO在4 min之内的活力反应情况如图1所示。由图1可以看出,在反应最初的1.5 min内,OD值呈线性增长趋势,说明初始阶段PPO酶的反应速度很快。随着时间的延长,反应速度逐渐减缓,OD值增长缓慢,逐渐进入稳定期,可能是由于随着酶促可逆反应的进行,底物浓度逐渐降低,产物浓度逐渐增加,以及pH和温度等因素的影响使酶失活,它们共同导致了酶促反应逆反应的加速[12]。在0~1 min内,OD值的变化线性较好,能够充分反映PPO的活性。因此,在人参果PPO活性的测定中,可以用1 min之内OD值随时间的变化速度来表示酶活力。

图1 人参果PPO反应进程曲线Fig.1 The reaction course curve of Solanum muricatum PPO
2.2 PPO的最适反应pH
pH对PPO活性的影响如图2所示。由图2可以看出,反应体系的pH对人参果PPO的酶活力影响非常显著。在pH 3.6~5.4,随着pH升高,PPO的活性先升高后降低,在pH为4.8时为最大值。之后,随着pH的进一步升高,PPO的活性虽出现相同的变化趋势,但活性明显增强。pH 为6.8时PPO的酶活性最高,这可能与PPO的活性部位含有组氨酸基团(pK=6.0)有关[13]。此外,PPO是碱性蛋白质,在较强的酸性条件下,辅基铜以铜离子的形式解离,而在碱性条件时,辅基铜则会解离成Cu(OH)2[14],所以过酸或过碱的环境都会降低人参果PPO的酶活性。
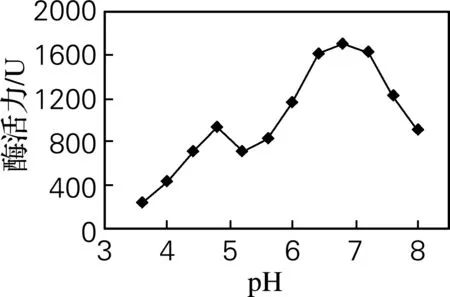
图2 pH对人参果PP0活性的影响Fig.2 Effects of pH on Solanum muricatum PPO activity
2.3 PPO的最适反应温度
温度对PPO活性的影响如图3所示。在实验所考察的温度范围内,随着反应温度的升高,人参果PPO的酶活性整体呈下降趋势。在20~40 ℃ PPO的活性较稳定,且在30 ℃时活力相对最高,因此可以确定30 ℃为人参果PPO反应的最适温度,这与Dincer[15]和Dogan[16]等报道的枸杞果和茄子等PPO的最适温度一致。当温度大于40 ℃时,温度越高,酶活力越低。温度升高,在加快酶促反应速度的同时,也会对酶的结构产生不利影响,导致酶活力下降,因此,PPO的最适反应温度是这2种影响综合作用的结果[17]。40 ℃ 以下时,温度对人参果PPO酶促反应的加速起主导作用,但当温度继续升高时,高温对酶蛋白结构或活力的破坏起主导作用。

图3 温度对人参果PPO活性的影响Fig.3 Effects of temperatures on Solanum muricatum PPO activity
2.4 PPO的米氏常数
图4为根据双倒数作图法绘制的动力学曲线。由图4可以得到人参果PPO的米氏常数Km=4.4 mmol/L,相应的酶促反应动力学方程为V=2 000[S]/(4.4+[S])。Km是酶的基本特征常数,反映酶与底物结合及解离的性质。Km代表反应速度达到最大速度一半时的底物浓度,Km越小说明底物与酶结合的亲和力越强。人参果PPO的Km与Dogan等[18]对百里香PPO的研究结果相似,但因品种的差异还是有所不同。

图4 米氏常数的测定Fig.4 Determination of Km
2.5 PPO的纯化
分别选用具有不同饱和度的丙酮和硫酸铵对人参果PPO酶进行纯化,结果如图5所示。由图5可以看出,丙酮和硫酸铵的饱和度不同,PPO酶的纯化效果明显不同。在饱和度为30%~80%时,随着饱和度的增加,PPO酶的纯化倍数均呈先升高后降低的变化趋势,且都在饱和度为50%时达到最大值。2种方法的纯化结果如表1所示。

图5 丙酮、硫酸铵沉淀法纯化人参果PPOFig.5 Partial purification of Solanum muricatum PPO by acetone and ammonium sulfate precipitation method

表1 人参果PPO的纯化Tab.1 Partial purification of solanum muricatum PPO

3 结 论
(1)人参果PPO的最适反应pH为6.8,最适反应温度为30 ℃,可以通过改变PPO的反应条件来抑制其酶活。
(2)人参果PPO酶促褐变反应动力学符合米氏方程所描述的单底物酶促反应动力学,Km=4.4 mmol/L,以邻苯二酚为底物的最大反应速度为2 000 U/min,相应的酶促反应动力学方程为V=2 000[S]/(4.4+[S])。
(3)经丙酮沉淀法纯化后,人参果PPO的纯化倍数为3.49,得率为2.26%;经硫酸铵沉淀法纯化后,人参果PPO的纯化倍数为4.26,得率为8.92%,硫酸铵沉淀法的纯化效果更好。
[1] 孙俊秀. 人参果[J]. 四川烹饪高等专科学校学报,2004(2):21-22.
[2] 解灵芝,李秋菊. 人参果营养成分及饮料加工[J]. 辽宁熊岳农业高等专科学校学报, 1999, 1(1):57-59.
[3] 汤凤霞,魏好程,曹禹芒. 芒果多酚氧化酶的特性及抑制研究[J]. 食品科学, 2006, 27(12):156-159.
[4] 何思莲,刘慧霞,周少基,等. 甘蔗多酚氧化酶酶学特性及应用研究[J]. 广西大学学报, 2009, 34(6):827-831.
[5] GAWLIK-DZIKI U, SZYMANOWSKA U, BARANIANK B.Characterization of polyphenol oxidase from broccoli (Brassicaoleraceavat,botrytisitalica) florets[J]. Food Chemistry, 2007, 105(3):1047-1053.
[6] WESCHE-EBELING P, MONTGOMERY M W. Strawberry polyphenol oxidase extraction and partial characterization[J]. Journal of Food Science, 1990, 55(5):1320-1324.
[7] YANG C, FUJITA S, KOHNO K, et al. Partial purification and characterization of polyphenol oxidase from banana (MusasapientumL) peel [J]. Journal of Agricultural and Food Chemistry, 2001, 49(3):1446-1449.
[8] 刘文山,肖凯军,郭祀远. 苹果多酚氧化酶的提取及其抑制作用的研究[J]. 现代食品科技, 2006, 22(4):82-84.
[9] HO K. Characterization of polyphenol oxidase from aerial roots of an orchid,Aranda“Christine 130”[J]. Plant Physiology and Biochemistry, 1999, 37(11):841-848.
[10] UNAL M U. Properties of polyphenol oxidase from Anamur banana (Musacavendishii) [J]. Food Chemistry, 2007, 100(3):909-913.
[11] 张永亮,朱勇. 桑尺蠖多酚氧化酶的分离纯化[J]. 河南农业科学, 2010(5):69-71.
[12] 彭志英. 食品酶学导论[M]. 北京:中国轻工业出版社, 2002:120-165,141-149.
[13] 沈金玉,黄家音,李晓莉. 芦荟多酚氧化酶特性的研究[J]. 食品与发酵工业, 2005, 31(3):21-25.
[14] 张勇,池建伟,温其标,等. 香蕉多酚氧化酶褐变性质的研究[J]. 食品与发酵工业, 2004, 30(5):52-57.
[15] DINCER B, COLAK A, AYDIN N, et al. Characterization of polyphenol oxidase from medlar fruits (MespilusgermanicaL. Rosaceae)[J]. Food Chemistry, 2002, 77(1):1-7.
[16] DOGAN M, ARSLAN O, DOGAN S. Substrate specificity, heat inactivation and inhibition of polyphenol oxidase from different aubergine cultivars[J]. International Journal of Food Science and Technology, 2002, 37(4):415-423.
[17] 李宪臻. 生物化学[M]. 武汉:华中科技大学出版社, 2008:148-150.
[18] DOGAN S, DOGAN M. Determination of kinetic properties of polyphenol oxidase fromThymus(Thymuslongicaulissubsp.chaubardiivar.chaubardii)[J]. Food Chemistry, 2004, 88(1):69-77.
