产碱性蛋白酶海洋细菌的筛选及其发酵条件优化
2013-09-22宋明徽,丛丽娜,王红英,姜启晨
宋 明 徽, 丛 丽 娜, 王 红 英, 姜 启 晨
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
蛋白酶是在一定的温度和pH条件下催化蛋白质水解成小肽和氨基酸的一类生物酶。蛋白酶是很重要的水解酶类,在饲料、医药、食品等领域中具有重要的作用,广泛存在于动物内脏、植物茎叶果实以及微生物中[1]。碱性蛋白酶是在碱性条件下水解蛋白质肽键的酶类,一般pH为9.0~11.0。中性偏碱性的蛋白酶作为饲料酶在水产养殖的应用越来越受到关注。由于水产动物消化系统不如畜禽完善,内源酶分泌没有畜禽完全,这样容易影响对饲料中营养成分消化吸收,需外源酶添加辅助消化[2]。若在饲料中添加蛋白酶,可使高分子的蛋白质降解为低分子的肽及各种氨基酸,易被消化吸收,提高饲料利用效率。水产动物大多数只有消化道,其消化道环境呈中性或偏碱性[3],因此水产饲料中添加外源酶时需注意选择适宜中性偏碱性等条件下的酶类,才能达到较佳效果。
从海洋微生物中寻找特异活性的碱性蛋白酶作为饲料添加酶更具有相容性,而且海洋环境的多样性与独特性造就了海洋微生物自身具有独到的优越性[4],并且具有优势的海洋细菌筛选也为水产养殖业中所需求的益生菌提供了资源。本研究从海洋微生物中筛选一株具有高产碱性蛋白酶优势的菌株,并对其所产蛋白酶的酶学性质和发酵条件进行研究,进一步提高了该菌株的产蛋白酶能力,为水产饲料添加酶的生产应用以及水产饲用益生菌的研究提供了充实的理论基础。
1 材料与方法
1.1 材 料
1.1.1 试验材料
以大连海域采集的贝类、海鱼、海参等为试验材料。
1.1.2 培养基
2216E培养基[5]:蛋白胨5 g,酵母膏1 g,磷酸铁0.1 g,琼脂20 g,海水1 000 mL,pH 8.0。
富集培养基:蛋白胨1 g,酵母膏5 g,牛肉膏5 g,海水1 000 mL,pH 8.0。
分离培养基:干酪素10 g,琼脂20 g,海水1 000 mL,pH 8.0。
产酶发酵培养基:蛋白胨10 g,牛肉膏3 g,NaCl 5 g,去离子水1 000 mL,pH 8.0。
1.1.3 主要试剂和仪器
牛肉膏、蛋白胨、酵母膏、琼脂粉、干酪素均购自北京奥博星生物技术有限责任公司;其他常用试剂均来自国产试剂公司;紫外/可见光分光光度计,上海精密科学仪器有限公司;恒温水浴锅,上海嘉鹏科技有限公司。
1.2 方 法
1.2.1 菌种筛选
初筛:将海参肠、贝类以及鱼的内脏剪碎后放入无菌海水浸泡过夜,取上清液1 mL放入富集培养基,28 ℃、160 r/min摇床培养48 h;将富集培养液进行稀释,分别涂布于分离培养基,培养3~4 d[6];挑取透明圈颜色、形态各不相同的较大单个菌落划线分离纯化,直到得到纯的菌株,并于2216E斜面保藏[7]。将已纯化的菌株接种于种子培养基,28 ℃、160 r/min摇床培养24 h,将无菌滤纸片贴于酪蛋白平板上,吸取5 μL发酵液滴于滤纸片上,28 ℃恒温培养48 h,挑取水解圈与菌苔直径比值较大的菌株保存[8]。
复筛:将初筛中得到的菌株接入发酵培养基,30 ℃、160 r/min振荡培养48 h。发酵液在4 ℃、10 000 r/min下离心10 min,分离得到上清液为粗酶液,进行蛋白酶酶活测定。采用Folin酚显色法测定粗酶液活性。
1.2.2 菌株HS-A156产蛋白酶性质的初步研究
1.2.2.1 温度对蛋白酶活力和热稳定性影响
将菌株HS-A156的粗酶液分别置于25、30、35、40、45、50、55、60 ℃下测定蛋白酶活力,以确定酶的最适作用温度[9]。该粗酶液在不同温度下保温2 h,在40 ℃下测定剩余蛋白酶活力,以未处理的酶液的酶活力为100%。
1.2.2.2 pH对蛋白酶活力和稳定性的影响
采用pH为6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0的缓冲溶液配制酪蛋白底物溶液,测定在不同pH下的蛋白酶活力[10],以确定酶的最适作用pH。用不同pH的缓冲液稀释酶液,保温1 h,40 ℃下测定剩余蛋白酶活力,以未处理的酶液的酶活力为100%。
1.2.3 发酵产酶培养基的优化
以2216E培养基作为种子液培养基,种子液培养12 h达到最佳种龄(OD600=1.3),2%接种量,培养温度30 ℃,摇床转速160 r/min,发酵48 h。在无碳培养基中,分别加入1%葡萄糖、蔗糖、乳糖、玉米粉、可溶性淀粉,测定菌株HS-A156的产酶能力,以确定最佳碳源。在已确定碳源的培养基中,分别加入1%牛肉膏、酵母粉、豆粕粉、尿素、硫酸铵、牛肉膏和酵母粉混合料、豆粕粉和酵母粉混合料,其他条件相同,以确定最佳氮源。在已经选定的碳源和氮源的培养基中,分别加入0.05% Mg2+、Ca2+、K+、Fe2+、Zn2+,其他条件相同,测定其酶活力,考察金属离子对菌株HS-A156产酶的影响。最后利用L9(34)正交试验(表1)来确定该菌株发酵产酶的最佳培养基组成。


表1 正交试验因素水平表Tab.1 The factors and levels of orthogonal experiment
1.2.4 发酵产酶条件的优化
在已优化的发酵培养基的基础上,通过分别改变培养基的初始pH、培养温度和接种量,确定最佳的培养基初始pH、培养温度和接种量,从而确定最终的发酵产酶条件。
2 结果与讨论
2.1 菌株的筛选
从大连海域采集的贝类、海鱼、海参中分离纯化出73株产蛋白酶的海洋细菌,利用酪蛋白培养基对菌株进一步筛选,得到23株具有较强水解酪蛋白能力的菌株。再采用Folin酚法通过测定发酵液酶活力进行复筛,最后从海参肠道中筛选出一株产碱性蛋白酶活力最高而且遗传性能稳定的海洋细菌,命名为HS-A156。
2.2 菌种鉴定
菌株HS-A156的菌落形态近似圆形,乳白色,湿润,边缘光滑,易挑取。在显微镜下可以观察到该菌株呈长杆状,细胞染色为蓝紫色,为革兰氏阳性菌。将菌株HS-A156进行测序,其16S rDNA序列经过分析比对后,初步判断该菌株为枯草芽孢杆菌(B.subtilis)。已将该序列提交到GenBank中,检索号为KC166863。
2.3 温度对蛋白酶活力和热稳定性的影响
由图1可知,菌株HS-A156所产蛋白酶最适反应温度为40 ℃。粗酶液在上述温度下分别保温2 h,测定酶活力。结果表明,起初随着温度上升酶活性逐渐升高,但40 ℃后,酶活力迅速下降。在25~40 ℃酶活力维持在较高水平,45 ℃ 时酶活力虽然开始下降,但其相对酶活力仍达到58.2%,所以初步推断在25~45 ℃,该菌株产生的蛋白酶具有良好的热稳定性,尤其在25 ℃低温环境下菌株HS-A156所产碱性蛋白酶的酶活力保持在99%以上,这与一些嗜高温碱性蛋白酶相比,菌株HS-A156所产碱性蛋白酶,作为水产饲料添加酶能够适应海洋水产动物低温养殖生长的特点,减少饲料添加酶的损失。

图1 温度对酶活力及稳定性的影响Fig.1 Effect of temperature on enzyme activity and stability
2.4 pH对蛋白酶活力和稳定性的影响
由图2可知,pH为9.0时该酶活力最高,当pH大于其最适pH时,酶活力迅速下降。该粗酶液在pH 8.0的缓冲液中保温1 h后,酶活保持89.0%,在pH 11.0的缓冲溶液中保温1 h后,酶活只丧失了21.9%,这说明该酶在 pH 8.0~11.0范围内具有良好的稳定性。该酶作为海洋水产饲料添加酶能够适应水产动物肠道内偏碱性的环境,提高酶的利用效率,增强饲料添加酶的相容性。

图2 pH对酶活力及稳定性的影响Fig.2 Effect of pH on enzyme activity and stability
2.5 菌株HS-A156发酵培养基条件优化
2.5.1 发酵培养基碳源优化
考察不同碳源对菌株HS-A156产酶的影响。由图3可知,不同碳源对菌株HS-A156产蛋白酶活性影响较大,其中以葡萄糖作为碳源酶活力最高,而可溶性淀粉相对较低。这可能是由于葡萄糖是容易被利用的单糖,结构简单,不需要降解和转化。因此,选择葡萄糖作为培养基的碳源。
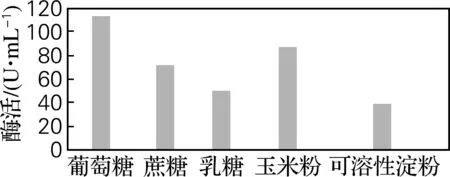
图3 碳源对产酶的影响Fig.3 Effects of carbon sources on protease production
2.5.2 发酵培养基氮源优化
考察不同氮源对菌株HS-A156产酶影响。由图4可知,以牛肉膏和酵母粉组成的复合氮源作为产酶发酵培养基的氮源时,菌株HS-A156产蛋白酶活力最高,为242 U/mL;而采用铵盐、尿素作为发酵培养基的氮源时,酶活最低,这说明与有机氮源相比,无机氮源不利于菌株HS-A156的产酶发酵,而有机氮源当中的复合氮源优于单一氮源。因此,采用牛肉膏和酵母粉组成的复合氮源作为菌株HS-A156的产酶发酵的最佳氮源。
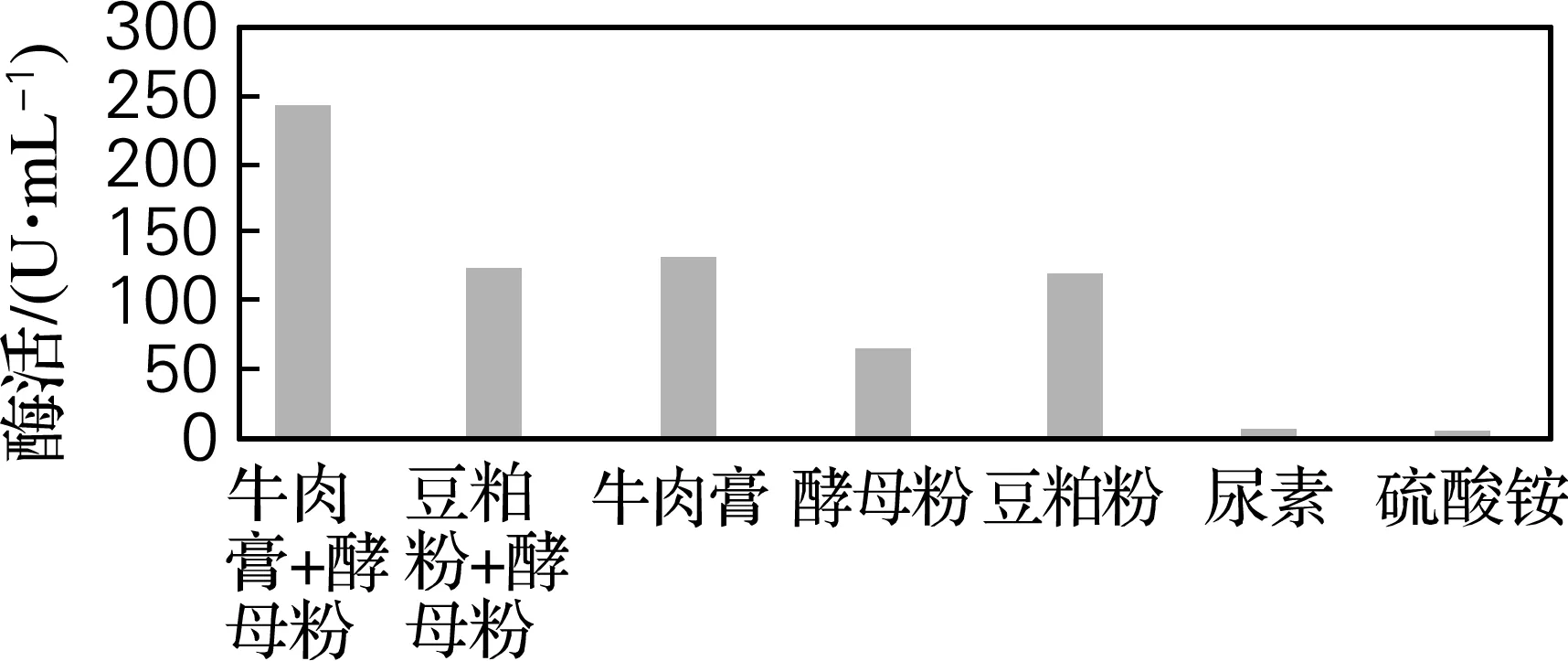
图4 氮源对产酶的影响Fig.4 Effects of nitrogen sources on protease production
2.5.3 不同金属离子对产酶的影响
通过添加5种金属离子,测定各种金属离子对菌株HS-A156产酶的影响。由图5可知,适量的Ca2+能显著提高HS-A156菌株产蛋白酶量,其蛋白酶活力达到257 U/mL,而Fe2+、Zn2+对产酶有较强的抑制作用。因此可以在培养基中加入适量的Ca2+,以提高该菌株的产蛋白酶能力。
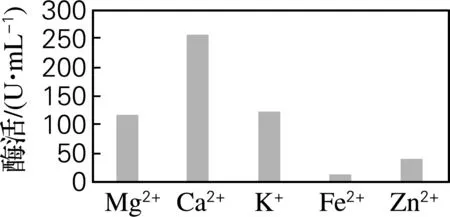
图5 金属离子对产酶的影响Fig.5 Effect of various metal ions on protease production
2.5.4 培养基优化正交试验
为了进一步考察培养基组分中葡萄糖、牛肉膏、酵母粉、Ca2+4种因素的含量对产酶的影响,利用L9(34)正交试验来确定最佳培养基,以提高菌株HS-A156的产蛋白酶量。

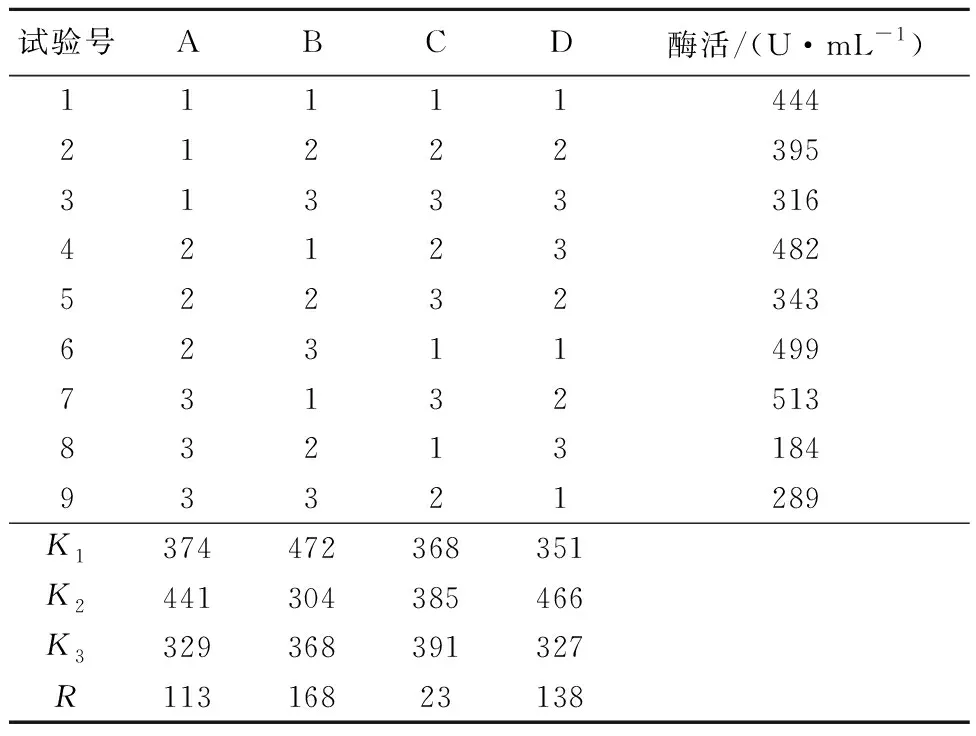
表2 正交试验数据分析表Tab.2 Data analysis of orthogonal test
从表2极差分析看出,在考察的4个因素中,对产酶影响的大小关系为B>D>A>C,培养基中牛肉膏浓度因素的极差值R最大,说明该因素对产酶影响最大,其次是Ca2+的质量分数,然后是葡萄糖质量分数,酵母粉质量分数的极差值R最小,其对产酶的影响最小。通过培养基优化正交试验,选出最佳实验方案为A2B1C3D2,即葡萄糖1.5%、牛肉膏1.0%、酵母粉2.0%和CaCl20.05%,在此培养基条件下测得蛋白酶活力为519 U/mL。
2.6 菌株HS-A156发酵产酶条件优化
2.6.1 培养基初始pH对产酶的影响
由图6可知,在pH 7.5~8.5时,产酶活力比较稳定,说明偏碱性的条件下较利于菌株的生长和营养物质的吸收,进而有利于蛋白酶的生成,其中当pH=8.0时,酶活力最高为524 U/mL。
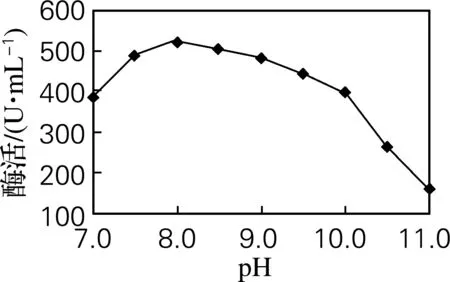
图6 培养基初始pH对产酶的影响Fig.6 Effects of initial pH in fermentative medium on protease production
2.6.2 发酵温度对产酶的影响
由图7可知,发酵温度在25~30 ℃时酶活力比较稳定,这由于温度25~30 ℃适于菌株HS-A156生长,过高的温度将会不利于菌体生长,因而其在30 ℃时产酶量最高达516 U/mL。
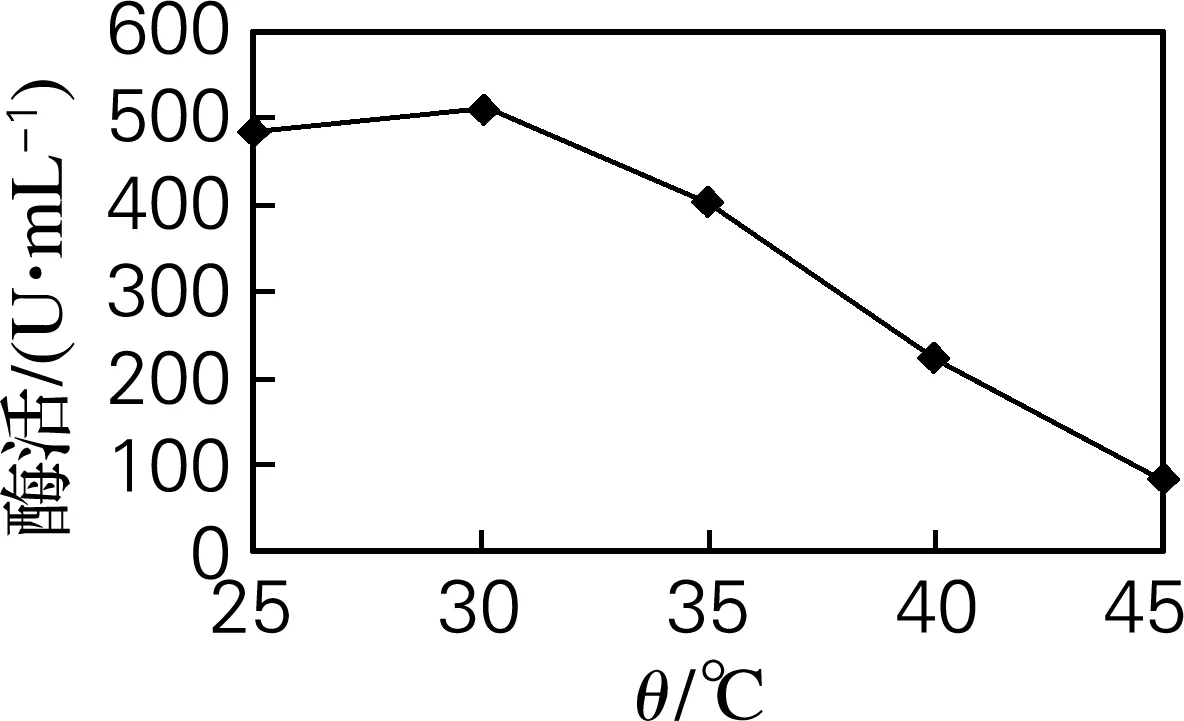
图7 发酵温度对产酶的影响Fig.7 Effects of culture temperature on protease production
2.6.3 接种量对产酶的影响
由图8可知,接种量在2%~4%时其酶活力比较稳定。当接种量为1%时,由于菌体细胞数量太少而不利于产酶,但接种量过高时,菌体数量过多,生长期时营养物质消耗太多,产酶期时营养物质浓度下降,也不利于产酶。因此,接种量在3%时最优。

图8 接种量对产酶的影响Fig.8 Effects of inoculation quantity on protease production
综合以上各个实验研究,在选择最佳培养基成分的基础上,培养基初始pH为8.0、发酵过程培养温度为30 ℃、接种量为3%,菌株HS-A156发酵48 h,其发酵液中产生的蛋白酶酶活力达到最高,为538 U/mL。此优化条件为该菌株的最佳产酶发酵条件。
3 结 论
从海参肠道中筛选出一株产碱性蛋白酶较强的海洋枯草芽孢杆菌HS-A156。该菌株所产碱性蛋白酶最适温度为40 ℃,在25~45 ℃具有良好的热稳定性,属于一种中低温蛋白酶,与其他嗜热碱性蛋白酶相比,适于海洋水产动物低温养殖的特点。该酶最适pH为9.0,在pH 8.0~11.0具有良好的pH稳定性。
最适产酶培养基组成为葡萄糖1.5%、牛肉膏1.0%、酵母粉2.0%、CaCl20.05%;最佳发酵条件为培养基初始pH 8.0、发酵温度30 ℃、接种量3%。经过发酵产酶优化之后,菌株HS-A156所产碱性蛋白酶的活力达到了538 U/mL,比优化前提高了3.7倍。这个结果优于夏振强等[11]研究的海洋细菌L1-9菌株的产酶量128.3 U/mL,孙谧等[12]研究的海洋细菌YS-9412-130的产酶量180 U/mL。
综上所述,本研究成功地筛选出高产碱性蛋白酶的海洋细菌HS-A156以及对其所产蛋白酶性质、发酵条件等进行了初步探索,为下一步海洋益生菌及海洋生物酶水产饲用方面的研究与应用提供了充实的理论基础。
[1] JOO H S, CHOI J W. Purification and characterization of a novel alkaline protease fromBacillushorikoshii[J]. Journal of Microbiology and Biotechnology, 2012, 22(1):58-68.
[2] RAMESH S, RAJESH M, MATHIYANAN N. Characterization of a thermostable alkaline protease produced by marineStreptomycesfungicidesMML1614[J]. Bioprocess and Biosystematic Engineering, 2009, 32:791-800.
[3] 肖峰,张浩,王斌,等. 一株产中性蛋白酶海洋细菌的筛选与初步鉴定[J]. 食品与药品, 2011, 13(3):89-93.
[4] RAJKUMAR R, KOTHILMOZIAN J, RAMASAMY R. Production and characterization of a novel protease fromBacillussp. RRM1 under solid state fermentation[J]. Journal of Microbiology and Biotechnology, 2011, 21(6):627-636.
[5] 李爱民,丛丽娜,侯英敏. 海参肠道菌HS-A38的鉴定[J]. 大连工业大学, 2011, 30(1):10-12.
(LI Ai-min, CONG Li-na, HOU Ying-min. Identification of a sea cucumber intestine bacterium(A38) [J]. Journal of Dalian Polytechnic University, 2011, 30(1):10-12.)
[6] SALEEM M, REHMAN A, YASMIN R, et al. Biochemical analysis and investigation on the prospective applications of alkaline protease from aBacilluscereusstrain[J]. Molecular Biology Reports, 2012, 39(4):6399-6408.
[7] DENG Aihui, WU Jie, ZHANG Yun, et al. Purification and characterization of a surfactant-stable high-alkaline protease fromBacillussp. B001[J]. Bioresource Technology, 2010, 101(18):7111-7117.
[8] MUKHERJEE A K, RAI S K. A statistical approach for the enhanced production of alkaline protease showing fibrinolytic activity from a newly isolated Gram-negativeBacillussp. strain AS-S20-I[J]. New Biotechnology, 2011, 28(2):182-189.
[9] 路炳声,黄志强,林白雪,等. 海洋氧化短杆菌15E产碱性蛋白酶的发酵条件研究[J]. 福建农林大学学报, 2007, 36(6):591-595.
[10] HAJJI M, REBAI A, GHARSALLAH N, et al. Optimization of alkaline protease production byAspergillusclavatusES1 inMirabilisjalapa tuber powder using statistical experimental design[J]. Applied Microbiology and Biotechnology, 2008, 79(6):915-923.
[11] 夏振强,暴增海,王增池,等. 海洋细菌L1-9菌株蛋白酶的初步纯化及其酶学性质研究[J]. 中国酿造, 2009(11):17-20.
[12] 孙谧,王跃军,张云波,等. 一株产低温碱性蛋白酶嗜冷海洋细菌YS-9412-130的分离和培养条件研究[J]. 海洋水产研究, 2000, 21(4):1-5.
