新疆乌鲁木齐市耐甲氧西林金黄色葡萄球菌耐药性及PVL基因检测
2013-09-21朱震宏刘素辉武贵臻
陈 锋,朱震宏,刘 潇,刘素辉,武贵臻
(1.新疆医科大学基础医学院病原学教研室,乌鲁木齐830011;2.新疆医科大学第一附属医院检验科,乌鲁木齐830011;3.新疆医科大学基础医学院科研中心,乌鲁木齐830011)
金黄色葡萄球菌是目前引起医院感染常见的病原体,可以引起皮肤软组织感染、败血症和中毒性休克综合征等多种疾病。从上世纪九十年代末开始,随着抗菌药物的广泛应用以及各种介入性治疗方法的应用,耐甲氧西林金黄色葡萄球菌(MRSA)感染越来越多,成为医院感染中常见的重要病原菌[1-2];近年 MRSA引起的社区感染也日见增多,引起社区感染的 MRSA(CA-MRSA)多携带杀白细胞素(panton-valentine leukocidin,PVL)基因,主要引起化脓性皮肤感染和坏死性肺炎。MRSA感染具有流行范围广、多重耐药和临床治疗困难等特点,因此了解本地区MRSA的耐药性对指导临床用药和防止其播散有重要意义。本研究的目的是调查新疆医科大学第一附属医院分离的MRSA耐药性和PVL基因携带率,为临床治疗及控制MRSA感染提供依据。
1 材料与方法
1.1 材料 49株MRSA菌株为2011年3~10月从新疆医科大学第一附属医院门诊和住院患者分离所获得的临床分离菌株;质控菌株为金黄色葡萄球菌ATCC25923,来自新疆医科大学微生物教研室。
1.2 试剂 药敏试验用培养基M-H琼脂购自杭州微生物试剂厂,青霉素G、苯唑西林、红霉素、庆大霉素、利福平、呋喃妥因、阿奇霉素、阿米卡星、左氧氟沙星、克林霉素和万古霉素等药敏纸片均购自英国Oxoid公司,引物由上海生工合成,PCR试剂盒购自上海生工,细菌DNA提取试剂盒购自天根生物公司。
1.3 方法
1.3.1 MRSA的鉴定 将临床标本接种于血平板进行分离培养,通过革兰染色、溶血性、血浆凝固酶试验和甘露醇发酵试验进行金黄色葡萄球菌的鉴定;通过表型和基因型检测进行MRSA鉴定。表型检测:采用头孢西丁纸片法,抑菌圈小于或等于21判断为MRSA。基因型检测:按试剂盒说明提取细菌DNA,采用PCR法检测mecA基因。2012年临床和实验室标准协会(CLSI)指出:MRSA的分子生物学检测方法中最准确的方法是检测mecA基因或其编码蛋白青霉素结合蛋白-α(PBP-α),即mecA基因阳性者判定为 MRSA。mecA基因上游引物序列为5′-TGG CTA TCG TGT CAC AAT CG-3′,下游引物序列为5′-CTG GAA CTT GTT GAG CAG AG-3′,扩增片段为310bp。
1.3.2 药敏试验 采用纸片扩散法测定MRSA对10种抗菌药物的敏感性,万古霉素用微量肉汤稀释法,参照CLSI 2009年标准操作进行判读。
1.3.3 PVL基因检测 按试剂盒说明提取细菌DNA。上游引物序列为5′-ATC ATT AGG TAA AAT GTC TGG ACA TGA TCC A-3′,下 游 引 物 序 列 为 5′-GCA TCA AGT GTA TTG GAT AGC AAA AGC-3′,扩增片段为433bp[2]。PCR反应体系为20μL:PCR Master 10μL,引物各1μL,模板DNA 3μL,dH2O 5μL;反应条件为94℃预变性5min,然后94℃变性50s,55℃复性50s,72℃延伸1min,共循环30次,最后72℃延伸5min。取扩增产物5μL进行琼脂糖(2%)凝胶电泳(100V,30min),于紫外灯下观察结果并照相记录。质控菌株为ATCC49775。
2 结 果
2.1 MRSA的检测 49株MRSA菌株均对头孢西丁耐药,均表达mecA基因,见图1。
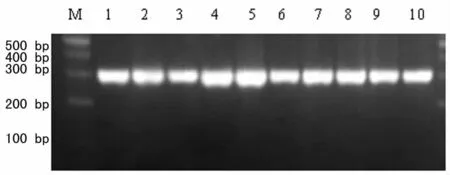
图1 mecA基因PCR扩增电泳图
2.2 药敏试验结果 49株MRSA对青霉素G和苯唑西林100.0%耐药,对利福平耐药率高达95.9%,对阿奇霉素、红霉素、阿米卡星、庆大霉素、左氧氟沙星和克林霉素表现出不同程度的耐药,其耐药率分别为77.8%、77.8%、88.9%、86.7%、83.67%和67.35%,对呋喃妥因耐药性仅为2.2%,对万古霉素全部敏感。
2.3 PVL基因检测 49株MRSA仅31株检出PVL基因,占63.3%,MRSA菌株PVL基因检测结果,见图2。
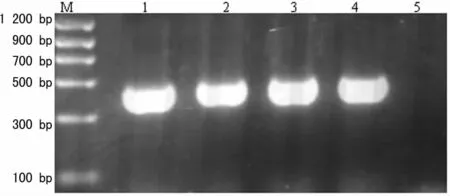
图2 PVL基因PCR结果
3 讨 论
MRSA是医院感染的重要病原菌,对目前临床应用的大多数抗菌药物有很高的耐药率,给临床治疗带来困难,已成为世界范围内耐药监测的重点。本次药敏结果显示,新疆医科大学第一附属医院临床分离的49株MRSA具有多重耐药性,对青霉素G和苯唑西林均耐药,对利福平、红霉素、庆大霉素、阿奇霉素和阿米卡星均有较高的耐药率,尚未发现对万古霉素耐药的菌株。结果表明乌鲁木齐地区MRSA耐药现象比较严重,呈多重耐药,仅对万古霉素敏感性较好,与文献报道的结果一致,故乌鲁木齐地区应该加强对MRSA耐药性的监测,并根据药敏试验结果合理使用抗菌药物,也可以考虑联合用药以降低抗菌药物的使用剂量,避免耐药现象的发生。
PVL可通过改变细胞膜通透性杀伤白细胞,体外试验表明PVL尚可通过线粒体途径诱导白细胞凋亡[3]。目前普遍认为PVL是引起金黄色葡萄球菌皮肤软组织感染及坏死性肺炎的重要毒力因子,产生PVL的金黄色葡萄球菌更容易穿过皮肤引起严重感染[4],动物实验也证实了这一点[5-6],但也有相反的观点[7]。PVL在CA-MRSA)中有较高的携带比例,其阳性被认为是CA-MRSA的分子生物标志。国外报道在CA-MRSA中PVL基因阳性率在80%以上[8],而在医院相关性 MRSA(HA-MRSA)中阳性率较低。国内张楠等[9]报道宁夏地区PVL阳性率仅为9.1%,王风玲等[10]、孙桂珍等[11]报道 MRSA的PVL阳性率分别为46.8%、40.0%,表明产PVL的MRSA在我国临床已占有较高的比例,应引起临床高度重视。在本研究中49株PVL阳性率高达63.3%,而且这些菌株也表现出对红霉素、克林霉素、庆大霉素等抗菌药物的多重耐药性,这与潘宏升等[12]的报道一致。而PVL基因对 MRSA耐药性是否有影响尚有待进一步研究。
新疆是我国艾滋病的高发地区,HIV感染被认为是MRSA定植[13]、感染[14]的危险因素。因此,检测乌鲁木齐地区MRSA的耐药性及毒素基因可为临床正确使用抗菌药物治疗以及更好地控制MRSA感染提供科学的指导依据。
[1] Carleton HA,Diep BA,Charlebois ED,et al.Communityadapted methicillin-resistant Staphylococcus aureus(MRSA):population dynamics of an expanding community reservoir of MRSA[J].J Infect Dis,2004,190(10):1730-1738.
[2] Lina G,Piémont Y,Godail-Gamot F,et al.Involvement of Panton-Valentine leukocidin-producing staphylococcus aureus in primary skin infections and pneumonia[J].Clin Infect Dis,1999,29(5):1128-1132.
[3] Genestier AL,Michallet MC,Prévost G,et al.Staphylococcus aureus Panton-Valentine leukocidin directly targets mitochondria and induces Bax-independent apoptosis of human neutrophils[J].J Clin Invest,2005,115(11):3117-3127.
[4] Gülmez D,Sancak B,Ercis S,et al.Investigation of SCC-mec types and Panton-Valentine leukocidin in communityacquired and nosocomial Staphylococcus aureus strains:comparing skin and soft tissue infections to the other infections[J].Mikrobiyol Bul,2012,46(3):341-351.
[5] Ward PD,Turner WH.Identification of staphylococcal Panton-Valentine leukocidin as a potent dermonecrotic toxin[J].Infect Immun,1980,28(2):393-397.
[6] Bubeck Wardenburg J,Palazzolo-Ballance AM,Otto M,et al.Panton-Valentine leukocidin is not a virulence determinant in murine models of community-associated methicillin-resistant Staphylococcus aureus disease [J].J Infect Dis,2008,198(8):1166-1170.
[7] Srinivasan A,Seifried S,Zhu L,et al.Panton-Valentine leukocidin-positive methicillin-resistant staphylococcus aureus infections in children with cancer[J].Pediatr Blood Cancer,2009,53(7):1216-1220.
[8] Herman RA,Kee VR,Moores KG,et al.Etiology and treatment of community-associated methicillin-resistant Staphylococcus aureus[J].Am J Health Syst Pharm,2008,65(3):219-225.
[9] 张楠,赵志军,贾伟,等.宁夏地区耐甲氧西林金黄色葡萄球菌分子流行病学研究[J].检验医学,2011,26(5):287-290.
[10]王凤玲,张金艳,李红岩,等.杀白细胞素基因阳性耐甲氧西林金黄色葡萄球菌的耐药性分析[J].国际检验医学杂志,2012,33(1):23-24,26.
[11]孙桂珍,于艳华.50株耐甲氧西林金黄色葡萄球菌PVL基因检测及同源性分析[J].中华医院感染学杂志,2009,19(12):1471-1474.
[12]潘宏升,田素飞,年华,等.耐甲氧西林金黄色葡萄球菌的分子流行病学研究[J].微生物学杂志,2011,31(1):34-38.
[13]Hidron AI,Kourbatova EV,Halvosa JS,et al.Risk factors for colonization with methicillin-resistant Staphylococcus aureus(MRSA)in patients admitted to an urban hospital:emergence of community-associated MRSA nasal carriage[J].Clin Infect Dis,2005,41(2):159-166.
[14]Pan ES,Diep BA,Charlebois ED,et al.Population dynamics of nasal strains of methicillin-resistant Staphylococcus aureus-and their relation to community-associated disease activity[J].J Infect Dis,2005,192(5):811-818.
