共染MIP-1α与B7-1诱导乳腺癌大鼠免疫应答能力的研究
2013-08-14梁莉萍贾存东
梁莉萍,贾存东
(新疆医科大学附属肿瘤医院:1.病理科;2.肿瘤内科,乌鲁木齐 830011)
乳腺癌是女性中常见的恶性肿瘤,且发病率随着社会的发展而趋向增长[1-2]。对于乳腺癌的治疗手段多样,大大提高了患者的生存率,但其病死率仍较高,尤其是对于乳腺癌晚期及远处转移的患者,普通的治疗手段往往效果难以令人满意[3-4]。随着医疗相关学科及技术的发展,基因治疗引起了各学者的重视[5]。目前,关于乳腺癌基因治疗的研究仍较少,因此,笔者通过动物实验探讨共转染 MIP-1α与B7-1基因对乳腺癌大鼠免疫效应应答的影响,为临床对乳腺癌患者实施基因治疗提供一个初步的基础。
1 材料与方法
1.1 实验材料 SPF级环境下饲养的SD雌性大鼠40只,体质量25~30g,7~10d;源性乳腺癌细胞株SHZ-88及经逆转录或(和)培育的SHZ-88亲代细胞、SHZ-88/MIP-1α细胞、SHZ-88/B7-1细胞及SHZ-88/MIP-1α+B7-1细胞。
1.2 研究方法
1.2.1 乳腺癌大鼠造模及成瘤实验 采用SHZ-88乳腺癌细胞建立乳腺癌大鼠模型40只,观察模型的稳定性;将实验动物按照接种细胞的不同分成对照组(接种SHZ-88亲代细胞)、MIP-1α组(接种 SHZ-88/MIP-1α细胞)、B7-1组(接种 SHZ-88/B7-1细胞)及联合组(接种SHZ-88/MIP-1α+B7-1细胞),每组10只,观察接种后有无肿瘤生长。
1.2.2 转基因细胞对乳腺癌大鼠的治疗方法 各细胞均经丝裂霉素C灭活,浓度为2.5×107/mL,1周注射1次,每次0.2 mL,共治疗2次。治疗完成2周后取一半大鼠的外周血检测CD4+、CD8+百分比和CD4+/CD8+比值以及白细胞介素2(IL-2)、人γ干扰素(IFN-γ)水平,另一半大鼠用于观察肿瘤体积变化以及生存时间。
1.2.3 观察指标 计算注射转基因肿瘤细胞后乳腺癌大鼠肿瘤体积分别在第1周、第2周、第3周及第4周的大小;记录实验大鼠的生存时间,计算每组的平均值;采用流式细胞术检测大鼠外周血CD4+、CD8+百分比和CD4+/CD8+比值;使用酶联免疫吸附试验法检测大鼠外周血的IL-2、IFN-γ水平。
1.3 统计学处理 采用SPSS17.0建立数据库并对数据进行处理分析,计数资料采用的形式表示,组间差异采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 SD大鼠造模及成瘤结果 采用SHZ-88细胞建立的乳腺癌大鼠模型均成功且稳定,致瘤率达到100%,且肿瘤体积随着时间的延长不断增大。在肿瘤细胞接种10d后,采用SHZ-88亲代细胞接种,成瘤性达到100%;采用SHZ-88/MIP-1α接种,成瘤性降低到20%;采用SHZ-88/B7-1接种,成瘤性降低到30%;而采用SHZ-88/MIP-1α+ B7-1接种则成瘤性消失且保持无瘤状100d以上。
2.2 乳腺癌大鼠肿瘤体积的变化 注射转基因肿瘤细胞的荷瘤大鼠的肿瘤体积在1~4周均较对照组小,差异有统计学意义(P<0.05);而在第2周、第3周及第4周,联合组荷瘤大鼠的肿瘤体积均明显小于MIP-1α组及B7-1组,差异有统计学意义(P<0.05)。见表1。
表1 乳腺癌大鼠肿瘤体积的变化(cm3,,n=10)

表1 乳腺癌大鼠肿瘤体积的变化(cm3,,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与联合组比较。
组别 1周 2周 3周 4周0.89±0.113.26±0.198.05±0.5453.38±2.49 MIP-1α组 0.85±0.08a1.30±0.11ab 3.53±0.33ab 8.22±0.52ab B7-1组 0.86±0.12a1.39±0.13ab 3.84±0.38ab 9.31±0.44ab联合组 0.82±0.14a1.03±0.10a1.64±0.29a5.48±0.47对照组a
2.3 荷瘤大鼠外周血T淋巴细胞亚型百分比比较 MIP-1α组、B7-1组及联合组外周血T淋巴细胞亚型CD4+、CD8+的百分比与CD4+/CD8+均较对照组高(P<0.05);且联合组明显高于 MIP-1α组及B7-1组,差异有统计学意义(P<0.05)。见表2。
表2 荷瘤大鼠外周血T淋巴细胞亚型百分比的比较(,n=10)

表2 荷瘤大鼠外周血T淋巴细胞亚型百分比的比较(,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与联合组比较。
组别 CD4+(%) CD8+(%) CD4+/36.29±1.03 13.19±0.89 2.19±0.20 MIP-1α组 40.80±1.71ab 15.81±1.29ab 2.79±0.09ab B7-1组 40.79±1.28ab 16.41±1.04ab 2.71±0.14ab联合组 44.28±4.10a 19.81±1.91a 3.08±0.23 CD8+对照组a
表3 荷瘤大鼠生存天数、外周血IL-2及IFN-γ水平的比较(,n=10)
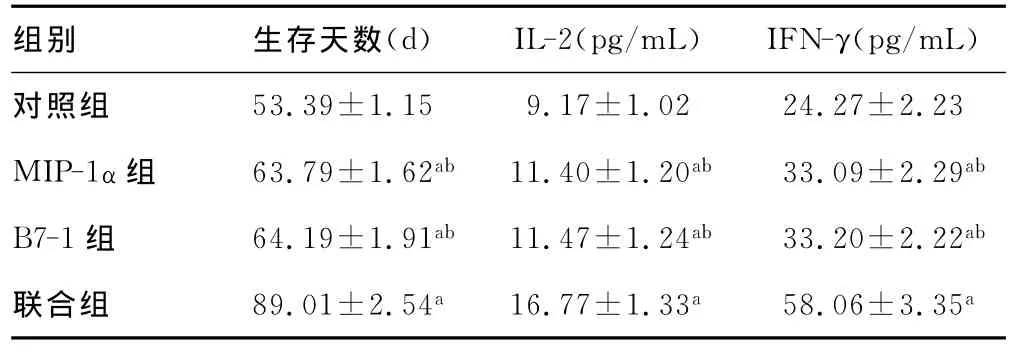
表3 荷瘤大鼠生存天数、外周血IL-2及IFN-γ水平的比较(,n=10)
a:P<0.05,与对照组比较;b:P<0.05,与联合组比较。
组别 生存天数(d) IL-2(pg/mL) IFN-γ(pg/mL)53.39±1.15 9.17±1.02 24.27±2.23 MIP-1α组 63.79±1.62ab 11.40±1.20ab 33.09±2.29ab B7-1组 64.19±1.91ab 11.47±1.24ab 33.20±2.22ab联合组 89.01±2.54a16.77±1.33a 58.06±3.35对照组a
2.4 荷瘤大鼠的生存天数、外周血IL-2及IFN-γ水平比较MIP-1α组、B7-1组及联合组荷瘤大鼠的生存天数均明显多于对照组(P<0.05);且联合组较 MIP-1α组及B7-1组明显延长,差异有统计学意义(P<0.05)。MIP-1α组、B7-1组及联合组大鼠外周血的IL-2及IFN-γ水平均明显高于对照组(P<0.05);且联合组的水平明显高于 MIP-1α组及B7-1组,差异有统计学意义(P<0.05)。
3 讨 论
肿瘤患者存在不同程度的免疫抑制[6-7],且随肿瘤负荷的增大而越趋明显,导致肿瘤局部未能显现出有效的抗肿瘤免疫应答[8]。因此,尝试提高免疫效应细胞的数量及质量,激发机体产生抗肿瘤免疫应答,增强肿瘤局部免疫原性,逆转免疫抑制状态,可达到治疗肿瘤的效果。
MIP-1α主要生物功能有[9-10]:管理炎性反应;参与 T 淋巴细胞免疫反应;增强单核、巨噬细胞、T淋巴细胞与内皮细胞的黏附性;诱导各种炎性介质的产生等。肿瘤细胞往往缺乏B7分子的共刺激作用,未能有效激活T细胞,使得肿瘤细胞未能被机体免疫系统攻击[11]。转染B7-1分子,促进第二信号系统作用,激活T细胞效应,可产生抗肿瘤作用[11-12]。本实验结果显示在乳腺癌大鼠模型内接种转染MIP-1α与B7-1细胞后,成瘤性消失且保持无瘤状态超过100d,荷瘤大鼠生存时间明显长于转染单基因及亲代肿瘤细胞大鼠。可见转染 MIP-1α与B7-1能够提高肿瘤局部有效的免疫效应细胞数量及质量,提高肿瘤的免疫原性,激发强烈的抗肿瘤作用。
T淋巴细胞介导的细胞免疫是抗肿瘤免疫效应机制的最主要部分,其主要元素是激活状态下的T细胞CD4+及CD8+2个亚型,加以CD4+/CD8+可作为反映机体免疫功能状态的指标[13]。CD4+细胞参与巨噬细胞、B细胞、NK细胞等的激活,还可分泌各种细胞因子,从而起到抗肿瘤的作用[14]。CD8+细胞对肿瘤细胞具有一定的杀伤作用且不伤害正常细胞[15]。细胞因子中以IL-2及IFN-γ在抗肿瘤效应中起主要作用[16-17]。因此,本研究通过测定CD4+、CD8+、CD4+/CD8+及IL-2、IFN-γ水平来评价荷瘤大鼠接种转基因细胞后的抗肿瘤免疫效应。结果显示,共转染MIP-1α与B7-1细胞的荷瘤大鼠外周血CD4+、CD8+百分比和CD4+/CD8+比值以及IL-2、IFN-γ水平均明显高于对照组及转染单基因的大鼠,可见共转染 MIP-1α与B7-1后,能明显提高机体的免疫效应,大大提高抗肿瘤作用。
本实验表明,协同 MIP-1α与B7-1的不同作用原理及机制,能增强对乳腺癌大鼠的抗肿瘤作用,疗效明显优于单基因治疗,可为日后进一步的实验研究提供初步的参考。
[1]吴爱国.乳腺癌基因治疗研究现状[J].中华乳腺病杂志:电子版,2008,2(5):561-570.
[2]荀艳莉.关于国内乳腺癌治疗的进展研究[J].科技资讯,2012(8):242.
[3]唐金海,徐晓明.乳腺癌规范化和个体化治疗进展[J].肿瘤学杂志,2011,17(5):325-330.
[4]冉健,孙万邦.乳腺癌免疫生物治疗研究进展[J].国际检验医学杂志,2012,33(2):197-199.
[5]杜力成,王栋,刘奇,等.乳腺癌基因治疗的研究进展[J].医学综述,2012,18(20):3400-3403.
[6]Boniface JD,Poschke I,Mao Y,et al.Tumor-dependent down-regulation of theζ-chain in T-cells is detectable in early breast Cancer and correlates with immune cell function[J].Int J Cancer,2012,131(1):129-139.
[7]万华,邹强,董佳容,等.乳腺癌患者免疫指标检测及其临床意义[J].肿瘤,2006,26(3):279-281.
[8]刘季芳,祁岩超.肿瘤免疫编辑研究进展[J].广东医学,2009,30(10):1579-1581.
[9]刘志忠,陈燕,叶虹等.星形细胞瘤和髓母细胞瘤患儿血清IL-6、IL-8和 MIP-1α水平变化[J].标记免疫分析与临床,2012,19(5):278-281.
[10]张佩莲.趋化因子 MCP-1、MIP-lα、RANTES与自身免疫性疾病[J].皮肤病与性病,2012,34(4):204-207.
[11]Ilias Basha H,Tiriveedhi V,Fleming TP,et al.Identification of immunodominant HLA-B7-restricted CD8+ cytotoxic T cell epitopes derived from mammaglobin-A expressed on human breast cancers[J].Breast Cancer Res Treat,2011,127(1):81-89.
[12]孙宏治,宫建,王巍,等.协同刺激分子CD28、B7-1在乳腺癌患者外周血的表达及意义[J].山东医药,2011,51(41):57-58.
[13]顾敏,范原铭,王强等.乳腺癌患者外周血CD4+、CD8+以及CD4+CD25+调节性T细胞变化及其意义[J].重庆医学,2009,38(7):869-871.
[14]Khan MM,Chatterjee S,Dwivedi VP,et al.CD4+ T cellderived novel peptide Thp5induces interleukin-4production in CD4+ T cells to direct T helper 2cell differentiation[J].J Biol Chem,2012,287(4):2830-2835.
[15]于益芝,曹雪涛.调节性T细胞在肿瘤免疫和肿瘤免疫治疗中的作用[J].中国肿瘤生物治疗杂志,2010,17(1):1-6.
[16]Tomala J,Chmelova H,Mrkvan T,et al.In vivo expansion of activated naive CD8+T cells and NK cells driven by complexes of IL-2and anti-IL-2monoclonal antibody as novel approach of Cancer immunotherapy[J].J Immunol,2009,183(8):4904-4912.
[17]黄文炼,徐曼,王婷婷等.乳腺癌B7-H4异常表达及与肿瘤内CD8+T细胞浸润IFN-γ分泌的相关性研究[J].中国肿瘤临床,2012,39(15):1096-1099,1103.
