辛伐他汀与阿托伐他汀对高糖培养大鼠肾小球系膜细胞p27蛋白表达的影响
2013-08-14徐艳丽李青菊
徐艳丽,李青菊
(郑州大学第二附属医院内分泌科 450014)
近年来他汀类药物对糖尿病肾病非依赖降脂的肾脏保护作用越来越受到人们的重视。糖尿病肾病早期病理特征为肾小球系膜细胞的增殖与肥大[1]。p27是一种重要的细胞周期激酶抑制剂,其在肾小球系膜细胞增殖与肥大过程中起到重要作用[2]。他汀类药物是否通过影响p27蛋白的表达来发挥非依赖降脂的肾脏保护作用目前还不完全清楚。本实验采用体外培养大鼠肾小球系膜细胞,观察辛伐他汀及阿托伐他汀对高糖刺激大鼠肾小球系膜细胞p27蛋白表达的影响,以探讨他汀类药物的非依赖降脂肾脏保护的作用机制。
1 材料与方法
1.1 材料 大鼠肾小球系膜细胞株(中国科学院典型培养物保藏委员会,细胞数量5×107),葡萄糖浓度为5.6mmol/L的低糖DMEM(细胞培养基)培养液(Thermo公司),Trizol试剂(Invitrogen公司),逆转录试剂盒(Fermentas公司),辛伐他汀(Merck公司),阿托伐他汀(辉瑞制药有限公司),兔抗p27单克隆抗体(CST公司),鼠抗β-actin单克隆抗体(武汉博士德公司)等。
1.2 方法
1.2.1 细胞培养及分组 将大鼠肾小球系膜细胞置于含5%CO2,37℃的培养箱中,用含10%胎牛血清的低糖DMEM培养液进行常规培养,每2天换液1次,待细胞铺满整个培养瓶底的80%时可行传代培养。传至第5~6代可进行实验。实验前24h用不含胎牛血清的DMEM培养基进行培养。细胞分为4组(各组细胞数量106):正常对照组:培养液中葡萄糖浓度为5.6mmol/L;高糖组:葡萄糖浓度为30mmol/L;高糖辛伐他汀组:葡萄糖浓度为30mmol/L,辛伐他汀浓度为10μmol/L;高糖阿托伐他汀组:葡萄糖浓度为30mmol/L,阿托伐他汀浓度为10μmol/L。每组设置6个复孔,于24、48、72、120h收集细胞进行蛋白及mRNA的测定。
1.2.2 观察细胞形态 4组细胞分别在24、48、72、120h在倒置相差显微镜下观察细胞形态并拍照记录。
1.2.3 逆转录PCR(RT-PCR)测定细胞p27mRNA的表达采用Trizol试剂提取细胞总mRNA,RT-PCR试剂盒进行逆转录。RT-PCR法测定大鼠肾小球系膜细胞p27mRNA的表达,RT-PCR引物详细序列如下:p27引物序列:正链为5′-GGA CTT GGA GAA GCA CTG C-3′,反链为5′-CGA GTC AGG CAT TTG GTC C-3′,扩增片段大小为282bp。GAPDH引物序列:正链为5′-GAC AAG ATG GTG AAG GTC GG-3′,反链为5′-CAT GGA CTG TGG TCA TGA GC-3′,扩增片段大小为538bp。PCR反应条件为:95℃预变性5min,94℃变性40s,60℃退火40s,72℃延伸30s,循环结束后72℃延伸7 min,循环38次。PCR产物加于2%的琼脂糖凝胶(0.5μg/mL EB),120V电泳20min。通过凝胶成像分析系统扫描,测定电泳条带的灰度,灰度值是将目的基因与内参基因的电泳条带灰度值相比作为数据进行统计学分析。
1.2.4 Western blotting测定细胞p27蛋白的表达 裂解液裂解细胞收集细胞总蛋白,采用BCA法进行蛋白浓度的测定,取总蛋白75μg,经12%的SDS-PAGE电泳后,转移至聚偏二氟乙烯膜上,并用丽春红染色观察转移效果。然后用含有封闭液的TBST室温封闭1h,弃去原有封闭液,加入用5%脱脂奶粉稀释的p27兔单克隆抗体(1∶1000稀释)及β-actin单克隆抗体(1∶500稀释),4℃过夜。洗膜后加辣根过氧化酶标记的IgG(1∶4000稀释),置于脱色摇床上,使之充分反应2h。再次用TBST洗膜3次,每次15min,再次洗膜后加入ECL显色剂,增强化学发光。采用凝胶图像分析系统及Genetool软件对蛋白条带进行分析,用测量得到的p27/β-actin光密度比值作为p27蛋白的相对表达量。
1.3 统计学处理 采用SPSS17.0分析软件进行统计学处理,计量资料用表示,组间比较用单因素方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠肾小球系膜细胞形态学 正常对照组肾小球系膜细胞呈长梭形,核呈圆形,居中间。高糖组细胞数量增多,体积增大,成旋涡状排列。高糖辛伐他汀组和高糖阿托伐他汀组细胞数量减少。见图1。
2.2 各组大鼠肾小球系膜细胞p27mRNA转录水平 表1结果显示,在不同时间段,高糖组、高糖辛伐他汀、高糖阿托伐他汀组p27mRNA转录量均较正常对照组升高(P<0.05);在不同时间段,高糖辛伐他汀组、高糖阿托伐他汀组大鼠肾小球系膜细胞p27mRNA表达较高糖组降低(P<0.05)。
2.3 各组大鼠肾小球系膜细胞p27蛋白表达水平 表2结果显示,在不同时间段,高糖组、高糖辛伐他汀组、高糖阿托伐他汀组p27蛋白表达均较正常对照组升高(P<0.05);在48、72及120h,高糖辛伐他汀组p27蛋白表达均较高糖组降低(P<0.05);在24、48、72及120h,高糖阿托伐他汀组p27蛋白表达均较高糖组降低(P<0.05)。

图1 各组大鼠肾小球系膜细胞形态学
表1 各组大鼠肾小球系膜细胞p27mRNA转录水平(,n=6)

表1 各组大鼠肾小球系膜细胞p27mRNA转录水平(,n=6)
a:P<0.05,与正常对照组比较;b:P<0.05,与高糖组比较。
组别24h 48h 72h 120h正常对照组 0.384±0.175 0.386±0.210 0.392±0.172 0.395±0.182高糖组 1.006±0.182a 1.010±0.210a 1.384±0.175a 1.639±0.279a高糖辛伐他汀组 0.887±0.172a 0.697±0.249ab 0.656±0.096ab 0.560±0.144ab高糖阿托伐他汀组 0.866±0.085ab 0.688±0.256ab 0.630±0.166ab 0.537±0.141ab
表2 各组大鼠肾小球系膜细胞p27蛋白相对表达量(,n=6)
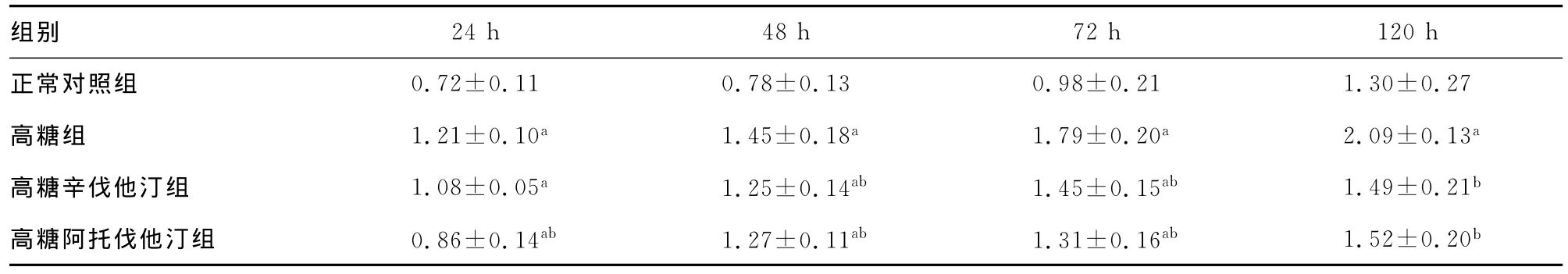
表2 各组大鼠肾小球系膜细胞p27蛋白相对表达量(,n=6)
a:P<0.05,与正常对照组比较;b:P<0.05,与高糖组比较。
组别24h 48h 72h 120h正常对照组0.72±0.11 0.78±0.13 0.98±0.21 1.30±0.27高糖组 1.21±0.10a 1.45±0.18a 1.79±0.20a 2.09±0.13a高糖辛伐他汀组 1.08±0.05a 1.25±0.14ab 1.45±0.15ab 1.49±0.21b高糖阿托伐他汀组 0.86±0.14ab 1.27±0.11ab 1.31±0.16ab 1.52±0.20b
3 讨 论
有文献报道,高糖培养下肾小球系膜细胞前期以增殖为主,进一步的高糖刺激,细胞复制停滞于G1期,引起细胞的肥大[3-6]。在高糖状态下,p27蛋白的过度表达,抑制了细胞周期素激酶的活性,激酶活性的降低导致了肾小球系膜细胞停滞于G1期,不能正常进入S期,出现肥大。国外研究报道,体外培养的小鼠系膜细胞在高糖刺激下也停顿于细胞周期的G1期,且发生了细胞的肥大[7],并且p27蛋白水平也呈增高趋势。与本研究结果较为一致。
近年来他汀类药物的非依赖降脂的肾脏保护作用越来越受到人们的重视。糖尿病肾病的重要病理特征之一便是转化生长因子β1(TGF-β1)的过度表达,辛伐他汀可明显降低高糖培养下肾小球系膜细胞上清液中TGF-β1的浓度的,并抑制肾小球系膜细胞的增殖及减少细胞外基质蛋白的产生,从而发挥肾脏保护作用[8]。也有研究发现,辛伐他汀可通过降低糖尿病肾病患者血清相关炎症因子如CRP、IL-6及TNF-α的水平进而减少尿蛋白,保护肾脏功能[3,9]。阿托伐他汀可通过降低糖尿病肾病患者超敏C反应蛋白、蛋白尿延缓肾功能的恶化[4,10]。阿托伐他汀也可抑制肾小球系膜细胞的增殖、抑制血管紧张素Ⅱ、TGF-β1的表达及分泌,进而降低基质蛋白的生成与沉积发挥保护肾脏的功能[11]。本研究发现,辛伐他汀与阿托伐他汀可明显降低高糖培养的大鼠肾小球系膜细胞p27蛋白表达水平及mRNA转录水平,据此可以认为,辛伐他汀与阿托伐他汀可通过抑制p27蛋白的表达,使细胞周期能够顺利地进入S期,降低肾小球系膜细胞的肥大,减轻糖尿病肾病患者的肾脏肥大,对肾脏发挥保护作用。因此本研究建议,无论糖尿病患者有无脂质代谢异常,均可以使用他汀类药物治疗早期糖尿病肾病[12]。
[1]钱华翔,何爱琴,缪珩,等.Resveratrol对高糖培养大鼠肾小球系膜细胞氧化应激和p27蛋白表达的影响[J].南京医科大学学报:自然科学版,2011,31(5):656-659.
[2]Wolf G,Reinking R,Zahner G,et al.Erk 1,2phosphorylates p27(Kip1):Functional evidence for a role in high glucose-induced hypertrophy of mesangial cells[J].Diabeto-logia,2003,46(8):1090-1099.
[3]杨轶青,蒋慧君,韦红金,等.辛伐他汀治疗早期糖尿病肾病的疗效评价[J].临床荟萃,2011,26(19):1674-1676.
[4]潘攀,周海艳,杨晶.阿托伐他汀治疗早期糖尿病肾病临床疗效观察[J].中华全科医学,2010,8(11):1374-1375.
[5]Ding DF,You N,Wu XM,et al.Resveratrol attenuates renal hypertrophy in early-stage diabetes by activating AMPK[J].Am J Nephrol,2010,31(4):363-374.
[6]丁大法,游娜,徐家蓉,等.Resveratrol对糖尿病大鼠肾皮质4E-BP1和S6磷酸化表达的影响[J].南京医科大学学报:自然科学版,2009,29(10):1347-1351.
[7]Wolf G,Schroeder R,Ziyadeh FN,et al.High glucose stimulates expression of p27Kip1in cultured mouse mesangial cells:relationship to hypertrophy[J].Am J Physiol,1997,273(3Pt 2):348-356.
[8]曹宏,杨涛,刘超,等.辛伐他汀对高糖培养肾小球系膜细胞增殖和促基质蛋白分泌的影响[J].南京医科大学学报:自然科学版,2003,23(1):56-59.
[9]翟小琳,徐晓燕.辛伐他汀对糖尿病肾病相关炎症因子的影响分析[J].中国实用医药,2009,4(7):128-129.
[10]肖宁.阿托伐他汀治疗糖尿病早期肾病的疗效观察[J].实用心脑肺血管病杂志,2012,20(10):1660,1662.
[11]缪珩,李慧敏,蒋秀琴,等.阿托伐他汀对高糖培养人肾系膜细胞的作用[J].江苏医药,2005,31(4):255-257.
[12]Costa J,Borges M,David C,et al.Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients:meta-analysis of randomised controlled trials[J].BMJ,2006,332(7550):1115-1124.
