不同粗饲料组合全混合日粮对泌乳奶牛瘤胃液微生物蛋白浓度24 h变化和小肠微生物蛋白流量的影响
2013-09-20张智慧杨红建任清长李胜利
张智慧 杨红建 任清长 金 鑫 李胜利
(中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193)
反刍动物小肠代谢蛋白质由过瘤胃蛋白质、瘤胃微生物蛋白(MCP)和内源性蛋白质组成。MCP合成量的高低不仅可以反映瘤胃中微生物的数量,而且能反映MCP合成的效率[1]。MCP可为宿主提供所需小肠代谢蛋白质的40% ~60%[2],其传统测定方法主要包括内源指示剂法(微生物核酸)和外源指示剂法(35N、15S)[3]。上述方法均需瘘管动物,而瘘管安装本身会对动物正常生理机能产生一定的侵害性,不利于准确地估测MCP合成量[4-5]。Topps等[6]发现瘤胃 MCP 合成量与尿中嘌呤衍生物(purine derivative,PD)排出量具有线性相关性,并首次提出将尿液PD作为MCP测定的内源性标记物。十二指肠中的核酸主要源于瘤胃中微生物体嘌呤的降解物,经肠道消化吸收后,经尿液以尿囊素为主排出[7]。此后,Chen等[8-9]建立了通过尿中PD排出量来估测小肠中MCP 流量的方法。González-Ronquillo等[10]研究发现在奶牛上应用此方法所测定的MCP流量与外源指示剂法测定结果基本一致。尿液PD法因其对试验动物无侵害、易操作,准确性较高而倍受青睐,其影响因素主要有动物种类、饲粮组成、饲料加工处理方法等[11]。饲粮碳水化合物在瘤胃内发酵产生的VFA可作为MCP合成的碳架,ATP为微生物生长提供能量,是MCP合成的动力,其水平高低和来源差异可影响MCP合成。目前,我国奶牛养殖业普遍存在优质饲草短缺,只有一些大型规模化牛场有条件饲喂苜蓿、羊草等优质牧草。为了最大限度保持较高产奶量,通常做法是通过提高饲粮中精饲料比例来满足产奶能量需要,但易面临瘤胃亚急性酸中毒(SARA)等异常代谢疾病频发风险。本试验在高精饲料比例饲粮条件下,以玉米秸、玉米秸黄贮、全株玉米青贮为主要粗饲料原料,辅以羊草和苜蓿优质干草,旨在探讨不同粗饲料组合全混合日粮(TMR)对泌乳奶牛瘤胃液MCP浓度24 h变化和小肠MCP流量的影响,进而从MCP合成量角度评估最低优质粗饲料的适宜用量。
1 材料与方法
1.1 试验动物与试验设计
选用5头体况良好,体重(543±45)kg,年龄4岁,泌乳期[(60±13)d]和日均产奶量[(18.47±0.77)kg]相近,安装有大口径瘤胃瘘管的荷斯坦奶牛作为试验动物。采用5×5拉丁方设计,分5期完成试验,每期18 d,前15天为预试期,后3天为正试期。试验期内每天配制TMR,在每天07:00和19:00分2次集中饲喂,栓系饲养,机械挤奶(05:30和17:30),全天自由饮水。试验TMR精粗比为61:39,各处理粗饲料组合如下:TMR1,100% 玉米秸;TMR2,50% 玉米秸与50%玉米秸黄贮;TMR3,50%玉米秸黄贮与50%全株玉米青贮;TMR4,50%羊草与50%全株玉米青贮;TMR5,34%羊草、33%全株玉米青贮与33%苜蓿。精饲料组成见表1。试验TMR组成及营养水平见表2。
1.2 样品采集与分析测定
1.2.1 瘤胃液的采集与MCP浓度测定
在正试期内第1天01:00、07:00(晨饲)、13:00、19:00(晚 饲),第 2 天 03:00、09:00、15:00、21:00,第 3 天 05:00、11:00、17:00、23:00采集共12个时间点的瘤胃液,每个时间点采集5头牛瘤胃液样品,并经4层纱布过滤后保存于-20℃中。取1 mL瘤胃液,430×g离心5 min,去除原虫和饲料颗粒后,参照Makkar等[12]的比色法进行MCP浓度测定。

表1 精饲料组成(干物质基础)Table 1 Concentrate composition(DM basis)%
1.2.2 尿液的采集与尿中嘌呤衍生物测定
在正试期内,连续3 d 24 h全收尿并记录尿量。在尿桶中预加入200 mL 10%的稀硫酸使pH<3.0,以防止尿样的腐败分解,并分装于塑料瓶中-20℃条件下贮存。将待测尿样稀释50倍用于尿囊素含量测定,稀释10倍用于尿酸含量测定。参照Chen等[9]的应用比色法在522 nm处测定尿囊素含量、尿酶法在293 nm处测定尿酸含量。PD排出量(Y,mmol/d)与嘌呤吸收量(X,mmol/d)之间的关系如下:

瘤胃液微生物氮(MN)计算式:

式中:70为每毫摩尔嘌呤所含的氮量(mg);0.83为微生物核酸嘌呤的消化率;0.116为微生物嘌呤氮与总氮的比值[9]。
1.3 数据处理及统计分析
试验数据经 Excel 2007整理后,采用 SAS 9.1.3统计软件中GLM过程进行单因素方差分析,采用Duncan氏法和MEANS语句统计组间差异的显著性。差异性显著水平为P<0.05。
2 结果
2.1 不同TMR模式下瘤胃液MCP浓度24 h变化
由表3可知,瘤胃液MCP浓度24 h不同时间点差异不显著(P>0.05)。在数值上,瘤胃液MCP浓度总体趋势为:TMR3>TMR4>TMR2>TMR5>TMR1。统计分析表明,不同TMR间瘤胃液MCP浓度平均值差异显著(P<0.05),TMR3的瘤胃液MCP浓度平均值最高(1.217 mg/mL),与 TMR1、TMR5差异显著(P <0.05),但与TMR2、TMR4差异不显著(P>0.05)。
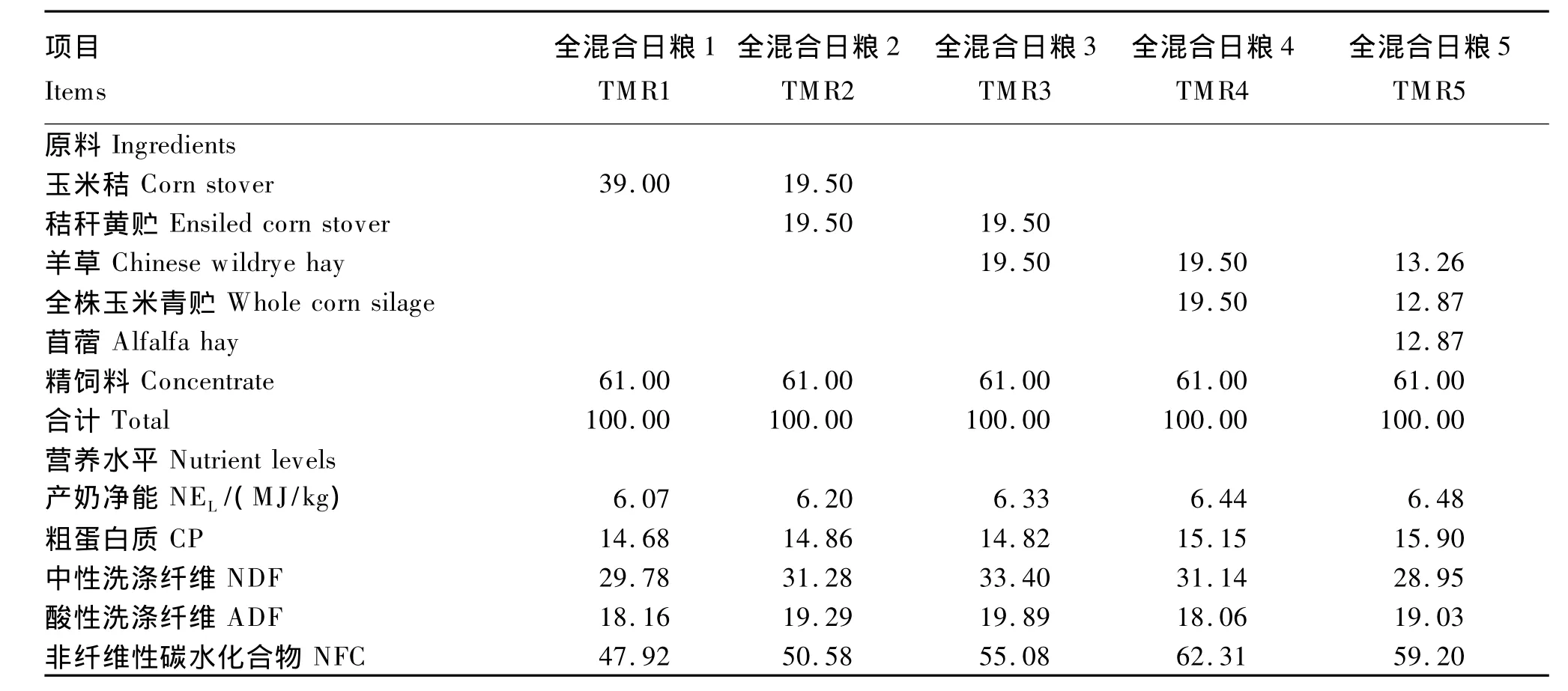
表2 试验TMR组成及营养水平(干物质基础)Table 2 Composition and nutrient levels of experimental TMR(DM basis) %

表3 不同TMR模式下瘤胃液MCP浓度24 h变化Table 3 The variation of rumen fluid MCP concentration in 24 hours under different TMR mg/mL
2.2 不同TMR模式下尿中氮代谢指标
由表4可知,5种试验TMR尿排出量范围为16.3~19.1 L/d,但不同TMR间差异不显著(P>0.05)。TMR1至 TMR5的尿囊素排出量,从106.64 mmol/L升高至139.45 mmol/L,占 PD排出量的 83% ~92%。TMR5与 TMR2、TMR3、TMR4差异不显著(P>0.05),但与TMR1差异显著(P<0.05),比TMR1增加了30.77%。TMR2、TMR3、TMR4、TMR5与 TMR1相比较,尿酸排出量依次升高了69%、108%、146%、183%,差异显著(P<0.05)。在数值上,TMR1至 TMR5的 PD排出量依次升高,TMR4和TMR5显著高于TMR1和TMR2(P<0.05),TMR3居中。MN和 MCP合成量与PD排出量变化一致。在数值上,TMR1至TMR5的MN和MCP合成量依次升高,TMR4和TMR5显著高于TMR1和TMR2(P<0.05),TMR3居中。

表4 不同TMR模式下尿中氮代谢指标Table 4 Nitrogen metabolic indices in urine under different TMR
3 讨论
反刍动物经小肠黏膜可吸收的嘌呤来源主要包括瘤胃微生物核酸、饲粮核酸和宿主体组织代谢内源性核酸。有研究表明,瘤胃微生物体核酸含量很高(约8%),饲粮中核酸含量很低(小于1%)且大部分在瘤胃中在微生物作用下被降解,体组织代谢内源性核酸排出量相对稳定,因此由前段消化道流入小肠内被吸收的嘌呤主要来自微生物体核酸[13]。有研究表明,微生物体核酸的消化率可达85%[9]。从小肠内壁吸收的嘌呤核苷和游离碱基中,一小部分重新合成核酸,进而合成体组织,被各种器官利用。其余大部分则被降解为尿囊素、尿酸、黄嘌呤和次黄嘌呤,并随尿液排出体外。由于牛小肠黏膜上的黄嘌呤氧化酶活性很高,可将所有吸收的嘌呤转化为尿酸后进入肝脏被代谢,而不再被体组织利用。那些被吸收的未合成体组织核酸的嘌呤则完全转化为代谢终产物,即嘌呤衍生物[9]。尿中PD排出量与在小肠吸收的嘌呤量呈正相关。由于微生物体内嘌呤量与其体内蛋白质含量具有一定数量比例关系,因此,可根据PD排出量计算出微生物体嘌呤吸收量,进而估计出到达小肠的MCP流量[14]。本研究中5种TMR处理尿囊素占PD排出量的83%~92%,尿酸占PD排出量的8%~17%。本研究中未检测黄嘌呤和次黄嘌呤,这是因为奶牛体组织和血液中的黄嘌呤氧化酶活性很高,可将黄嘌呤和次黄嘌呤转化为尿酸[9]。徐萍[11]研究发现,中国荷斯坦成年公牛尿中尿囊素占PD排除量的比例为73% ~88%,而马广川[15]在研究中国荷斯坦泌乳期奶牛时发现,这一比例为68% ~86%。本试验中尿囊素占PD排出量的比例高于之前报道,这可能因动物性别和所处泌乳生理阶段的差异,导致利用外源嘌呤以及嘌呤降解酶的活性不同。
除了动物种类、年龄、性别、体重、采食量、饲喂频率、瘤胃外流速度和瘤胃液氨态氮浓度等因素之外,反刍动物饲粮中碳水化合物通常高达60% ~70%[16-17],饲粮精粗比、蛋白质和碳水化合物水平和来源以及饲粮能量水平也是是影响尿中PD排出量的重要影响因子[11]。一般将碳水化合物分为结构性碳水化合物(SC)和非结构性碳水化合物(NSC)。目前,NSC和非纤维性碳水化合物(NFC)可作为反映易消化非结构性碳水化合物的指标。由于NSC测定步骤较为繁琐,通常亦用NFC计算值代替NSC实测值。前人研究发现,MCP合成量的高低与饲粮中SC、NSC以及蛋白质降解产生能量的利用效率有关[18-19],淀粉、果胶等NSC与SC的比例是影响MCP合成的重要因素[20]。McCarthy等[21]在泌乳奶牛上的4 ×4 拉丁方试验以及Stokes等[18]的体外连续培养研究中均发现,当饲粮中NSC比例较高时,MCP合成量增加。在本试验中,随着饲粮中非纤维性碳水化合物/中性洗涤纤维(NFC/NDF)增加,到达小肠的MCP合成量增加,这可能是由于来自饲粮在瘤胃中可快速发酵的糖类和淀粉等增加造成的。本试验TMR中精粗比相同,不同TMR间NFC/NDF的差异可以认为是粗饲料组合不同引起的。从表2中可看出,5种TMR间粗蛋白质水平并无明显差异,即在TMR氮供给水平无明显差异下,随着TMR中NFC/NDF比例升高,增加了瘤胃微生物可发酵能的利用,进而导致MCP合成量增加。周永康[16]在徐淮山羊上的试验亦获得相似结果。
Chen等[14]指出,尿中 PD排出量与瘤胃液MCP合成量高度相关,因此尿中PD排出量反映了瘤胃MCP的合成情况。本试验中,尿囊素、尿酸和PD排出量均随TMR中NFC/NDF比例升高而显著升高(5种TMR中NFC/NDF分别为:1.609、1.617、1.649、2.001、2.045)并且由此估计的流入小肠的MN合成量、MCP合成量也显著升高。统计分析表明,尿囊素(y=50.44x+35.58,R2=0.733)、尿酸(y=27.22x-28.77,R2=0.734)和 PD排出量(y=77.67x+6.811,R2=0.734)均与TMR中NFC/NDF存在线性正相关关系。
颜品勋[22]研究发现饲料类型、种类不同,瘤胃食糜外流速度亦不同。特别是对于粗饲料,饲料种类的不同(比重上的差异)与颗粒大小不同(细度上的差异)直接影响外流速度。韩兴泰等[23-24]以不同饲粮饲喂牦牛时发现,十二指肠食糜流量随采食量升高而升高,且牦牛采食优质鲜绿青草、燕麦青干草和燕麦干草时的瘤胃食糜外流速度高于采食麦秸。本试验中瘤胃液MCP浓度随5种TMR呈现先升高后降低的变化趋势,与尿液PD法估计的小肠MCP流量有所差异,这可能与瘤胃食糜外流速度有关。后2种TMR中青贮与苜蓿和羊草优质干草的加入使得适口性增加,5种TMR 的 采食量分 别为 19.37、19.58、19.86、19.96、19.97 kg/d[25],采食量升高可能导致从瘤胃中流入小肠的MCP流量随之增加。
4 结论
①在高精饲料条件下,玉米秸黄贮、全株玉米青贮搭配或替代玉米秸秆饲喂泌乳奶牛可在一定程度上提高奶牛尿中PD排出量、流入小肠的MN和MCP合成量,但没有与羊草、苜蓿这类优质粗饲料组合效果显著,即羊草+青贮+苜蓿>羊草+青贮>黄贮+羊草>玉米秸+黄贮>玉米秸。
②由尿液PD法估计的流入小肠的MCP合成量与瘤胃液中的MCP浓度存在差异,提示不能单一用瘤胃液MCP浓度评定MCP合成情况,应结合小肠MCP测定技术或估测方法。
[1]CARDOZO P W,CALSAMIGLIA S,FERRET A,et al.Effects of natural plant extracts on ruminal protein degradation and fermentation profiles in continuous culture[J].Journal of Animal Science,2004,82(11):3230-3236.
[2]CHURCH D C.The ruminant animal digestive physiology and nutrition[M].Englewood Cliffs,N.J.:Waveland Press,1988:108-116.
[3]BRODERICK G A,MERCHEN N R.Markers for quantifying microbial protein synthesis in the rumen[J].Journal of Dairy Science,1992,75:2618-2632.
[4]TITGEMEYER E C.Design and interpretation of nutrient digestion studies[J].Journal of Animal Science,1997,75:2235-2247.
[5]DEWHURST R J,DAVIES D R,MERRY R J.Microbial protein supply from the rumen[J].Animal Feed Science and Technology,2000,85:1-21.
[6]TOPPS J H,ELLIOTT R C.Relationships between concentrations of ruminal nucleic acid and excretion ofpurine derivatives by sheep[J].Nature,1965,205:498-499.
[7]MCALLAN A B,SMITH R H.Degradation of nucleic acids on the rumen[J].British Journal of Nutrition,1973,29:331-340.
[8]CHEN X B,HOVELL F D DeB,ØRSKOV E R,et al.Excretion of purine derivatives by ruminants:effect of exogenous nucleic acid supply on purine derivative excretion by sheep[J].British Journal of Nutrition,1990,63:131-142.
[9]CHEN X B,GOMES M J.Estimation of microbial protein supply to sheep and cattle based on urinary excretion of purine derivatives:an over view of the technical details[M].Bucksburn Aberdeen:Occasional Publication,1995:1-22.
[10]GONZÁLEZ-RONQUILLO M,BALCELLS J,BELENGUER A,et al.A comparison of purine derivatives excretion with conventional methods as indices of microbial yield in dairy cows[J].Journal of Dairy Science,2004,87(2):211-221.
[11]徐萍.日粮类型对中国荷斯坦成年牛尿中嘌呤衍生物排出的影响[D].硕士学位论文.北京:中国农业大学,2006:12-15.
[12]MAKKAR H P S,SHARMA O P,DAWRA R K,et al.Simple determination of microbial protein in rumen liquor[J].Journal of Dairy Science,1982,65:2170-2173.
[13]ANTONIEWICZ A M,HEINEMANN W W,HANKS E W.Effect of level of feed intake and body mass on allantoin excretion and the allantoin to creatinine ratio in the urine of sheep[J].Roczniki Nauk Rolniczych:Zootechniczna,1981,8:49-65.
[14]CHEN X B,MAYUSZEWSKI W,KOWALCZYK J.Determination of allantoin in biological cosmetic and pharmaceutical samples[J].Journal of AOAC International,1996,79(3):628-635.
[15]马广川.比较不同生理阶段中国荷斯坦奶牛尿中嘌呤衍生物排出量[D].硕士学位论文.北京:中国农业大学,2008.
[16]周永康.日粮中SC/NSC对徐淮山羊碳水化合物利用的影响[D].硕士学位论文.扬州:扬州大学,2008.
[17]吴秋珏.在反刍家畜营养中碳水化合物的研究进展[J].饲料博览,2006(2):12-13.
[18]STOKES S R,HOOVER W H,MILLER T K,et al.Impact of carbohydrates and protein levels on bacterial metabolism in continuous culture[J].Journal of Dairy Science,1991,74:860-870.
[19]HOOBER W H,STOKES S R.Balancing carbohydrates and protein for optimum rumen microbial yield[J].Journal of Dairy Science,1991,74:3630-3644.
[20]ALDDRICH J M,MULLER L D,VARGU G A,et al.Nonstructural carbohydrate and protein effects on rumen fermentation,nutrient flow,and performance of dairy cows[J].Journal of Dairy Science,1993,76:1091-1105.
[21]MCCARTHY R D,KLUSMEYER T H,VICINI J L,et al.Effects of source of protein and carbohydrate on ruminal fermentation and passage of nutrients to the small intestine of lactating cows[J].Journal of Dairy Science,1989,72:2002-2016.
[22]颜品勋.反刍动物青粗饲料的瘤胃外流速度及降解率的研究[D].硕士学位论文.北京:中国农业大学,1992.
[23]韩兴泰,谢敖云,胡令浩.生长牦牛采食量的研究[J].青海畜牧兽医杂志,1990,20(6):5.
[24]韩兴泰,谢敖云,胡令浩.饲喂各种日粮时耗牛瘤胃液体与瘤胃食糜的外流速度[J].青海畜牧兽医杂志,1996,26(3):1-4.
[25]金鑫.不同NFC/NDF比例的日粮对奶牛瘤胃代谢及乳脂前体物生成的影响研究[D].博士学位论文.北京:中国农业大学,2012.
