树鼩呼肠孤病毒的分离鉴定
2013-09-20黄晓燕李晓飞王文广殷安国夏雪山孙晓梅代解杰
徐 娟,黄晓燕,李晓飞,王文广,殷安国,夏雪山,孙晓梅,*,代解杰,*
1. 中国医学科学院/北京协和医学院医学生物学研究所 云南省重大传染病疫苗研发重点实验室,云南 昆明 650118;
2. 昆明理工大学 生命科学与技术学院,云南 昆明 650500
哺乳动物呼肠孤病毒(mammalian orthoreovirus,MRV) 隶属于呼肠孤病毒科 (Reoviridea)正呼肠孤病毒属 (Orthoreovirus)第一亚群(Van Regenmortel et al,2003)。该病毒首次由Ramos-Alvarez & Sabin于 1954年于健康儿童粪便中分离 (Huang et al,1990)。病毒核酸为双链 RNA (dsRNA),首次证实了 dsRNA可以作为稳定的生命形态存在于自然界中 (Sabin et al, 1959)。MRV RNA分10个节段,按分子量大小可分成大 (L1,L2,L3)、中 (M1,M2,M3)和小 (S1,S2,S3,S4) 三个类群,分别编码11种蛋白,包括 8种结构蛋白和 3种非结构蛋白(McCrae & Joklik,1978)。该病毒宿主范围非常广泛,包括人、鼠、猫、犬、猪、牛 ( Zeng et al, 2007)及蝙蝠 (Koh et al, 2012)等多种动物,甚至也在河水、贮存水及污水等中被发现 (Spinner et al, 2001)。虽然该病毒与疾病的确切关系尚未最后确定,但是MRV可引起动物严重呼吸窘迫综合症,肺纤维化(London et al, 2003)和致死性间质性肺炎 (Tillotson& Lemer, 1967),且对SARS病原的相关研究也发现SARS的发生可能与呼肠孤病毒的同时感染有关(Zou et al, 2003)。近几年的相关文献报道,蝙蝠源呼肠孤病毒感染人类后可导致急性上呼吸道疾病(Chua et al, 2011)。
虽然MRV在多种动物中被发现,但是目前尚无其在树鼩 (tree shrew, Tupaia)体内的相关报道。为了解树鼩是否自然携带该病毒,2011年冬,随机抽取6份腹泻死亡的野生树鼩粪便标本,并用Vero细胞进行病毒分离,首次成功从树鼩体内分离出MRV。腹泻死亡的野生树鼩发病症状为精神萎靡、身体蜷缩、眼睑和角膜红肿、眼睛分泌物增加、爪子溃烂及血便等。解剖可见肠道出血及肺局部坏死。
树鼩作为新兴的实验动物,需明确其病原菌自然携带情况。本实验证实树鼩自然携带 MRV,为开展和制定树鼩病毒质量控制及标准,实现树鼩实验动物标准化奠定了基础。
1 材料与方法
1.1 实验材料
野生树鼩及6份粪便样本均采自云南省昆明市青龙峡地区;Vero传代细胞 (由中国医学科学院医学生物学研究所免疫室保存;Minimum essential medium (MEM) 液体培养基、1%双抗、谷氨酰胺及碳酸氢钠等来自中国医学科学院医学生物学研究所;标准新生牛血清购自兰州民海生物工程有限公司;DNA胶回收试剂盒、RT-PCR试剂盒及病毒DNA/RNA提取试剂盒等购自TaKaRa生物工程有限公司;PCR反应引物来自上海生工生物工程有限公司。
1.2 实验方法
六份树鼩粪便样本按1:5比例加入PBS,漩涡震荡混匀,4 000 r/min离心10 min,上清经0.22 μm微孔滤膜过滤。将处理好的粪便上清接种于 96孔板Vero细胞单层上,每孔接种30 μL,每份上清接种16孔,于37 ℃、5%CO2孵箱中吸附90 min,每隔15 min轻轻摇晃96孔板,使病毒均匀充分地吸附到细胞上。同时,每个96孔板设置16孔空白对照。吸弃未吸附的病毒液,加入MEM维持液150 μL,于37 ℃、5% CO2孵箱中培养,连续观察细胞病变效应 (cytopathogenic effect,CPE)7 d,并连续盲传三代。取盲传三代病变的Vero细胞反复冻融3次使细胞完全裂解,于 4 ℃, 4 000 r/min 离心 30 min,弃沉淀取上清,然后4 ℃,9 000 r/min离心20 min,弃沉淀取上清,于4 ℃,55 000 r/min 离心180 min,将沉淀用适量PBS溶解,4 ℃储存。1%磷钨酸常规染色纯化病毒后,于Hitachi 透射电镜下观察。
按照病毒 DNA/RNA提取试剂盒 (TaKaRa生物工程有限公司)说明书提取纯化病毒核酸。提取的病毒基因组核酸样品按 9:1的体积与 10× loading buffer 混匀后经核酸聚丙烯酰胺凝胶 (PAGE)电泳(积层胶3.5%,分离胶10%), 每孔上样15 μL,100 V恒压。硝酸银染色观察。
以提取的病毒核酸为模板,对LI基因进行PCR扩增。反应体系条件参照TaKaRa RT-PCR试剂盒说明书。根据 L1基因保守部分设计引物, 并参考Chang et al (2008)的报道(P1:5'-GCATCCATTGT AAATGACGAGTCTG-3',P2:5'-CTTGAGATTAG CTCTAGCATCAGTTG-3')。 扩增产物回收纯化后,送TaKaRa生物工程有限公司测序。测序结果通过NCBI在Blast上进行基因比对,选用同源性较高序列为参考序列。
采用软件 MEGA5.05中的临位相连法(neighbor-joining)绘制树鼩呼肠孤病毒L1序列与参考序列以及代表株TIL、T2J、T3D及NEDV等 L1序列的系统进化树,并采用自引分析法(Bootstrap,n=1 000)进行评估。
2 结果
2.1 病毒的细胞病变(cytopathic effects,CPE)特征
六份粪便样本在 Vero 细胞中进行病毒分离,得到 1株 MRV分离毒株 Tupaia orthoreovirus(TRV)。连续盲传 3代后,出现稳定细胞病变。病毒接种3 d后开始产生细胞病变,细胞内颗粒增多、细胞逐渐破碎、固缩变圆、细胞拉网及脱落,正常Vero 细胞生长良好 (图1)。
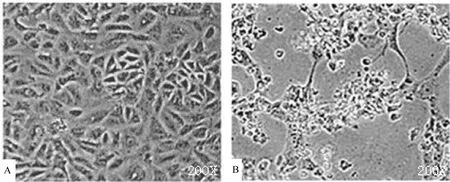
图1 正常Vero细胞及分离毒株TRV在Vero细胞上的病变Figure 1 Normal Vero cells and isolation strain TRV on the cells with cytopathic effects
2.2 电镜观察
电镜下,可见大量密集排列的球形病毒颗粒,完整直径~75 nm,内核直径45~55 nm,完整病毒颗粒以及“空壳颗粒”均可见,双层衣壳,形态疑似呼肠孤病毒 (图2)。

图2 分离毒株TRV电镜观察Figure 2 Electron microscopic observation of the isolation TRV
2.3 核酸聚丙烯酰胺电泳
纯化的病毒DNA/RNA核酸PAGE电泳结果显示该病毒由10个核酸节段组成,存在3个明显的节段区,按分子量大小可分成大 (L1,L2,L3)、中 (M1,M2,M3)和小 (S1,S2,S3,S4) 三个类群,且呈现典型的3:3:4排列 (图3)。
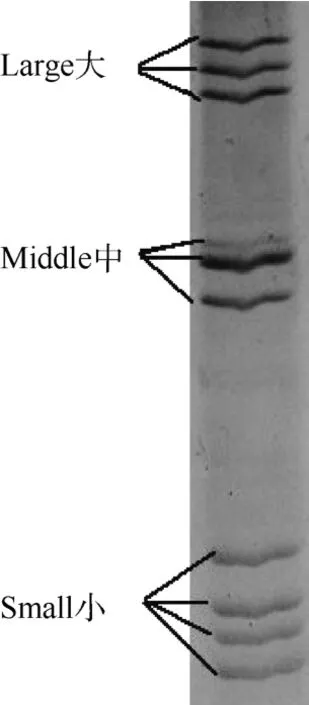
图3 分离毒株TRV基因组节段的PAGE电泳图谱Figure 3 PAGE analysis of the genome segments of the isolation TRV
2.4 RT-PCR产物
2%琼脂糖凝胶电泳PCR扩增产物,目的条带~370 bp,与预期大小一致 (图4)。

图4 分离毒株TRV L1基因电泳分析Figure 4 Amplification of the isolation TRV L1 by RT-PCR
2.5 目的基因序列分析
在 NCBI Blast上进行的序列对比结果显示目的基因序列与代表株TIL、T2J、T3D及NEDV等的 L1基因序列的核酸同源性分别为 89%、76%、89%和 88%,与蝙蝠来源的 MRV分离株T3Germany342/08(MRV strain T3/Bat/Germany/342/08) 核酸同源性最高,达96%。进化树上结果表明该病毒与MRV同属一支,且与蝙蝠来源的MRV同源性最高 (图5)。

图5 分离株L1基因(376 bp)的分子进化树Figure 5 Phylogenetic tree of L1 gene sequence (376 bp) of the isolate strain and reference strains
3 讨论
本实验从树鼩粪便中分离的 TRV病毒株可致Vero细胞逐渐破碎、固缩变圆、拉网及脱落;电镜图显示病毒颗粒为球形,双层衣壳,完整直径~75 nm;纯化病毒核酸PAGE胶电泳结果显示,该病毒由10个核酸节段组成且为3:3:4排列。以上结果均符合已报道的MRV的生物学特征。为进一步确定该病毒是否为 MRV,经 MRV L1基因保守区RT-PCR扩增、NCBI Blast核酸序列比对及MEGA5.05构建进化树,得出结果:目的基因序列与从大耳蝠 (P. auritus) 中分离出的 MRV分离株T3Ger342-08核酸同源性最高,达96%。从进化树上看,该病毒与MRV同属一支,且与从大耳蝠中分离出的MRV分离株T3Ger342-08同源性最高。从而证实该毒株为 MRV,并初步命名为树鼩呼肠孤病毒 (TRV)。
树鼩在分类地位上为攀鼩目(Scandentia),大耳蝠在分类地位上为翼手目(Chiroptera)小蝙蝠亚目(Microchiroptera)。攀鼩目和翼手目均置于统兽总目(Archonta)。从统兽总目系统进化树上看,攀鼩目和翼手目小蝙蝠亚目的亲缘关系最为接近。树鼩以昆虫为主食,兼食鸟类、兽类和植物果实。大耳蝠的食物为昆虫、鸟类、兽类以及其他蝙蝠。可见,树鼩与大耳蝠的食性相似。由于树鼩和大耳蝠亲缘关系接近且食性相似,可能导致他们感染同一种MRV。因此,树鼩与大耳蝠较近的亲缘关系和相似的食性可能是TRV和T3Ger342-08同源性最高的因素之一。
MRV都有一个共同的complement-fixing抗原,用血凝抑制试验和中和试验 (Knipe et al,2001)可分为 4个血清型 (1、2、3、4型),其代表株分别为血清型1型(ST1)代表株T1L (type 1 Lang)株、血清型2型(ST2)代表株T2J (type 2 Jones)株、血清型3型(ST3)代表株T3D (type 3 Dearing)株及血清型4型(ST4)代表株NEDV株 (Attoui et al,2001)。
Leary et al (2002)报道,MRV L1基因进化与血清型无关。由于该目的基因来源于MRV L1基因,因此,不能通过该目的基因序列比对及进化树构建等结果对该病毒株进行血清型判定。Cashdollar et al(1985) 报道S1基因进化与血清型关系密切。下一步欲获得该毒株S1全基因序列,通过S1全基因序列比对、进化树构建、血凝抑制试验和中和试验来判定该毒株的血清型。
MRV具有广泛的致病性,对多种动物胃肠道(Tyler et al,1998)、上呼吸道 (Majeski et al,2003a)、肺 (Majeski et al,2003b)、心脏 (Debiasi et al,2001)及神经系统 (Tyler et al,2004) 等多种组织均具有一定的致病性,并能在这些发病组织及肿瘤组织中分离出MRV。多数人感染MRV后无临床症状,少数出现轻微的呼吸道、胃肠道或神经系统疾病,罕见严重并发症甚至死亡。鼠、猪、牛、猴及猫等多种动物感染MRV后,同样会出现一定的临床症状。如感染MRV 1型的小鼠,通常于感染后5~7 d死亡,电镜检测显示神经元及心肌等处存在大量病毒颗粒 (Huang et al, 1990)。以上结果提醒我们应该谨慎对待MRV。TRV的首次分离,为国内外开展TRV的相关研究如病毒生物学特征、基因组结构和功能、致病机制以及与疾病的关系等奠定了基础。
本实验结果提示树鼩是MRV的自然宿主。目前,正在开展树鼩实验动物化的研究,因此树鼩可以作为一种研究MRV的良好动物模型。
MRV是人兽共患病病毒,不仅会影响动物的生命健康、干扰实验结果的可信性,而且可能危害实验动物从业人员的生命健康,为此,建议将MRV列为实验树鼩病毒质量控制的检测指标。
Attoui H, Biagini P, Stirling J, Mertens PP, Cantaloube JF, Meyer A, De Micco P, De Lamballerie X. 2001. Sequence characterization of Ndelle virus genome segments 1, 5, 7, 8, and 10: evidence for reassignment to the genus Orthoreovirus, family Reoviridae. Biochemical and Biophysical Research Communication, 287(2): 583-588.
Cashdollar LW, Chmelo RA, Wiener JR, Joklik WK. 1985. Sequences of the S1 genes of the three serotypes of reovirus. Proceedings of the National Academy of Sciences of the United States of America, 82(1): 24-28.
Chang JT, Li X, Zhang YL, Yu L. 2008. Isolation and identification of bovine reovirus from feces of the calves suffered from diarrhea. Chinese Journal of preventive Veterinary Medicine, 30(9):711-715. [ 常继涛, 李鑫,张亚科, 于力. 2008. 犊牛腹泻粪样中牛呼肠孤病毒的分离鉴定. 中国预防兽医学报, 30(9): 711-715.]
Chua KB, Voon K, Yu M, Keniscope C, Rasid KA, Wang LF. 2011.Investigation of a potential zoonotic transmission of orthoreovirus associated with acute influenza-like illness in an adult patient. PLoS One,6(10): e25434.
Debiasi RL, Edelstein CL, Sherry B, Tyler KL. 2001. Calpain inhibition protects against virus-induced apoptotic myocardia injury. Journal of Virology, 75(1): 351-361.
Huang ZX, Hong T, Sun CB. 1990. Medical Virology Basis, Fundamental Techniques and Methods. Beijing: Science Press, 608-612. [黄祯祥, 洪涛,孙崇柏. 1990. 医学病毒学基础及实验技术. 北京: 科学出版社,608-612. ]
Knipe DM, Howley PM, Griffin DE, Lamb RA, Martin MA, Roizman B,Straus SE. 2001. Fields Virology. 4thed. Philadelphia: Lippincott Willians and Wilkins, 2636-2663.
Koh C, Lesnik R, Brinkmann A, Ebinger A, Radonić A, Nitsche A,Mühldorfer K, Wibbelt G, Kurth A. 2012. Isolation and characterization of three mammalian orthoroviruses from European Bats. PLoS One, 7(8):e43106.
Leary TP, Erker JC, Chalmers ML, Wetzel JD, Desai SM, Mushahwar IK,Dermody TS. 2002. Detection of reovirus by reverse transcription-polymerase chain reaction usingprimers corresponding to conserved regions of the viral L1genome segment. Journal of Virological Methods, 104(2): 161-165.
London L, Majeski EI, Paintlia MK, Harley RA, London SD. 2003.Respiratory reovirus 1/L induction of diffuse alveolar damage: a model of acute respiratory distress syndrome. Experimental and Molecular Pathology,72(1): 24-36.
Majeski EI, Paintlia MK, Lopez AD, Harley RA, London SD, London L.2003a. Respiratory reovirus 1/L induction of intraluminal fibrosis, a model of bronchiolitis obliterans organizing pneumonia, is dependent on T lymphocytes. American Journal of Pathology, 163(4): 1467-1479.
Majeski EI, Harley RA, Bellum SC, London SD, London L. 2003b.Differential role for T cells in the development of fibrotic lesions associated with reovirus 1/L-induced bronchiolitis obliterans organizing pneumonia versus Acute Respiratory Distress Syndrome. American Journal of Respiratory Cell and Molecular Biology, 28(2): 208-217.
McCrae MA, Joklik WK. 1978. The nature of the polypeptide encoded by each of the 10 double-stranded RNA segments of reovirus type 3. Virology,89(2): 578-593.
Sabin AB. 1959. Reoviruses. Science, 130(3386): 1387-1389.
Spinner ML, Di Giovanni GD. 2001. Detection and identification of mammalian reoviruses in surface water by combined cell culture and reverse transcription-PCR. Applied and Environmental Microbiology, 67(7):3016-3020.
Tyler KL, Sokol RJ, Oberhaus SM, Le M, Karrer FM, Narkewicz MR,Tyson RW, Murphy JR, Low R, Brown WR. 1998. Detection of reovirus RNA in hepatobiliary tissues from patients with extrahepatic biliary atresia and choledochal cysts. Hepatology, 27(6): 1475-1482.
Tyler KL, Barton ES, Ibach ML, Robinson C, Campbell JA, Donnell SM,Valyi-Nagy T, Clarke P, Wetzel JD, Dermody TS. 2004. Isolation and molecular characterization of a novel type 3 reovirus from a child with meningitis. Journal of Infectious Diseases, 189(9): 1664-1675.
Tillotson JR, Lemer AM. 1967. Reovirus type 3 associated with fatal pneumonia. The New England Journal of Medicine, 276(19): 1060-1063.
Van Regenmortel MHV, Fauquet CM, Bishop DHL. 2003. Virus Taxonomy Seventh Report of the International Committee on Taxonomy of Viruses.San Diego: Academic Press, 84-96.
Zeng ZY, Guo WZ, Xu ZW, Song ZH. 2007. Isolation, identification of porcine reovirus from diarrhea feces of pigs. Acta Veterinaria et Zootechnica Sinica, 38(6): 574-580. [曾智勇, 郭万柱, 徐志文, 宋振辉,殷华平, 王新, 王小玉. 仔猪腹泻粪样中猪呼肠孤病毒的分离鉴定. 畜牧兽医学报, 38(6): 574-580.)
Zou TT, Tan H, He J, Zhu H, Zhang HJ, Song LH, Huang RT, Duan Q. 2003.Cloning and identification of reovirus isolated from specimens of SARS patients. Bulletin of the Academy of Military Medical Sciences, 27(4):241-243. [左庭婷, 檀华, 何君, 朱虹, 张浩杰, 宋立华, 黄如统, 端青.2003. 从SARS患者标本中分离的呼肠病毒的分离及鉴定. 军事医学科学院院刊, 27(4): 241-243. ]
