重金属Crボ与血清蛋白质组的结合反应性能研究
2013-09-15黄凤琴刘咪咪李铭慧
郭 明 黄凤琴 刘咪咪 李铭慧
(浙江农林大学化学系,临安 311300)
蛋白质组学以蛋白质组(Proteome)为研究对象,从蛋白质整体水平研究蛋白质功能表达,认识生命活动规律[1-2]。人体蛋白质组中,超过30%的蛋白质含有单一或多个金属离子,金属离子对蛋白质发挥生物学功能起着关键的作用[3]。金属离子络合物/复合物结构、功能的研究是无机化学的重要内容,而分析金属离子与生物大分子(蛋白质、DNA、酶等)的结合反应性能是无机化学发展的前沿领域之一。
重金属铬离子主要以三价和六价形式存在,Crバ对人体有益,而Crボ影响生物体葡萄糖、脂肪、蛋白质的新陈代谢[4-5],当Crボ进入血液后,可与血清中的高丰度组分如白蛋白、转铁蛋白、免疫球蛋白等相结合,发挥生物学效应。血清白蛋白是人和动物血浆中含量最丰富的蛋白质,能够与多种金属离子相互作用[6-7],免疫球蛋白是人体和动物体发挥免疫作用的关键蛋白质,转铁蛋白则是人体和动物体内运送铁等金属离子的载体蛋白,故在组学条件下研究Crボ与血清蛋白质组的结合反应性能对于理解Crボ-蛋白质分子的结构、性能及生物体内分布,阐释Crボ-蛋白质组络合/复合作用机制,解释铬离子在生物体内的代谢过程及评价Crボ的毒性具有一定的理论指导意义。
目前,生物活性小分子/离子与蛋白质分子结合作用机制的研究是国内外的研究热点之一,核磁共振法[7]、荧光光谱法[8]、红外光谱法[9]、圆二色谱法[10]等分析手段广泛应用,并取得了诸多成果,促进该研究领域的发展,而利用色谱方法研究陆续也有报道。色谱方法中亲和毛细管电泳(ACE)法具有样品用量少、高灵敏度、高分辨率等特点,通过ACE法研究重金属离子与单一蛋白质结合反应的报道已有相应文献[11-18],而组学条件下通过ACE方法研究金属离子与蛋白质组结合反应性能未见报道。重金属离子与蛋白质组的结合过程中,重金属离子与所有蛋白质相互结合,互相影响,故理想化的金属离子与单一蛋白质结合反应模型不能全面反映金属离子与蛋白质的结合反应机制,而在组学条件下研究更具有实际意义。牛血清具有与人血清结构和氨基酸序列高度相似,且低廉易得等特点,本文充分利用ACE对蛋白质组的高效分离功能结合其对络合物/复合物平衡性质的检测,研究Crボ与牛血清蛋白质组结合反应性能。通过分析Crボ与FBS高丰度组分结合反应的有效淌度数据,进行非线性拟合,获得Crボ与血清蛋白质组中高丰度组分相互作用的表观结合常数,推断Crボ与FBS结合反应的动力学机制。
1 实验部分
1.1 仪器与试剂
P/ACETMMDQ毛细管电泳仪(美国Beckman-Coulter公司);未涂层熔融石英毛细管柱(60.2 cm×50 μm I.D.,有效长度50 cm);KQ-250DB型数控超声清洗器 (昆山市超声仪器有限公司);Eppendorf移液枪(上海肯强仪器有限公司);ZD-2型精密酸度计(上海雷磁仪器厂);电子分析天平(十万分之一,德国Sartorius公司);1810D自动双重纯水蒸馏器 (美国Millipore 公司)。
牛血清(Fetal bovine serum,FBS;Purity≥98%,杭州四季青生物工程材料有限公司);牛血清白蛋白(Bovine serum albumin,BSA;Purity≥96%,Sigma公司); 牛 转 铁 蛋 白(Bovine apo transferrin,bATF;Purity≥98%)、牛免疫球蛋白(Bovine IgG,IgG;Purity≥98%)购置于上海浩然生物技术有限公司;N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF,上海华美生物工程公司);其它试剂均为分析纯;实验用水为亚沸蒸馏去离子水。
1.2 实验方法
1.2.1 ACE方法运行缓冲液及样品溶液的配制
称取适量CrO3固体,以25 mmol·L-1Na2B4O7-NaOH空白缓冲液 (pH 9.27)溶解并配制成0.1 mmol·L-1Crボ储备液 (CrO3在该 pH 下以 CrO42-存在,即铬以六价形式存在[19-20],以Crボ,表示铬与血清蛋白质作用时的初始价态,其并不代表铬与血清蛋白质作用时的最终化学式,后续Crボ表示相同含义)。移取系列不同体积Crボ储备液,以Na2B4O7-NaOH缓冲液依次稀释至所需浓度。空白缓冲液和各Crボ缓冲液均用0.45μm混合纤维素酯微孔过滤并脱气5 min,待用。
解冻后的胎牛血清用过滤脱气后的Na2B4O7-NaOH空白缓冲液以10∶1稀释,加入适量过滤脱气后的0.5%DMF(用于检测电渗流和迁移时间的重现性)混匀,待用。
1.2.2 FBS中高丰度组分的分析
FBS溶液进行ACE分析的测定条件:压力进样:2.068 5 kPa,进样时间:3 s;检测波长:214 nm;分离电压:25 kV;柱温:25℃。实验操作程序:将样品瓶置于样品槽中,用0.1 mol·L-1NaOH、去离子水及空白缓冲液分别冲洗3 min,压力进样,分离获得FBS电泳谱图。
内标添加法进行ACE分析确认FBS高丰度组分:适量BSA,bATF及牛IgG用Na2B4O7-NaOH缓冲液配成 1×10-5mol·L-1标准样品溶液,0.45 μm 混合纤维素酯微孔过滤。逐一适量添加BSA,bATF及牛IgG标准样品溶液于FBS溶液中,涡旋摇匀,分别置于样品瓶中,逐一通过ACE分析,检测条件和程序同FBS溶液,获得相应的电泳谱图。通过分析比较内标添加FBS溶液和FBS溶液电泳谱图上迁移时间、峰高、峰面积变化情况,确定FBS中高丰度组分信息。
1.2.3 Crボ-FBS 相 互作 用体 系中 FBS 高丰 度组分有效淌度的测定
不含Crボ运行缓冲液条件下,测定程序同1.2.2; 含 Crボ运行缓冲液条件下,FBS 高丰度组分有效淌度的测定程序:实验前用0.1 mol·L-1NaOH、去离子水及空白缓冲液分别冲洗3 min,随后用含相应Crボ浓度运行缓冲液冲洗5 min;其他测试程序同1.2.2,分别测定6次,求不同缓冲液条件下FBS中高丰度组分有效淌度的平均值。
2 结果与讨论
2.1 Crボ与FBS高丰度组分相互作用模型及相互作用理论方程
针对非共价键配体M(金属离子)-受体P(蛋白质分子)之间的相互作用体系(n M+P→MnP),所形成的结合物MnP的表观结合常数表达式如下:

受体P的平均电泳淌度(μ)变化值介于游离受体P(没有配体M存在)的电泳淌度(μP)与结合物MnP的电泳淌度(μMnP)之间,其可以表示为[21-23]:

μMnP可用配体M浓度较高时测得受体P的电泳淌度(μMnP,∞)代替。将方程式(1)代入方程式(2),得到受体P的平均电泳淌度μ。

在ACE方法中,一般不能准确获得迁移区带中游离态M的浓度cMf,在配体M的合理范围内(通常配体M的浓度高于受体P浓度的10~100倍[24])可设定cMf等于运行缓冲液中配体M的浓度cM,进而由受体P的μ值和cM估算结合常数KB。前人研究金属离子与HSA(人血清白蛋白),BSA等单一蛋白质分子结合反应时,多采用简化模型方法而考虑1∶1的配合物情况,本文也采用类似的简化方法。n=1时,方程式(3)转化为:

方程式(4)经过处理可转化为如下形式:

方程式(5)为以电泳淌度表示的位点结合模型,以1/(μ-μP)对1/cM进行线性拟合,将所得直线的截距与斜率值相比即可得KB。但在实际的拟合过程中,μ与cM不存在线性关系,Bowser等[23]强调通过对ACE方法测得的数据进行非线性拟合,特别在cM浓度合理范围内,计算结合常数能够降低误差。
从式(4)可知,不同的cM对应不同的μ值。从电泳谱图上,得到迁移时间,有效淌度计算公式如下:
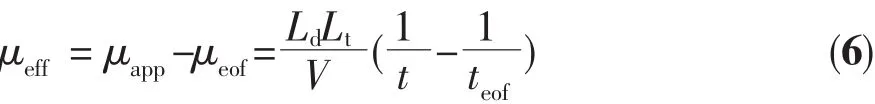
方程式(6)中,μeff是受体 P 的有效淌度,μapp是其表观淌度,μeof是电渗流淌度,t是从电泳谱图中直接测得的受体P的迁移时间,teof是DMF的迁移时间,V是毛细管两端的外加电压,Lt是毛细管总长,Ld是从进样端到检测窗口的有效长度。由式(6)计算出μeff,并把其作为式(5)中的μ(游离受体P的有效淌度或受体P的平均有效淌度),然后对cM进行非线性拟合更符合实际情况,所得的结果更为精确。因此本研究后续工作利用非线性拟合求KB。针对FBS蛋白质组体系,根据式(4)进行非线性拟合求表观结合常数。
2.2 内标添加法分析FBS蛋白质组分结果
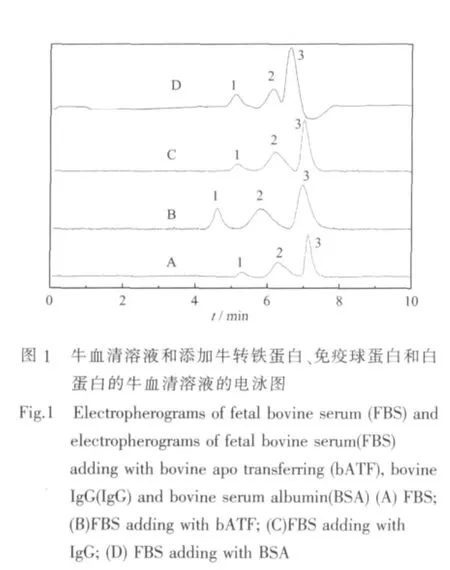
按1.2.2实验,测得FBS蛋白质组电泳谱图。分析比较FBS溶液ACE谱图与添加适量BSA,bATF及牛IgG标准样品溶液的FBS溶液ACE谱图,结果如图1所示。
FBS谱图表明,FBS蛋白质组中明显存在3个高丰度组分峰,依次为峰1,峰2与峰3。添加BSA标准样品后,FBS中3个高丰度组分峰迁移时间基本不变,但峰3明显增高,且峰面积增大,认定峰3为BSA峰;添加bATF标准样品后,FBS中3个高丰度组分峰迁移时间基本不变,但峰1明显增高,且峰面积增大,认定峰1为bATF峰;添加IgG标准样品后,FBS中3个高丰度组分峰迁移时间基本不变,但峰2明显增高,且峰面积增大,认定峰2为IgG峰,由此确定FBS中高丰度组分为BSA,bATF和IgG。BSA、bATF、IgG在血清中占90﹪左右,其他蛋白含量较少,本工作采用的ACE方法也难以分离并检测低丰度组分,故本文以下内容均考虑以该3个高丰度组分为基础开展相应工作,低丰度FBS组分的影响可近似忽略。FBS中3个高丰度组分的蛋白质标准品等电点值及其相关数据见表1[25-26]。

表1 蛋白质标准品基本物理量Table 1 Basic physical quantities of protein standards
2.2 ACE方法测定Crボ-FBS中3个高丰度组分相互作用后淌度变化
按1.2.3实验测定Crボ-FBS相互作用中3个高丰度组分的有效淌度,在不同运行缓冲液条件下,DMF与FBS混合进样后得到相应ACE谱图,结果见图2。
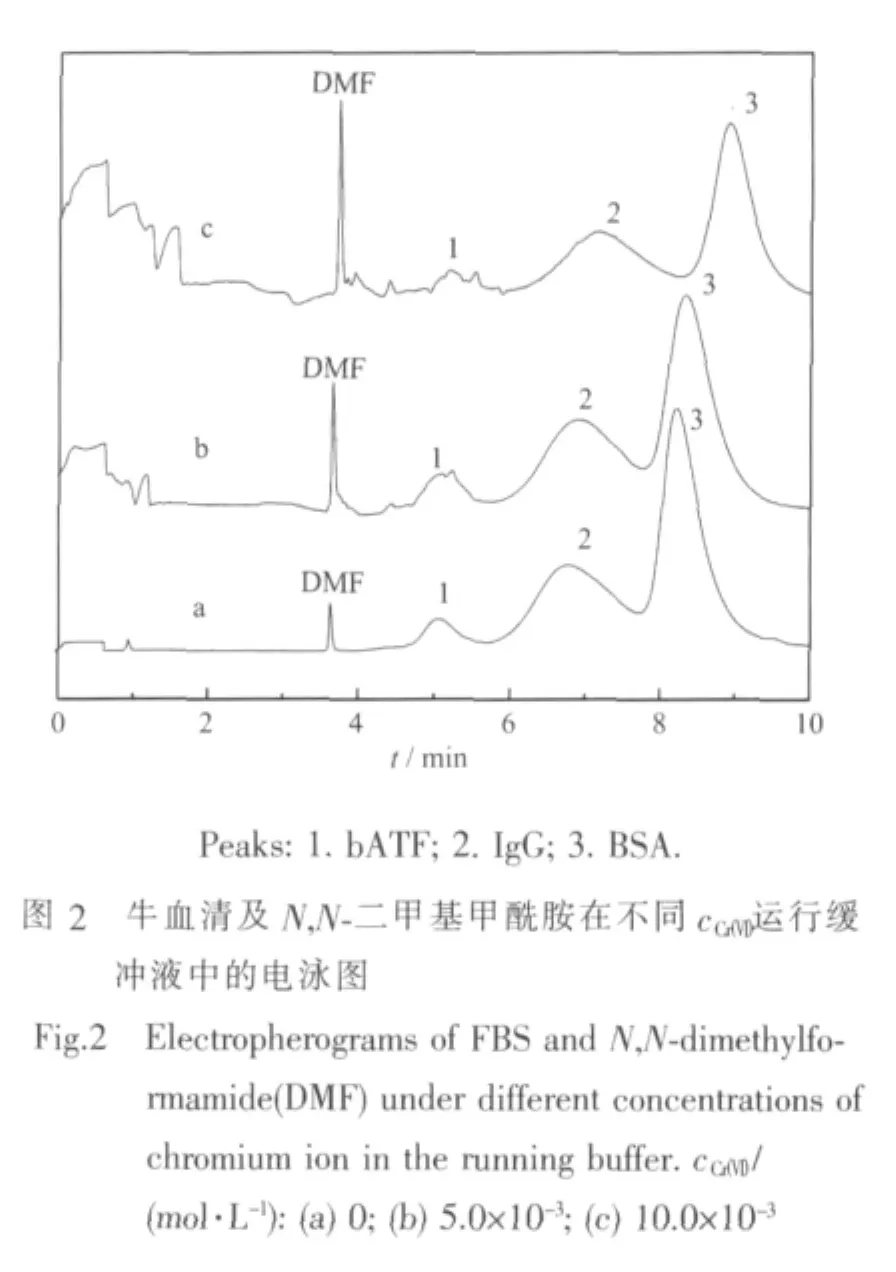
图2表明,随着Crボ浓度增大,FBS中各高丰度组分出峰时间均延长,区带展宽。pH 9.27时,中性内标物的迁移时间基本不变,Crボ浓度增大不能显著影响DMF的迁移行为,即DMF与Crボ之间没有明显的相互作用。bATF、IgG、BSA在pH 9.27空白缓冲液中均带有负电荷,根据CE中不同电荷物质出峰时间先后顺序知FBS中3个高丰度组分在DMF之后被检测到,这与图1所示FBS中各高丰度组分峰均在DMF之后出峰一致。由图2还可知:随着运行缓冲液中Crボ浓度的增大,在空白缓冲液中具有固定浓度的3个高丰度组分的出峰时间延长,区带展宽。Crボ使结合物 Crボ-bATF、Crボ-IgG、Crボ-BSA所带负电荷量增多,它们的电泳方向与电渗流相反,随着Crボ浓度的增大,各峰的迁移时间增大。
试验中改变运行缓冲液中Crボ浓度,可获得不同浓度Crボ条件下FBS中3个高丰度组分和DMF的迁移时间,根据式(6)可计算不同浓度Crボ运行缓冲液中3个高丰度组分的有效淌度,测定结果列于表2。由表2可见,bATF、IgG、BSA的有效淌度分别从-1.086 73×10-4cm2·V-1·s-1变化至-0.850 03×10-4cm2·V-1·s-1、 从-1.685 12×10-4cm2·V-1·s-1变化至-1.385 21×10-4cm2·V-1·s-1、从-2.026 13×10-4cm2·V-1·s-1变化至-1.525 13×10-4cm2·V-1·s-1, 这表明 Crボ-bATF、Crボ-IgG、Crボ-BSA 之间确实发生了结合反应,并且它们之间的相互作用逐渐增强。

表2 牛血清中转铁蛋白、免疫球蛋白和白蛋白在含不同浓度Crボ运行缓冲液中的有效淌度Table 2 Effective mobility of bATF,IgG and BSA in FBSunder the different concentrations of Crボ
以Crボ浓度为横坐标,以μeff为纵坐标作图,得到 Crボ-bATF、Crボ-IgG 与 Crボ-BSA 的 亲和 曲线(图 3), 进而可求得 Crボ-bATF、Crボ-IgG 与 Crボ-BSA结合物的平均有效淌度。按公式(4)非线性拟合,拟合结果列于表3中。
从图3看出,实验数据点基本接近拟合曲线,bATF、IgG与BSA的有效淌度随着运行缓冲液中Crボ浓度的增大而增大,因Crボ使结合物Crボ-bATF、Crボ-IgG、Crボ-BSA所带的负电荷量增多,则随着Crボ浓度的增大,bATF、IgG、BSA峰的迁移时间分别延长,区带展宽,相对于bATF、IgG、BSA峰游离有效淌度 (-1.086 73×10-4,-1.685 12×10-4,-2.026 13×10-4cm2·V-1·s-1),结合物 Crボ-bATF、Crボ-IgG、Crボ-BSA 的平均有效淌度变为-0.824 97×10-4,-1.348 63×10-4,-1.472 31×10-4cm2·V-1·s-1, 这也证实了 Crボ-bATF、Crボ-IgG、Crボ-BSA 之间发生了结合反应。由实验数据非线性拟合得到Crボ-bATF、Crボ-IgG、Crボ-BSA 的表观结合常数 KB分别为 1.27×104、4.91×104、8.98×104L·mol-1。 为了比较分析组学条件及单一蛋白质组分条件下,高丰度蛋白质组分与Crボ结合反应性能的差异,本工作选定BSA(费用低)开展其与Crボ结合反应的毛细管电泳实验,求得KCrボ-BSA=4.69×104L·mol-1,组学条件及单一蛋白质组分条件下高丰度蛋白质与Crボ结合反应性能存在一定差异,推测其它高丰度蛋白质组分与Crボ结合反应具有类似结果。由此推断,本文在组学条件下的获得的BSA、bATF、IgG与Crボ结合反应的毛细管电泳行为,即包括蛋白质-蛋白质相互作用的影响(含BSA、bATF、IgG等之间的相互作用)、低丰度蛋白-Crボ结合反应的影响及室温、溶液等环境因素的影响,应该比单独考虑BSA、bATF、IgG与Crボ结合反应的毛细管电泳行为更接近生理状态,所获得的结果为组学条件下BSA、bATF、IgG与Crボ结合反应的综合结果。依据结合反应发生的快慢,可将结合体系分为快平衡(KB数量级为 104~106L·mol-1)和慢平衡(KB数量级为103L·mol-1)体系[27-29]。其中快平衡的一个特点是游离蛋白质分子和结合物将难以分开,它们混合成一个条带迁移,在电泳谱图上表现为一个宽峰。根据表观结合常数KB,我们发现Crボ-bATF、Crボ-IgG、Crボ-BSA 之间发生的结合反应均为快平衡反应,且Crボ-BSA之间的结合作用最强,其次是 Crボ-IgG、Crボ-bATF。本试验中,发生结合后的电泳谱图峰数未增加,蛋白质分子峰无变形,表明Crボ-bATF、Crボ-IgG、Crボ-BSA 之间的结合体系为快平衡体系。
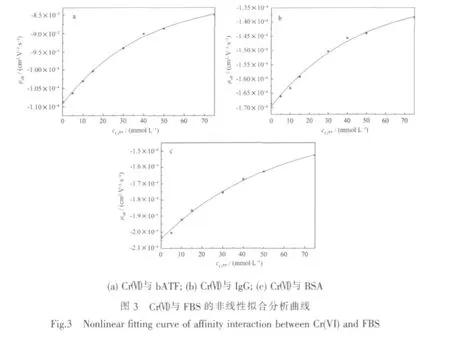

表3 Crボ-FBS相互作用的非线性拟合结果Table 3 Results of non-linear curve fitting about the interactions between Crボand FBS
当分析物分子在高压电场作用下通过毛细管发生电泳迁移时,它的电泳淌度μ由两个主要因素决定[30-33]:(1)分析物分子的荷/质比;(2)分析物分子所处环境中其它化学物质的影响。当蛋白质分子与质量相对小的带电配体发生相互作用时,结合物的电泳淌度发生变化主要是因为其电荷发生了变化,而因为其质量发生变化导致电泳淌度的改变可以忽略。在运行缓冲液 pH条件下,Crボ使结合物 Crボ-bATF、Crボ-IgG、Crボ-BSA 所带负电荷的量增大,则随着Crボ离子浓度的增大,bATF、IgG、BSA峰的迁移时间延长,且BSA峰迁移时间延长的最多,其次是IgG和bATF,这也进一步证实了BSA峰的表观结合常数KB最大,其次是IgG和bATF。
2.3 金属离子-蛋白质结合反应机制引起的电泳淌度变化的其他因素
2.3.1 缓冲溶液中影响因素
在该实验中,影响结合常数的因素包括荷/质比、运行缓冲液中所含有的化学物质、运行缓冲液的pH、溶液的粘度、离子强度等。本实验首先使Crボ和血清在同一缓冲液条件下运行;其次使Crボ浓度低于空白缓冲液的浓度,并使Crボ浓度在0~10 KB范围左右[34-36]。根据实验求得的KB值,计算最佳Crボ浓度范围为 0~7.87 mmol·L-1,而实验中 Crボ浓度范围大致在该浓度范围内,添加Crボ浓度对运行缓冲液的粘度、离子强度基本无变化,引起bATF、IgG、BSA 的有效淌度变化是 Crボ-bATF、Crボ-IgG、Crボ-BSA之间结合反应的结果。
2.3.2 蛋白质结构差异对结合作用影响
天然产物等有机活性分子与蛋白质等生物大分子之间的结合主要有疏水作用力、氢键作用力、范德华力和静电引力等,而金属离子与蛋白质大分子之间的结合作用主要靠静电引力[35]等。BSA分子是由585个氨基酸残基组成的多肽链,其中约67﹪的氨基酸以α-螺旋形成BSA二级结构,BSA三级结构由3个结构域Ⅰ、Ⅱ和Ⅲ组成,进而以槽口相对的方式形成圆筒状结构,活性分子/离子可通过包埋在圆筒结构内部进而与白蛋白分子发生结合反应,结构域Ⅱ与结构域Ⅲ为主要的结合反应位域;另一方面BSA分子中含有大量-OH、-NH2和-SH等极性官能团,极性官能团也是形成MnP络合物的极好配位官能团[36];IgG分子为四肽链组成的基本结构,两条较长的肽链称为重链(分子量较大),两条较短的肽链称为轻链(分子量较小),轻链与重链通过链间二硫键构成IgG分子。IgG分子由3个结构域形成Y形或T形三级结构,每一轻链和重链在其N-末端有一可变区,在其C-末端有一不变区。每个可变区中均有一个由链内二硫键连接形成的肽环,每个可变区域氨基酸的组成和排列具有可变性,故可结合多种具有不同结合抗原特异性的抗体,也是Crボ与IgG的活性结合位域[37];bATF是由两个结构和功能上类似的结构域组成的单一肽链糖蛋白,其立体结构是在二级结构的基础上折叠成2个相等的叶 (N-叶和C-叶),每个叶状结构中含有一个Fe3+的结合部位,但此部位存在于一个很深的裂隙中。分析蛋白质分子结构,BSA含较多的分子/离子结合部位,其圆筒状三级结构使Crボ较易进入其结构域空腔与亲和基团接触形成络合物,同时疏水氨基酸残基形成的外围空腔能将进入的Crボ牢牢裹住,充分结合,所以结合作用力较强,结合常数较大;其次,bATF的结合部位深陷在裂隙中[38],使Crボ较难进入裂隙与亲和基团键合,所以结合力较弱,结合常数较小;IgG分子中含有少量亲和基团,Crボ可以进入可变区与IgG发生结合反应。但IgG可变区域的Y或T形结构为疏水区域结构,Crボ不容易包裹在其中,较易流出,所以IgG结合作用适度。通过实验发现KCrボ-BSA>KCrボ-IgG>KCrボ-bATF, 结果表明 Crボ-BSA 之间的结合作用最强,其次是Crボ-IgG、Crボ-bATF,此实验结果与蛋白质的分子结构相一致。
3 结 论
(1)在现有实验条件下,依据毛细管电泳谱图,确定FBS中bATF、IgG、BSA高丰度组分峰,并基于确认的高丰度组分开展Crボ与蛋白质组的结合反应性能研究,FBS中存在其他低丰度及极低丰度组分,这些低丰度及极低丰度组分也可能与Crボ发生结合作用,这些结合反应对组学条件下Crボ-蛋白质络合物/复合物的形成起着一定作用,但鉴于目前蛋白质组分离技术的限制,尚不能完全清晰FBS全组分组成及含量,故只能基于目前现有的ACE技术手段开展Crボ与高丰度蛋白质组的结合反应性能研究。
(2)在蛋白质组学条件下,以DMF为内标物,构建配体Crボ-受体(FBS)相互作用模型,计算有效淌度的变化, 发现 Crボ-bATF、Crボ-IgG、Crボ-BSA 相互作用后的有效淌度均较游离bATF、IgG、BSA的有效淌度有所增加,表明Crボ确与FBS中bATF、IgG、BSA发生了结合反应;其次基于位点结合方程,通过非线性拟合方程计算Crボ-FBS中3个高丰度组分结合反应的表观结合常数 KCrボ-bATF、KCrボ-IgG、KCrボ-BSA;定量表征了Crボ与 FBS中 bATF、IgG、BSA结合作用强度及络合物稳定性,并解析电泳谱图获得了Crボ-FBS中高丰度组分的结合反应为一快平衡体系的结论。
(3)依据亲和曲线变化表明,得到结合反应作用强度即络合物稳定性与运行缓冲液中Crボ浓度存在量效关系,随溶液中Crボ浓度的提高,结合作用也随之增强,当Crボ浓度提高到一定浓度时,结合作用不再改变;同时通过文献查阅BSA、IgG、bATF分子结构进行比较分析,表明蛋白质的分子结构与实验所得表观结合常数 KCrボ-BSA>KCrボ-IgG>KCrボ-bATF结果相吻合。表明在蛋白质组学条件下,以ACE方法研究Crボ与血清蛋白质组的结合反应性能有效、可行。
本研究初步探索了组学条件下金属离子与蛋白质组的结合反应性能,相应结果可为生物无机化学类似工作提供前期工作基础,有关工作可为重金属离子-蛋白质络合物结合性能等研究提供一定参考。
[1]Jacobs J M,Adkins J N,Qian W J,et al.J.Proteome Res.,2005,4:1073-1085
[2]Costa M.Toxicol.Appl.Pharmacol.,2003,188(1):1-5
[3]Gray H B.Proc.Natl.Acad.Sc i.USA,2003,100(7):3563-3568
[4]WANGRui(王锐),BAIYan(白燕),LIANGZhi-Hong(梁志红),et al.Acta Phys.-Chim.Sin.(Wuli Huaxue Xuebao),2010,26(12):3225-3229
[5]Dai L B,Zhou C Z,Yuan S G.J.Chem.Eng.Chinese Universities,2012,26(4):674-678
[6]ZHANG Hai-Rong(张海蓉),BIAN He-Dong(边贺东),NI Shou-Hai(倪寿海),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(2):306-311
[7]SHEN Xin-Can(沈星灿),BIAN He-Dong(边贺东),TU Chu-Qiao(涂楚桥),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2000,16(1):73-78
[8]ZHANGFang(张芳),LINDong-Hai(林东海).Chin.J.Magnet.Resonance(Bopuxue Zazhi),2009,26(1):136-149
[9]LIANG Yan-Qiu(梁彦秋),LIU Ting-Ting(刘婷婷),FEI Hong-Bo(费洪博),et al.J.Anal.Sci.(Fenxi Kexue Xuebao),2007,23(3):303-306
[10]Ye Q,Hu R,Lin Z Y,et al.Chem.J.Chinese Universities,2006,27(8):1552-1554
[11]Anwesha B,Kaushik B,Pradeep K S.J.Photochem.Photobiol.B:Biology,2008,90(1):33-40
[12]Auda SH,Mrestani Y,Ahmed A M S,et al.Electrophoresis,2010,30(6):1066-1070
[13]Rundlett K L,Armstrong D W.Electrophoresis,2001,22(7):1419-1427
[14]Tanaka Y,Terebe S.J.Chromatogra.B,2002,768(1):81-92
[15]Urbaniak B,Mrestani Y,Kokot Z J,et al.Chromatographia,2007,65(7/8):489-492
[16]LIU Yong(刘勇),XIA Zhi-Ning(夏之宁),LI Hui(李晖).Chin.J.Anal.Chem.(Fenxi Huaxue),2005,33(12):1733-1736
[17]LI Bo(李 博 ),LIU Wen-Ying(刘 文 英 ).Prog.Pharmaceut.Sci.(Yaoxue Jinzhan),2003,27(2):81-84
[18]Castagnola M,Rossetti DV,Tnzitari R,et al.Electrophoresis,2003,24(5):801-807
[19]Hu J,Lo M C,Chen G H.Sep.Purif.Technol.,2007,56(3):249-256
[20]YUNQing-Xing(邢云青).Thesisfor the Doctorateof Zhejiang University(浙江大学博士论文).2007.
[21]WANG Chang(王畅),ZHENG Yu-Fang(郑育芳),XIONG Jian-Hui(熊建辉),et al.Acta Chim.Sin.(Huaxue Xuebao),2004,62(3):279-282
[22]Deng B Y,Wang Y Z,Zhu P C,et al.Anal Chim.Acta,2010,683(1):58-62
[23]Michael T,Bowser,David D.J.Phys.Chem.,1999,103(1):197-202
[24]Benjamin J,Cargile,Jonathan L,et al.J.Proteome Res.,2004,3(1):112-119
[25]Rosenfeld S I,Looney R J,Leddy J P.J.Chin.Invest,1985,76(6):2317-2322
[26]Saksena S,Zydney A L.Biotechnol.Bioengi.,1994,43(10):960-968
[27]GUOMing(郭明),LIUMi-Mi(刘咪咪),LIMing-Hui(李铭慧),etal.Chin.J.Anal.Chem.(Fenxi Huaxue),2012,40(2):268-272
[28]Zhang PJ,Lan P,Ma Y N,et al.J.Biochem.Mol.Toxicol.,2012,26(2):54-59
[29]LI Xiao-Feng(李晓峰).Thesis for the Masterate of Tianjin University(天津大学硕士论文),2003.
[30]YU Wen-Peng(于文鹏).Thesis for the Masterate of Beijing Forestry University(北京林业大学硕士论文).2005.
[31]Michael V,Ellen V,Roland B.J.Proteomics,2012,75(18):5848-5860
[31]YUAN Pei(袁佩),XIA Zhi-Ning(夏之宁),LIU Yong(刘勇).Chin.J.Instrument.Anal.(Fenxi Ceshi Xuebao),2001,20(1):79-83
[32]Liu Y,Zhang SY,Ling X M,et al.J.Peptide Sci.,2008,14(8):984-988
[33]Allen SJ,Crown SE,Handel T M.Annu.Rev.Immunol.,2007,25(1):787-820
[34]Kraly J,Fazal M A,Schoenherr R M,et al.Anal.Chem.,2006,78(1):4097-4110
[35]ZHAO Yan-Fang(赵艳芳),FU Chong-Gong(傅崇岗),LIU Ai-Lin(刘爱林).Chin.J.Chromatography(Sepu),2003,21(2):126-130
[36]Michael V,Ellen V,Roland B.J.Proteomics,2012,75(18):5848-5860
[37]Dudev T,Lim C.Annu.Rev.Biophys.,2008,37(1):97-116
[38]HE Wen-Ying(何文英),YAO Xiao-Jun(姚小军),LIU Peng-Jun(刘鹏军),et al.Sci.China Chem.(ZhongguoKexue),2007,37(1):54-63
