红曲霉产红色素液相发酵条件的优化
2013-09-14朴海燕张益维唐同同张羽汐
朴海燕,张益维,唐同同,刘 印,张羽汐
(东北电力大学化学工程学院,吉林 吉林 132012)
天然红曲色素是目前世界上唯一利用微生物发酵所得的天然红色,在我国已有千年多的应用历史[1]。随着毒理学研究的深入发展,人们越来越追求绿色产品和天然产品,红曲色素作为一种天然色素其安全性高,急慢性毒性实验、致突变实验都证明其无毒,也无致突变作用。由红曲色素取代人工合成色素的前景广阔,且红曲色素也是我国食品法规定允许使用的食品色素之一,现已广泛应用于各种食品着色过程中[2]。
天然红曲色素生产方法主要有固态法和液态法,其中液态法主要用于水溶性红曲色素的生产。我国常用发酵法生产效率低、产品品质难以控制,导致生产成本高,不利于工业化大生产[3]。本研究期望获得高产量红色素,为确定最佳发酵条件对一些关键因素进行了研究,如碳源、氮源、微量元素、pH值、摇瓶旋转速度等。
1 实验材料与方法
1.1 菌种
红曲霉菌株Monascus purpureus(ATCC 16365),保存培养基成分为:20 g葡萄糖、3 g麦芽膏、5 g蛋白胨、3 g 酵母膏、1.5 g 琼脂、1000 ml水[4]。
1.2 培养基
种子培养采用了摇瓶培养,培养液成分为:30 g 大米粉、1.5 gNaNO3、2.5 gKH2PO4、1.0 gMgSO4.7H2O、1000 ml水,121℃灭菌15 min,接种前pH值调整到7.0。
1.3 培养方法
1.3.1 种子的培养方法
将菌种接种到琼脂斜面培养基上,待孢子成熟后将孢子剥下,接入到250 ml三角瓶(100 ml培养液)中,30℃振荡(150 rpm)培养4 d。培养后的孢子悬浮液用均质器处理打碎后,作为接种液使用(接种体积分数为5%)。
1.3.2 发酵方法
液态培养实验均使用了250 ml三角瓶(100 ml培养液),振荡(150 rpm)培养4 d,通风量为1.0 vvm,溶解氧含量保持在20%以上。pH值影响研究实验中使用HCl和NaOH稀溶液调整。实验数据取三个平行实验结果的平均值。
1.4 分析方法
1.4.1 生物量的测定
取20 ml发酵液过滤,用蒸馏水洗涤两次,再置于80℃烘箱中烘干24 h后称重,即得生物量。
1.4.2 色素的测定
发酵液过滤后的滤液稀释后,用紫外可见分光光度计(721型:上海欣茂仪器有限公司)测定500 nm处的OD值,对没有接种的培养液进行相应倍数稀释,做空白对照。为了分析生物体内色素,取20 ml发酵液中的生物体用蒸馏水洗涤两次后,用20 ml的95%酒精振荡萃取,对萃取24 h后的浸提液进行离心分离,得到的上清液用适量水稀释,测OD值[5]。
2 实验结果与讨论
2.1 碳源的影响
为了确定发酵过程中的适宜碳源,对于不同种类碳源,按30 g/L浓度配制了培养基,发酵实验结果如图1。本实验所使用的不同碳源都可被红曲霉利用,不同种类碳源对红色素产量的影响是显著不同的,其中葡萄糖的效果优于其他碳源,以葡萄糖作为碳源的例子在文献报道中也较多[5]。可溶性淀粉会使培养液粘稠,增加供气难度。乳糖和蔗糖培养基中只有少量色素产生,因此可以确定葡萄糖为最佳碳源。
葡萄糖浓度对生物增长量和色素产量也有较大影响,浓度影响实验在5~50 g/L范围内进行,葡萄糖浓度为30 g/L时,达到红色素最大产量。过高葡萄糖浓度反而导致降低生物生长率和红色素产量,但是,是否由于产生乙醇影响和限制色素产量,高浓度碳源的具体限制机理还需要进一步研究。
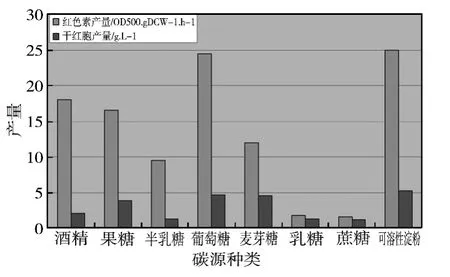
图1 不同碳源对生物产量和红色素产量的影响
2.2 氮源的影响
氮源的调节作用在微生物的代谢过程中非常重要[6],不同氮源培养条件下的实验结果见图2。硝酸铵、硝酸钠、谷氨酸钠的添加有利于红曲霉产色素,但生物体产量不如其他氮源,谷氨酸钠能很好地促进色素的合成。大豆粉和酵母提取物可促进生物增长,但色素产量不如谷氨酸钠。但是氯化铵的添加效果比硫酸铵好,这结果不同于文献报道,这应该是由于不同菌株对氮源的利用情况不同而出现的实验结果。谷氨酸钠的添加浓度影响实验在0.5~3 g/L范围内进行,适宜浓度为1.5 g/L,过高浓度虽有利于生物增长,造成菌体大量合成,但同时影响营养物质的传递,不利于代谢产物的合成与分泌,从而降低红色素产量。

图2 不同碳源对生物产量和红色素产量的影响
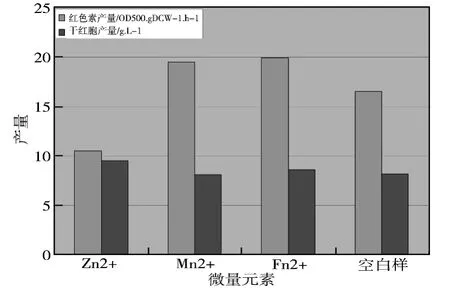
图3 不同微量元素对生物产量和红色素产量的影响
2.3 微量元素的影响
考察的Zn2+、Mn2+、Fe2+三种微量元素的影响结果见图3,Fe2+显著促进了菌体的生长以及红色素产量 也有促进作用,这实验结果可能是因为微量元素影响红曲色素合成酶系统。
2.4 pH值的影响
最佳碳源和氮源确定之后还进行了最佳pH值确定实验,pH值为4.5时,有利于生物增长,pH值在5.5~8.5范围内均有较高色素产量,在pH值小于5.5或大于8.5时,色素产量会明显降低。pH值在5.5~8.5范围内均有较高色素产量,但未经过调整的培养液pH值接近6.5,因此,最适合红色素的生成的pH值定为6.5。实验中还发现不同碳源和氮源组成时,发酵过程pH值也发生不同变化。
2.5 分批培养
在其他研究报告的基础上[7],再结合本实验结果,确定培养基组成物质后进行了分批培养。液态培养实验采用的摇瓶旋转速度为700 rpm,因为得到的菌丝可以形成介于浆状和小球状中间的混合物,有利于红色素的生成,而过强烈的搅拌则不利于生物生长,进而影响色素产量。
在最佳培养条件下,将红曲霉液体培养时间延长到7 d,每天测定主要变化,发现4 d后葡萄糖的消耗很大,同时生物增长的速度也变的缓慢,在1.5d时红色素开始大量形成,红色素的变化稍滞后于生物量的变化。4 d后随着营养物质的消耗,生物量和红色素量开始减少,微生物应该开始进入衰退期,因此,在此条件下的最佳培养时间定为4 d。最大生物产量和红色素产量分别为0.20 gDCW/g葡萄糖和32.5OD500 g/(DCW.h)。
3 结 论
通过红曲色素液态发酵工艺条件的优化,确定了最佳碳源是葡萄糖,氮源是谷氨酸钠。在30 g/L葡萄糖和1.5 g/L谷氨酸钠浓度条件下,能够获得红色素的最大产量,色素促进效果最佳的是微量元素Fe2+。最适合pH值定为6.5,分批培养时摇床定为700 rpm。在分批发酵时,最佳工艺条件下得到的生物体产量为0.20 gDCW/g葡萄糖,红色素产量为32.5OD500 g/(DCW.h)。在本研究中确定了成本较低廉、合理的培养条件来提高液态发酵生产红色素产量具有重要的现实意义。
[1]周波,王菊芳,吴振强等.高产红曲黄色素菌株的选育[J].微生物学通报,2008,35(12):1909-1914.
[2]丁海洋,孟惠惠,盛承承等.红曲霉JR摇瓶分批补料发酵产红曲色素的研究[J].中国酿造,2009(12):91-93.
[3]孙菲菲,岳田利,袁亚宏等.红曲霉菌5040发酵产生红曲色素的工艺及其色素特性的研究[J].西北农林科技大学学报,2006,34(6):137-144.
[4]Dominguez-Espinosa R M,Webb C.Submerged fermentation in wheat substrates for production of Monascus pigments[J].World J.Microbiol.Biotechnol.,2003,19(3):329 -336.
[5]杨成龙,杨晓君,何志刚等.碳氮源对红曲霉S产色素的影响[J].福建农业学报,2011,26(5):832-836.
[6]Kim C,Jung H,Kim Y,et al.Antimicrobial activities of amino acid derivatives of Monascus pigments[J].FEMS Microbiol.Lett.,2006,264(1):117-124.
[7]李小龙,张凤琴,刘飞等.氮源对红曲霉菌株HNLI产色素的影响[J].湖南工业大学学报,2009,23(5):22-25.
