肝素对金黄色葡萄球菌与血浆蛋白间粘附的阻断作用
2013-09-14张月明邹姗姗钱院红舒传业唐同同张羽汐
郑 胜,张月明,邹姗姗,钱院红,舒传业,易 景,唐同同,张羽汐
(东北电力大学化学工程学院,吉林 吉林 132012)
金黄色葡萄球菌(Staphylococcus aureus,金葡菌)是人和动物化脓感染中最常见的病原菌,可引起一系列不同程度的感染。一个不太严重的伤口若感染金黄色葡萄球菌,则极有可能发展为恶性的败血症、骨髓炎、脓毒性关节炎或心内膜炎等[1]。金黄色葡萄球菌更是医院感染中最常见的病原菌之一。据估计,约有0.5% ~1.5%的器官移植病人会受此菌感染,在某些情况下这个比率甚至会更高[2]。近年来,报告金黄色葡萄球菌感染的病例不断增加,在世界范围内,葡萄球菌株的耐药性日趋严重,给治疗带来一定的困难,因而当前迫切需要寻求新的抗生素以防治金黄色葡萄球菌[3]。
金黄色葡萄球菌通过表面的粘附素与宿主的细胞外基质发生特定的相互作用,是其感染的先决条件。若能阻断粘附环节,细菌将无法定居和繁殖,从而不能产生和释放胞外酶和外毒素,即可降低由其引发的疾病的发病率[4]。本研究的目的是通过静止粘附技术的实验手段,研究肝素对金黄色葡萄球菌与血浆蛋白粘附作用的阻断,以及肝素对淋巴细胞吞噬作用的影响。以期寻找防治金黄色葡萄球菌感染的新途径,为抗金黄色葡萄球菌感染药物的开发奠定基础。
1 材料与方法
1.1 实验动物及血浆蛋白和淋巴细胞的分离
1.1.1 血浆蛋白的分离
取ICR小鼠(购自吉林大学动物中心),麻醉后采用眼眶采血法取血3 mL,按71的比例加入柠檬酸抗凝剂,混合均匀后置于离心机中,以1500 rpm的转速离心20 min,离心后将上层血清转移至新的离心管中,置于4℃冰箱中保存备用。
1.1.2 淋巴细胞的分离
将八层纱布置于培养皿中,用PBS充分浸润,取小鼠脾脏用纱布包好后将其充分捣碎。取出纱布沥干,将培养皿中的液体转移至干净的离心管中,以1500 rpm的转速离心10 min。离心后弃上清液,用适量PBS将沉淀重悬,再以1500 rpm的转速离心10 min,如此反复两次。最后将沉淀的淋巴细胞以适量PBS重悬,重悬均匀后分装至几只干净的离心管中,置于4℃冰箱中保存备用即可。
1.2 金黄色葡萄球菌菌液的制备
取金黄色葡萄球菌菌株斜面培养物接种于牛肉膏蛋白胨液体培养基中,37℃、1500 rpm振荡培养3~4 h。3~4 h后,采用显微镜直接计数法对菌液进行计数,将菌液浓度调整至(10~100)×104个/ml,即血细胞计数板上平均每一大格的菌落数目为10~100个。置4℃冰箱保存备用。
1.3 肝素对粘附作用的阻断及最适作用浓度的确定
(1)取16只载玻片,任取其中2只编号①,各滴加30 μLPBS做空白对照;其余14只随机分成7组,编号②~⑧,分别滴加30 μL血浆蛋白溶液,滴好后置于4℃冰箱中过夜粘附;
(2)次日,取适量金黄色葡萄球菌菌液分别与 PBS、1.0、0.9、0.7、0.5、0.3、0.1 mg/mL 肝素溶液按91的比例混合,分别编号菌液A-G,混合均匀后置于37℃恒温培养箱中孵育30 min;
(3)30 min后从4℃冰箱中取出载玻片,用滤纸吸去未粘附在载玻片上的PBS和血浆蛋白溶液,①~②号滴加足量的菌液A,③-⑧依次滴加足量的菌液B-G,使菌液充分覆盖住载玻片上残留的PBS和血浆蛋白溶液。将全部载玻片重新移至37℃恒温培养箱中孵育30 min;
(4)30 min后将试样全部取出,用PBS将载玻片上的未粘附菌冲掉,镜检计数。粘附固定的菌落数目越少,说明阻断作用越明显。
1.4 肝素对淋巴细胞吞噬作用的影响
(1)取4只干净的离心管,编号①~④,分别滴加50 μL金黄色葡萄球菌菌液。其中①~③继续滴加50 μLPBS,④号滴加50 μL 1 mg/mL的肝素溶液,混合均匀后置于37℃恒温培养箱中孵育30 min;
(2)30 min后取出,①~②号滴加50 μLPBS,③~④号滴加50 μL血浆蛋白溶液,混合均匀后置于37℃恒温培养箱中孵育30 min;
(3)30 min后,①号滴加50 μLPBS,②~④号滴加50 μL淋巴细胞溶液,混合均匀后置于37℃恒温培养箱中孵育。之后每隔1 h取出镜检计数一次,共计孵育4 h,镜检计数4次,观察淋巴细胞对金黄色葡萄球菌的吞噬及肝素对这种吞噬作用的影响。
2 实验结果
2.1 肝素阻断粘附作用的最适浓度的确定
本文采用静止粘附实验检验肝素对金黄色葡萄球菌与血浆蛋白间粘附的阻断作用,在预先铺好血浆蛋白的玻片上加入用不同浓度肝素或PBS孵育后的金黄色葡萄球菌,并观察、统计其粘附的细胞数目。
实验结果如图1所示,1 mg/mL浓度的肝素溶液对粘附作用的阻断效果最明显,在该浓度下,粘附作用的强度最弱,固定的菌落数目最少;随着肝素溶液浓度的降低,阻断强度依次减弱;0.1 mg/mL浓度的肝素溶液对粘附作用的阻断效果最微弱。
在使用时需要考虑药品用量的问题。0.9 mg/mL、1 mg/mL浓度的肝素溶液阻断效果最明显,但药品用量过大;0.5 mg/mL和0.7 mg/mL的肝素溶液对粘附作用的阻断程度接近,且均有较为明显的现象。因此,建议确定肝素溶液作用的使用浓度为 0.5 mg/mL。
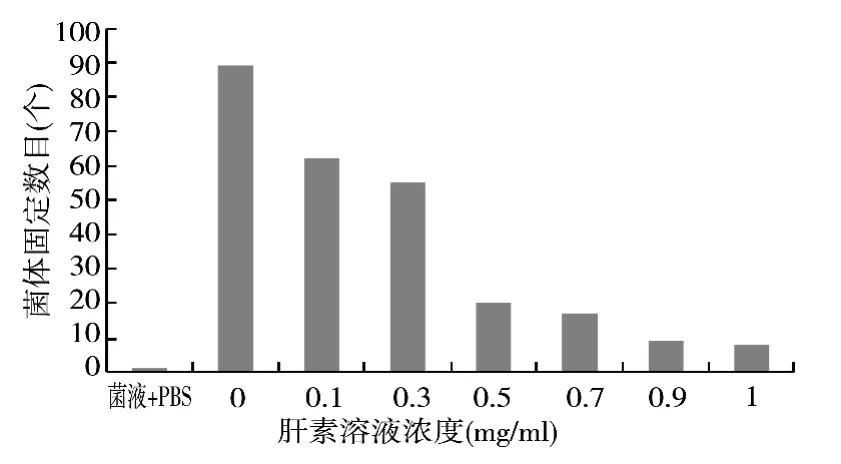
图1 不同浓度肝素溶液对粘附作用的阻断
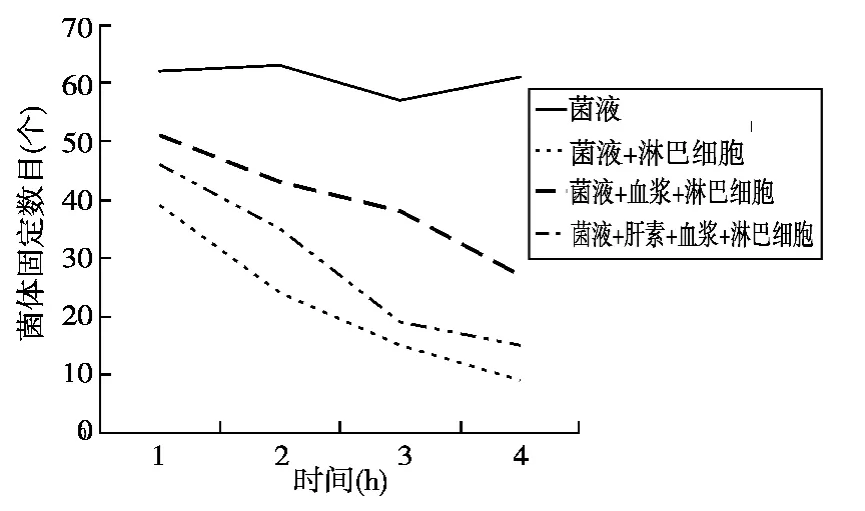
图2 菌体固定数目随时间变化规律
2.2 肝素对淋巴细胞吞噬作用的影响
本文采用体外吞噬实验检验血浆蛋白对淋巴细胞吞噬金黄色葡萄球菌的影响,并检验肝素对这种影响的遏制。实验如图2所示,淋巴细胞对游离的金黄色葡萄球菌有明显的吞噬作用;金黄色葡萄球菌粘附血浆蛋白后,淋巴细胞的吞噬作用减弱;添加肝素溶液后,这种吞噬作用的强度有回升的趋势。
3 讨 论
本研究主要采用静止粘附技术的实验手段,观察并研究肝素对金黄色葡萄球菌粘附血浆蛋白的阻断作用。实验结果显示,肝素对粘附过程有明显的阻断作用,且肝素溶液作用的最适浓度为0.5 mg/mL。
金黄色葡萄球菌产生的细胞外结合基质蛋白主要有能够识别纤连蛋白的纤连蛋白结合蛋白FnBP、能够识别纤维蛋白原的纤维蛋白结合蛋白ClfA/B(聚集因子A/B),以及能够识别胶原蛋白的胶原蛋白结合蛋白 Cna[5]。
由大量实验及相关文献资料可证实,几乎所有的金黄色葡萄球菌都具有纤连蛋白结合蛋白FnBP。FnBP能够识别机体的纤连蛋白,并与之发生特异性相互作用,依此介导金黄色葡萄球菌黏附于宿主组织[6]。肝素能够阻断FnBP与宿主细胞纤连蛋白之间的这种特异性相互作用,因此添加肝素溶液后粘附现象减弱。另外,该实验结果还可以证明FnBP在细菌粘附宿主细胞的过程中发挥着重要的作用,是金黄色葡萄球菌重要的粘附素之一。
肝素对淋巴细胞吞噬作用的影响的研究结果显示,淋巴细胞对游离的金黄色葡萄球菌具有明显的吞噬作用;金黄色葡萄球菌粘附血浆蛋白后,淋巴细胞的吞噬作用减弱;加入肝素溶液后,吞噬作用的强度又有回升的趋势。
金黄色葡萄球菌粘附血浆蛋白后,它的表面蛋白将机体细胞的可溶性细胞外基质(如纤连蛋白、胶原蛋白、纤维蛋白原等)大量结合在细菌菌体表面,使细菌体完全被宿主的细胞外基质包围,从而不被宿主的免疫系统所识别,因此淋巴细胞对金黄色葡萄球菌的吞噬作用减弱。加入肝素后,金黄色葡萄球菌与血浆蛋白的粘附作用被阻断,游离的金黄色葡萄球菌数目增多,被宿主细胞的细胞外基质包被的菌体数目减少,所以淋巴细胞的吞噬作用增强。这一实验结果也充分证明了金黄色葡萄球菌的表面蛋白除了介导细菌粘附外,还赋予细菌逃避宿主防御机制的功能[7]。
在抗生素使用如此普及的今天,金黄色葡萄球菌的耐药性日趋严重,给治疗带来一定的困难。由于缺乏有效的抗菌药物,许多病人感染高致病菌后便无药可治[8]。因而当前迫切需要寻求新的抗生素以防治金黄色葡萄球菌,而找到针对病原菌的新的靶点是获得新型抗生素的先决条件。金黄色葡萄球菌的表面蛋白由于具有与宿主组织特异的粘附能力,正成为抗金黄色葡萄球菌感染疫苗开发的热点分子[9]。
因此,观察并研究金黄色葡萄球菌的粘附现象,基于金黄色葡萄球菌表面蛋白的粘附机制研究如何阻断金黄色葡萄球菌对宿主细胞的粘附和侵入,从而防治由金黄色葡萄球菌感染所引发的疾病,并开发研制新型、安全、高效的抗金黄色葡萄球菌疫苗,是研究如何防治金黄色葡萄球菌感染的一个全新角度,具有十分广阔的研究前景[10]。
[1]饶希,吕晓菊,刘焱斌等.金黄色葡萄球菌败血症55例临床分析[J].四川大学学报:医学版,2009,40(2):347-349.
[2]韦莉萍,靳士英,李春梅等.金黄色葡萄球菌医院感染危险因素的研究[J].中华医院感染学杂志,2002,12(3):175-176.
[3]宁振英,任宪辉.金黄色葡萄球菌耐药性分析[J].牡丹江医学院学报,2009,30(2):92-93.
[4]陈怀青.金黄色葡萄球菌的粘附素[J].中国人兽共患病杂志,1996,12(6):43-44.
[5]Champion C,Elisabeth R,Wei C.A novel variant of the immunoglobulin fold in surface adhesins of Staphylococcus aureus:crystal structure of the Fbrinogen binding Mscramm,clumping factor A[J].Embo J.,2002,21(24):6660 -6672.
[6]Gabriel L,Nathan Y,Evgenia L,et al.Development of a Staphylococcus aureus vaccine against mastitis in dairy cows.Ⅱ.field trial[J].Veterinary Immunology and Immunopathology,2003,93(7):153 -158.
[7]周宏,李韩平,姜永强等.金黄色葡萄球菌表面蛋白研究进展[J].生物技术通讯,2004,15(1):73-75.
[8]李雅卿,黄卫红.耐甲氧西林金黄色葡萄球菌医院感染临床分析[J].中华医院感染学杂志,2002,12(2):151-152.
[9]李殷.葡萄球菌疫苗研制的进展与挑战[J].国外医学:免疫学分册,2003,26(4):179-183.
[10]张晓艳,易绍琼,陈薇.金黄色葡萄球菌疫苗的研究进展[J].微生物学免疫学进展,2009,37(2):74-78.
