反硝化聚磷菌的分离鉴定及其特性研究
2013-09-13张武刚洪武林郑春丽
张武刚 洪武林 郑春丽
进入21世纪以来,我国地表水污染问题依然较为严重,湖泊(水库)富营养化问题依然突出。导致水体富营养化的主要营养物质为氮和磷,而目前城市污水处理中对氮、磷的去除率并不高[1],所以防治水体富营养化首要目的就是研究如何进行脱氮除磷。
反硝化聚磷菌(Denitrifying phosphate accumulating organisms,DNPAOs)是应用于反硝化除磷技术的有效菌群,它能在缺氧条件下以硝酸盐作为电子受体进行同步反硝化(脱氮)和过量吸磷(除磷)过程[2,3]。因此,反硝化除磷技术具有反硝化脱氮时无需碳源、吸磷时无需曝气并且排泥量少等优点[4,5],已成为当前废水处理技术领域的研究热点之一。
目前国内外对反硝化聚磷菌的种属都有了一定的研究,而且反硝化聚磷菌的筛选技术也有了一定的发展,但较权威、特别是具有说服力的研究并不多[6]。本研究利用现有的反硝化聚磷菌筛选技术,从内蒙古乌梁素海湖水中找到了一株反硝化聚磷菌P1-1,通过形态、生理生化特性、BIOLOG碳源利用分析以及16S rRNA 基因序列分析对其进行了鉴定,再从生物学角度出发,对筛到的菌株进行了生物学特性研究,旨在为反硝化除磷这项新技术的应用推广提供一定的理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 化学试剂 KH2PO4等试验用到的试剂均为AR级,中国医药上海化学试剂公司生产;水样取自内蒙古乌梁素海湖水。
1.1.2 培养基 聚磷菌分离培养基(L-1)[7]:3.68 g CH3COONa·3H2O、131.82mg MgSO4·7H2O、57.27mg NH4Cl、28.73mg Na2HPO4·2H2O、26.74mg K2SO4、17.2mg CaCl2·2H2O、12 g HEPES 缓冲溶液、2mL微量元素和琼脂20g,pH7.0,用于聚磷菌的分离。
牛肉膏蛋白胨培养基(L-1):10 g蛋白胨、5 g牛肉膏、5 g NaCl、20 g琼脂,pH7.0,用于反硝化聚磷菌的纯化。
缺磷培养基(L-1)[6,8]:3.32 g CH3COONa·3H2O、152.8mg NH4Cl、17.83mg K2SO4、23mg Na2HPO4·2H2O、81.12mg MgSO4·7H2O、11mg CaCl2·2H2O、2mL微量元素和7 g HEPES 缓冲溶液,pH7.0。
富磷培养基(L-1)[6,8]:3.32 g CH3COONa·3H2O、91.26mg MgSO4·7H2O、305.52mg NH4Cl、25mg KH2PO4、25.68mg CaCl2·2H2O、2mL微量元素和 8.5 g PIPES缓冲液,pH7.0;可作为模拟废水。
微量元素溶液(L-1)[6,8]:5 g EDTA、5 g MnCl2·4H2O、1.6 g CuSO4·5H2O、5 g FeSO4·7H2O、50mg CoCl2·6H2O、10mg KI、50mg (NH4)6Mo7O24·4H2O 和 50mg H3BO3。
培养基中所有pH都用1mol/L的氢氧化钠溶液和1mol/L的盐酸溶液调至7.0;培养基都用1×105Pa灭菌 30min。
1.1.3 主要仪器 HITACHI U-2910型紫外可见分光光度计,雷磁PHS-3C型pH计,OLYMPUS CX31双目微生物学显微镜,日本电子JSM-5600 LV扫描电子显微镜,BIOLOG微生物自动分析系统。
1.2 方法
1.2.1 菌株的分离、纯化及筛选
1.2.1.1 菌株的分离、纯化 先将水样混合均匀,用移液管移取10mL水样,移入盛有90mL无菌水的三角瓶中,振荡使其混合均匀,按倍比稀释,分别得到 10-1、10-2、10-3、10-4、10-5和 10-6的稀释溶液。分别取10-3、10-4、10-5和10-6不同浓度的0.1mL水样溶液在聚磷菌分离培养基上进行涂布培养,在恒温隔水式培养箱中,30℃条件下培养2d。从这几个稀释梯度中挑选出1个最合适的梯度,要求平板上菌落分布清晰均匀(菌落数在30-300个),然后用此梯度的水样再进行3个重复平行涂布,挑取形态清晰、易于挑取的单菌落用牛肉膏蛋白胨培养基进行分离纯化,重复3次以上菌落形态特征一致,无异常菌落出现,可认为是单菌落。最后挑取纯化好的单一菌落接种到斜面培养基上培养2d,4℃保存备用。
1.2.1.2 菌株的筛选 选取上面分离纯化后所得的菌株,首先接种在缺磷培养基中,通过30℃,140r/min进行1-2d的富集预培养;接着取预培养后的5mL菌液,在1×104r/min的条件下离心2min,倾去上清液,并用无菌蒸馏水洗2次,将得到的菌株悬浮于富磷培养基中,整个过程在无菌操作台上进行;然后将接种好菌株的富磷培养基在30℃,140r/min进行扩大培养,培养24h,每种菌取15mL菌液,在1×104r/min的条件下离心2min,取上清液用钼酸铵分光光度法(GB 11893-89)测定接种前后-P含量的变化;最后取除磷率高于50%的菌株进行硝酸盐还原产气试验、异染颗粒染色试验和聚-β-羟基丁酸(PHB)颗粒染色试验,将既能过量吸磷,又具有反硝化脱氮功能并有PHB颗粒和异染颗粒的菌株定为反硝化聚磷菌(DNPAOs)[9]。
1.2.2 DNPAOs的脱氮除磷试验 将富磷培养基作为模拟废水,首先在原有富磷培养基的基础上加入一定量的KNO3,使硝态氮的含量为60mL/L[6],装入密封的三角锥形瓶,取预培养24h后的DNPAOs进行无菌蒸馏水洗涤2次,离心后投入到加有KNO3的富磷培养基中;最后在30℃恒温隔水式培养箱中培养24h后用钼酸铵分光光度法(GB 11893-89)测定培养前后磷含量的变化,并用紫外分光光度法(HJ/T 346-2007)测定硝态氮含量的变化。
1.2.3 菌株的鉴定
1.2.3.1 形态及生理生化特征 将处于稳定期的菌液制片,在光学显微镜下观察,并做革兰氏染色,利用扫描电镜分析梯度脱水处理后的剩余菌液。菌株的生理生化特征试验及鉴定见《伯杰细菌鉴定手册(第八版)》[10]。
1.2.3.2 BIOLOG碳源利用分析 利用BIOLOG微生物自动分析系统,以DNPAOs对微平板上95种碳源的利用情况为基础进行分析鉴定。
1.2.3.3 16S rRNA基因测序与构建系统发育树的分析 在液体培养基将菌体培养至对数期,取1mL菌液利用试剂盒(TIANamp Bacteria DNA Kit)提取基因组DNA,用常见细菌通用引物对(正向引物27F 5'-AGAGTTYGATCCTGGCTCAG-3';反向引物1492R 5'-AAGGAGGTGATCCAGCCGCA-3'[11])扩增菌株的16S rRNA基因。PCR反应体系总共为50μL,组成为:无菌水 34μL、10×PCR Buffer 5μL、dNTPs(2.5mmol/L)4μL、引物 27F 和 1492R 各 1μL、Taq DNA聚合酶 1μL、MgCl2(25mmol/L)3μL、DNPAOs 的基因组 DNA 1μL。所用程序为 :94℃ 3min;94℃40s,55℃ 30s,72℃ 1min,30个循环;72℃ 10min。PCR扩增产物的纯化和测序由上海生工生物技术有限公司来完成。然后将菌株的16S rRNA 基因序列结果提交到GenBank核酸序列数据库中与已有的相关序列比较,再通过ClustalX 1.8软件进行全序列的比对[12],最后利用MEGA3.1构建系统发育树[13]。
1.2.4 菌株的生物学特性研究
1.2.4.1 生长曲线的测定 细菌的生长情况采用光电比浊法进行测定,利用HITACHI U-2910型紫外可见分光光度计以OD600值表示;培养条件:温度30℃,pH7.0,转速140r/min,每2h取样测一次,共测24h。
1.2.4.2 温度、pH值、磷含量与菌株生长关系的确定 温度分别设置为15℃、20℃、25℃、30℃、35℃和40℃,将筛选到的DNPAOs活化18h后,在每个温度条件下以10%的接种量(接种后OD600=0.14±0.01)分别接入3份同样的模拟废水即富磷培养基中,恒温、140r/min的条件下培养24h后,测定细菌悬浮液的OD600以及接种前后模拟废水中的磷含量的变化。
pH分别设置为4.0、5.0、6.0、7.0、8.0、9.0和10.0,以上述相同的接种方式,30℃恒温、140r/min条件下培养24h后测定细菌悬浮液的OD600以及接种前后模拟废水中的磷含量的变化。
2 结果
2.1 反硝化聚磷菌的分离、纯化及筛选
挑取的菌落经牛肉膏蛋白胨3次以上划线后得单菌落菌株8株,按照“1.2方法”在缺、富磷液体培养基内培养后,选出除磷率在50%以上的8株菌,经硝酸盐还原产气试验、PHB颗粒染色及异染颗粒染色试验,结果见表1。

表1 菌株的筛选结果
2.2 反硝化聚磷菌的脱氮除磷试验
经过24h缺氧培养后测定NO3--N和
2.3 菌株P1-1鉴定

图1 菌株P1-1 显微镜照片(1000×)
2.3.1 菌株P1-1形态学特征与生理生化特性 菌株P1-1革兰氏染色反应呈阴性,光学显微镜和扫描电镜显示该菌为典型的短杆状(图1,图2),大小(0.3-0.4μm)×(1.2-2.0μm)。在固体牛肉膏蛋白胨培养基上培养24h菌落直径小于1mm,48h菌落基本长成,菌落直径1-2mm,不透明,米黄色,拱顶球状,边缘整齐,易挑起。菌株P1-1主要生理生化特性为革兰氏阴性,氧化酶阳性,接触酶阳性(表 2)。

图2 菌株P1-1的扫描电镜照片
2.3.2 BIOLOG碳源利用分析 将BIOLOG系统鉴定结果与数据库中数据进行匹配,ID地址栏显示最佳匹配名称为Pseudomonas fluorescens,系统得到的3个重要参数均比较理想,分别为:SIM值=0.514,DIST=4.355,PROB=67.2%。BIOLOG分析结果说明该菌株与Pseudomonas fluorescens匹配度最高且达可信程度。
2.3.3 16S rRNA基因序列分析 测序获得菌株P1-1的16S rRNA基因序列(1 440bp),GenBank序列登录号为JN030498。菌株P1-1的16S rRNA基因序列与GenBank中已有的多株Pseudomonas fluorescens菌株相似性都在99%,并在16S rRNA基因序列同源性的基础上构建系统发育树(图3)。

表2 菌株P1-1的生理生化鉴定
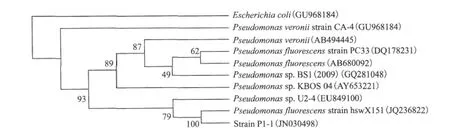
图3 菌株P1-116S rDNA序列的系统发育树
2.4 菌株P1-1的生物学特性研究
2.4.1 菌株P1-1的生长曲线测定 菌株P1-1的生长曲线(图4)显示,菌株的延滞期不足2h,说明接种的菌株都处在生长旺盛期,4h以后菌株进入对数生长期,而在12h以后菌株进入了稳定期,说明菌株P1-1易于培养。
2.4.2 温度对菌株P1-1生长及除磷效果的影响 为确定菌株P1-1最佳生长温度和最佳除磷温度,以富磷培养基为反应体系,改变反应物体系的温度,测定OD600和反应前后磷浓度的变化,每个温度下的3个平行试验取平均值,结果如图5所示。菌株P1-1在温度15-35℃生长良好,菌株的最佳生长温度为30℃;菌株在15-35℃除磷率接近100%;40℃下不利于菌株生长而且没有除磷效果。
2.4.3 pH对菌株P1-1生长及除磷效果的影响 为确定菌株P1-1最佳生长pH和最佳除磷条件下的pH,以富磷培养基为反应体系,改变反应物体系的pH,每个pH值下的3个平行试验平均值,结果如图6所示。菌株P1-1在pH 6.0-9.0生长良好,其中在pH 8.0下是生长最好;菌株在pH6.0-9.0磷的去除效果都很好,去除率都接近100%;在pH<6.0或者pH>9.0时磷的去除效果都不好,特别是在偏酸性条件下不利于菌株的生长。

图4 菌株P1-1的生长曲线

图5 温度对菌株P1-1的生长及除磷率的影响

图6 pH对菌株P1-1的生长及除磷率的影响
3 讨论
本研究结果显示,菌株P1-1具有反硝化能力,且体内都含有PHB颗粒和异染颗粒,认为菌株P1-1为反硝化聚磷菌。菌株P1-1主要生理生化特性为革兰氏阴性,氧化酶阳性,接触酶阳性,其基本生理生化特性与《伯杰细菌鉴定手册》中描述的假单胞菌(Pseudomonas)[10]很相似。结合菌株 P1-1的主要形态特征、生理生化特征,BIOLOG分析结果以及16S rRNA序列分析结果,鉴定该菌株为荧光假单胞菌,命名为Pseudomonas fluorescens strain P1-1。根据马放等[6]所报道的高效反硝化聚磷菌的除磷和脱氮效果,本试验筛选到的菌株已经表现出了较好的反硝化除磷能力。虽然菌株P1-1在缺氧条件下具有反硝化过量吸磷的能力,但是缺氧条件下磷的去除效果没有好氧条件好,这是由于利用硝态氮吸磷时可能不如利用分子氧效率高[14]。根据报道[4,5],反硝化除磷技术具有脱氮时无需碳源、吸磷时无需曝气并且排泥量少等优点,而反硝化聚磷菌在反硝化除磷技术中起到了关键作用。因此筛选分离反硝化聚磷菌对研究反硝化除磷技术,提高反硝化除磷能力具有重大意义。
4 结论
参考已有的反硝化聚磷菌的筛选方法,利用聚磷分离培养基进行初筛,大大提高了筛菌的效率,缩短了时间。从内蒙古乌梁素海湖水中筛选到一株反硝化聚磷菌,鉴定为荧光假单胞菌,并命名为荧光假单胞菌P1-1(Pseudomonas fluorescens strain P1-1)。菌株P1-1最佳生长和除磷的温度是30℃,pH为8.0,除磷率接近100%,具有较好的应用前景。
[1] 吕志堂, 纪翠平, 苏强, 等.3株反硝化聚磷菌的分离与鉴定[J].环境工程学报, 2009, 3(8):1405-1048.
[2] Lee DS, Jeon CO, Park JM.Biological nitrogen removal with enhanced phosphate uptake in a sequencing batch reactor using single sludge system [J].Water Research, 2001, 35(16):3968-3976.
[3] Ahn J, Daidou T, Tsuneda S, et al.Characterization of denitrifying phosphate-accumulating organisms cultivated under different electron acceptor conditions using polymerase chain reactiondenaturing gradient gel electrophoresis assay [J].Water Research,2002, 36(2):403-412.
[4] Kuba T, Van Loosdrecht MCM, Heijnen JJ.Phosphorus and nitrogen removal withminimal COD requirement by integration of denitrify dephosphatation and nitrification in a two-sludge system [J].Water Research, 1996, 30(7):1702-1710.
[5] Merzouki M, Bernet N, Delgenes JP, et al.Bioloical denitrifying phosphorus removal in SBR:effect of added nitrate concentration and sludge retention time [J].Water Science and Technology,2001, 43(3):191-194.
[6] 马放, 王春丽, 王立立.高效反硝化聚磷菌株的筛选及其生物学特性[J].哈尔滨工程大学学报, 2007, 28(6):631-635.
[7] 杨志愿, 邱业先, 李孝坤, 等.几株反硝化聚磷菌的筛选及其生理生化特性的鉴定[J].苏州科技学院学报, 2009, 26(3):42-48.
[8] Merzouki M, Delgenes JP, Bernet N, et al.Polyphosphateaccumulating and denitrifying bacteria isolated from anaerobicanoxic and anaerobic-aerobic sequencing batch reactors [J].Current Microbiology, 1999, 3(8):9-17.
[9] 罗宁, 罗固源, 吉方英, 等.新型双泥生物反硝化除磷脱氮系统中微生物的组成[J].给水排水, 2003, 29(8):33-35.
[10] Buchanan RE, Gibbons NE.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社, 1984:274-313.
[11] Liu JS, Xie XH, Xiao SM.Isolation of Leptospirillum ferriphilum by single-layered solidmedium [J].Journal of Central South University of Technology, 2007, 14(4):467-473.
[12] Thompson JD, Gibson TJ, Plewniak F, et al.The CLUSTAL X windows interface:flexible strategies formultiple sequence alignment aided by quality analysis tools [J].Nucleic Acids Research, 1997, 25(24):4876-4882.
[13] Kumar S, Tamura K, Nei M.MEGA3:integrated software formolecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics, 2004, 5(2):150-163.
[14] Vlekke G, Comeau Y, Oldham WK.Biological phosphate removal from wastewater with oxygen or nitrate in sequencing batch reactors[J].Environmental Technology Letters, 1988, 9(8):791-796.
