低温环境下聚磷微生物的富集驯化研究*
2014-12-19邹海明吕锡武
邹海明,吕锡武,顾 倩
(1.东南大学 能源与环境学院,江苏 南京 210096;2.安徽科技学院 资环系,安徽 凤阳 233100)
氮、磷元素是引起水体富营养化的两个重要因子,众多国家对其排放浓度都有着严格限制.我国国家环境保护部要求城镇污水处理厂出水排入重点流域及湖泊、水库等封闭、半封闭水域时,执行《城镇污水处理厂污染物排放标准》(GB 18918-2002)的一级A 标准.随着氮、磷排放标准的提高,在新建污水处理厂或旧工艺升级改造过程中,高效率低能耗的生物脱氮除磷技术应用尤为重要.
目前,生物强化除磷工艺(enhanced biological phosphorus removal,EBPR)因其效率高、成本低和环境友好而备受学者关注.该工艺中主要的功能微生物是聚磷菌(Accumulibacter),其主要特点是:在厌氧条件下细胞内聚磷水解产生能量(adenosine triphosphate,ATP)和还原型辅酶NADH,用于挥发性脂肪酸(volatile fatty acid,VFA)的吸收并储存为聚-β-羟丁酸(poly-β-hydroxybutyrate,PHB);然后在好氧条件下以PHB 为电子供体,以氧为电子受体进行过量吸磷,从而以剩余污泥排放的形式去除污水中的磷[1].随着学者对聚磷菌的深入研究[2-3],发现存在着一种聚磷菌可以在缺氧条件下以硝酸盐为电子受体进行同步反硝化脱氮除磷,称为反硝化聚磷菌.反硝化聚磷菌相比于好氧聚磷菌可节省曝气量30%,减少污泥产生量50%,降低碳源需求量50%,特别适合低C/N 比生活污水的处理[4].无论是好氧聚磷菌还是反硝化聚磷菌在富集过程中都极易受到具有类似代谢类型但不具备释磷和吸磷功能的聚糖菌竞争,而pH,DO,碳源和温度等因素[5-7]将影响着聚磷菌和聚糖菌的富集环境[8].在这些影响因素中,温度是聚磷菌和聚糖菌富集的主要影响因素[9].Winkler等人[10]研究发现当温度从20 ℃上升到30 ℃时,磷去除率从79%降至32%;当温度由20 ℃上升到35 ℃时类似的结果同样被发现[6];亢涵等人[11]在温度为15 ℃的情况下成功富集到大量的聚磷菌而淘汰了聚糖菌.在已有的温度研究范围内(15 ℃~40 ℃)温度越低越有利于聚磷菌的生长繁殖,然而关于低温下(<15 ℃)富集聚磷菌的文献尚未见报道.研究低温环境下聚磷菌的富集驯化状况,对EBPR 系统应用于实践有着重要的指导意义(尤其是冬季).
为此,本课题在低温(冬季室温为8~11 ℃时)情况下开展好氧聚磷菌和反硝化聚磷菌的富集驯化,探究一种可以实现低温启动运行EBPR 系统的策略;通过进出水工艺参数化学分析,考察系统启动运行状况;通过不同环境下的批次试验,考察聚磷菌吸磷和释磷特征;利用FISH 分子生物学分析手段,考察反应器启动前后活性污泥中聚磷菌数量的动态变化.结合本试验化学分析和微生物分析结果,以期为低温环境下启动运行EBPR 系统提供参考,同时为EBPR 技术应用于实践中提供借鉴.
1 材料与方法
1.1 反应装置及运行
试验装置为有机玻璃材质(内径15cm,总高度33cm,有效容积3.3L),见图1.整个装置通过电子控制器(上海天那电器有限公司)控制进水、出水、搅拌和曝气,其运行周期为8h(进水0.5h,厌氧2 h,缺氧或好氧4h,沉淀1h和排水0.5h).厌氧段控制溶解氧DO(dissolved oxygen)为0.1mg/L以下,好氧段控制DO 为2.0mg/L 以上,缺氧段控制氧化还原电位ORP(oxidation-reduction potential)为-100~-40mV,温度为8~11 ℃(室温),控制pH 7.0±0.5.由于本试验是在低温下运行,故采用“高注水比(0.58)、高污泥浓度、先高后低底物负荷”工况启动厌氧/好氧(anaerobic/aerobic)和厌氧/缺氧(anaerobic/anoxic)反应器(简称RAO,RAA),水力停留时间HRT(hydraulic detention time)为13.9h.在厌氧/缺氧反应器运行之前,先通入氮气(1.5L/min)5min排除残余氧气.好氧段通入空气速率为2.0L/min.整个试验过程中除进水、出水和沉淀期间外,均采用悬臂式搅拌机搅拌,速率为200 r/min.

图1 试验装置示意图Fig.1 Schematic diagram of experimental setup
1.2 试验材料
试验所用接种污泥取自江苏省南京市城东污水处理厂A2O(厌氧/缺氧/好氧,anaerobic/anoxic/aerobic)工艺好氧池,主要参数:混合液悬浮固体浓度MLSS(mixed liquor suspended solids)为4 200 mg/L,混合液挥发性悬浮固体浓度MLVSS(mixed liquor volatile suspended solids)为3 600mg/L.
试验用水采用人工配水,其主要成分为,每升(L):CH3COONa,1.025g;KH2PO4,0.176g;(NH4)2SO4,0.471g;CaCl2,0.021g;MgSO4·7H2O,0.180g.营养液0.60mL;营养液组成,每升(L):FeCl3·6H2O ,1.50g;H3BO3,0.15g;Cu-SO4·5H2O,0.03g;KI,0.18g;MnCl2·4H2O,0.12g;Na2MoO4·2H2O,0.06g;ZnSO4·7H2O,0.12g;CoCl2·6H2O,0.15g;EDTA,10.00g,其水质:化学需氧量COD(chemical oxygen demand)800mg/L,PO43--P 40mg/L.
1.3 试验设计
1.3.1 富集试验
厌氧/好氧和厌氧/缺氧两个反应器内污泥富集过程分为两个阶段:阶段一(0~30d),为了在低温环境下有利于微生物生长采用高底物负荷进水,进水中COD 800 mg/L,PO43--P 40 mg/L,缺氧时加NO3--N 50mg/L,此阶段不排泥;阶段二(31~80d),为了适应生活污水水质和成功富集聚磷菌,此阶段降低进水中的底物负荷和COD/P 比[14],进水中COD 300 mg/L,PO43--P 20 mg/L,缺氧时加NO3--N 30 mg/L,每天厌氧/好氧反应器排泥330mL,厌氧/缺氧反应器排泥115 mL,使其污泥停留时间(sludge retention time,SRT)分别为10d和20d,污泥浓度(mixed liquor suspended solid,MLSS)分别为4 500mg/L和3 700mg/L.
1.3.2 批次试验
为了探究好氧聚磷菌以硝酸盐为电子受体的除磷能力和反硝化聚磷菌以氧为电子受体的除磷能力,在两个反应器运行达到稳定状态时进行污泥样品的批次试验.在好氧段和缺氧段结束取污泥样品0.5L,立即用营养液(不含C,N,P)冲洗2次.处理后的好氧聚磷菌污泥和反硝化聚磷菌污泥样品平均分为两部分,加入到批次试验容器中(有效容积1 L),见图2.好氧聚磷菌污泥和反硝化聚磷菌污泥分别在厌氧/好氧和厌氧/缺氧两种模式下进行对比试验,进水浓度与富集试验阶段二一致.各阶段运行时间为:厌氧2h,缺氧或好氧4h,每隔15min采集一次样品.

图2 批次试验装置示意图Fig.2 Schematic diagram of batch tests
1.3.3 荧光原位杂交
为了探究厌氧/好氧和厌氧/缺氧两个反应器内富集前后聚磷菌动态变化,此处采用荧光原位杂交(FISH)技术原位分析接种污泥、好氧聚磷菌污泥和反硝化聚磷菌污泥聚磷菌丰度.取培养驯化前接种污泥、厌氧/好氧和厌氧/缺氧反应器稳定阶段污泥各5mL进行FISH 分析,其操作步骤[13]为:样品前处理、4%的多聚甲醛固定、乙醇梯度脱水、原位杂交、洗脱、DAPI染色和风干备观察.
1.4 分析方法
1.4.1 化学分析
PO43--P 和NO3--N采用流动分析仪测定(AutoAnalyzer3,SEAL,英国);COD,MLSS,MLVSS根据标准方法[15]测 定;DO 采 用 溶 解 氧 测定仪(YSI DO 200,美国)测定;pH,ORP采用复合测定仪(YSI pH 100,美国)测定.
1.4.2 微生物分析
试验使用的16SrRNA 寡核苷酸荧光探针[16]由上海生物工程公司合成,PAO651(5’-CCCTCTGCCAAACTCCAG-3’), PAO462 (5’-CCGTCATCTACWCAGGGTATTAAC-3’), PAO846(5’-GTTAGCTACGGCACTAAAAGG-3’)以上均由荧光染料Cy3标记为红色.使用时将PAO651,PAO462,PAO846 3种荧光探针按等体积混合配制成PAOmix,浓度为50ng/μL,用于探测聚磷菌Accumulibacter.此外,DAPI(4',6-二脒基-2-苯基吲哚)染色用于检测全细菌[17].
1.4.3 数据处理
数据统计分析和图形绘制采用origin 8.0 软件;试验装置图绘制采用Visio 2003 软件;FISH 图片观察通过荧光显微镜(FSX100,Olympus,日本),具备图像导航功能且带有Olympus FSX-BSW软件;FISH 图片荧光强度分析采用Image-Pro Plus软件[18].
2 结果与分析
2.1 厌氧/好氧和厌氧/缺氧反应器启动过程
2.1.1 出水磷浓度的变化
取自A2O 工艺好氧池的接种污泥在低温情况下(8 ℃~11 ℃)通过厌氧/好氧和厌氧/缺氧两种模式富集好氧聚磷菌和反硝化聚磷菌,定期监测出水中磷(PO43--P)浓度,结果见图3.厌氧/好氧反应器在40d时达到稳定状态,其出水PO43--P浓度为0.5mg/L,而厌氧/缺氧反应器则通过80d的富集驯化过程达到与厌氧/好氧相类似的稳定状态.通过试验发现:在低温情况下采用“高注水比、高污泥浓度、先高后低底物负荷”可以成功地富集到好氧聚磷菌和反硝化聚磷菌,但达到稳定阶段(即微生物驯化成熟)所需的时间与高温富集时相比较长[11,19].在污泥培养驯化开始阶段,两个反应器内均表现出一定的磷去除能力,这是由于接种污泥取自A2O 工艺,该工艺中污泥经历厌氧/缺氧/好氧过程可以富集到一定量的聚磷微生物,FISH 分析显示接种污泥中含有9.3%的Accumulibacter(见2.5节).
2.1.2 MLVSS/MLSS比值的变化
在生物强化除磷系统中,MLSS由MLVSS和灰分组成,MLVSS包括:生物细胞体、PHB和糖原,灰分则95%以上是聚磷,((KMg)1/3PO3)n.因 此,通 常 用MLVSS/MLSS比值大小表征聚磷微生物含磷量的多寡[20].接种污泥、厌氧/好氧和厌氧/缺氧反应器启动完成后污泥MLSS,MLVSS和MLVSS/MLSS比值见表1.由表1可知,厌氧/好氧和厌氧/缺氧反应器内污泥含磷量要明显高于接种污泥含磷量,其MLVSS/MLSS比值分别为0.70,0.78和0.86,与Lu等人[21]在实验室条件下富集聚磷菌MLVSS/MLSS变化一致(从0.84降至0.71),表明了聚磷菌已在两个反应器内成为优势种群.

图3 厌氧/好氧和厌氧/缺氧反应器启动过程中出水磷浓度变化Fig.3 Variations of effluent PO43--P concentration of RAA and RAO during their start-up period

表1 厌氧/好氧和厌氧/缺氧反应器启动前后MLSS和MLVSS的变化Tab.1 Variations of MLSS,MLVSS and MLVSS/MLSS before and after RAA and RAO start-up
2.2 厌氧/好氧和厌氧/缺氧反应器内污泥厌氧释磷特征
对于增强的生物除磷系统EBPR 来说,厌氧释磷越充分,越有利于好氧或缺氧条件下过量吸磷从而有效去除废水中的磷[22].为此,通过批次试验考察厌氧/好氧和厌氧/缺氧两个反应器启动完成后污泥厌氧释磷特征,接种污泥做同样的试验作为对照.
2.2.1 污泥厌氧释磷量的变化
在2h的厌氧过程中好氧聚磷菌污泥、反硝化聚磷菌污泥和接种污泥释磷量的变化和总释磷量,见图4和图5.
在整个厌氧释磷过程中,接种污泥在前30min内表现了一定的释磷能力(7.8 mg P/g MLVSS),表明在A2O 工艺中有一定数量的聚磷菌存在,这为低温环境下富集好氧聚磷菌和反硝化聚磷菌提供了帮助.因此,在富集聚磷菌试验中所用的接种污泥应取自含有厌氧/缺氧/好氧过程的工艺(如A2O,氧化沟),若从传统的仅为去除有机物为目的的工艺中取泥则增加了聚磷菌的富集难度,这一点在Hu等人[23]的试验中得到了证实.好氧聚磷菌单位污泥释磷量要高于反硝化聚磷菌释磷量,分别为27.7 mg P/g MLVSS,17.4mg P/g MLVSS,但通过增加厌氧/缺氧反应器内污泥浓度可以弥补释磷总量的差距.此外通过MLVSS/MLSS比值(见表2)在厌氧前后的变化也可以看出两个反应器内聚磷菌细胞内聚磷含量逐渐减少,表明好氧聚磷菌和反硝化聚磷菌均发挥了生物除磷功能.

图4 厌氧/好氧,厌氧/缺氧和接种污泥厌氧释磷过程Fig.4 Phosphorus release performance of sludge from RAA,RAO and seed in anaerobic condition

图5 厌氧/好氧,厌氧/缺氧和接种污泥释磷量和吸磷量Fig.5 Amount of phosphorus release and uptake of sludge from RAA,RAO and seed in anaerobic,aerobic or anoxic conditions
2.2.2 污泥厌氧释磷过程中碳源吸收量的变化
聚磷菌在好氧或缺氧阶段完成过量的吸磷工作,其能量主要来源于降解细胞内储存的PHB,而细胞内PHB的储存水平与厌氧阶段碳源吸收量有着直接关系[24].单位MLVSS污泥吸收碳源量(以COD 计)及与释磷量的关系见表2和图6.由表2可知,不同环境下富集的聚磷菌其单位污泥吸收碳源的能力有明显差异,好氧聚磷菌比反硝化聚磷菌有更强的吸收碳源能力,相应地其释磷能力也更强.
在EBPR 系统中,当好氧聚磷菌或反硝化聚磷菌培养驯化完成(即在反应器内占优势地位)时,厌氧阶段碳源吸收量与释磷量有明显的正相关关系[25].由图6可知,厌氧/好氧和厌氧/缺氧污泥在厌氧阶段其碳源消耗量与释磷量表现了较好的相关关系,其决定系数R2分别为0.9411和0.9712,而接种污泥的这种相关关系较差(R2=0.7098)且碳源消耗量、释磷量低,表明聚磷菌在传统的脱氮除磷降解有机物系统中数量较少,不占优势地位.FISH 分析(见2.5节)也同样显示了在厌氧/好氧和厌氧/缺氧两个EBPR 反应器内聚磷菌为优势种群.

表2 厌氧/好氧和厌氧/缺氧过程中污泥化学计量值的变化Tab.2 Variations of stoichiometry of sludge samples from RAA,RAO and seed at the anaerobic-aerobic or anoxic modes
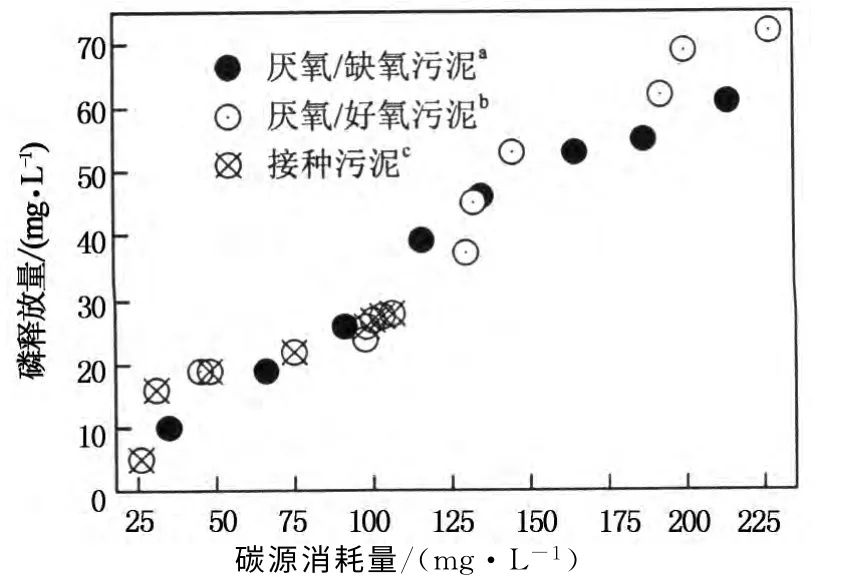
图6 厌氧/好氧,厌氧/缺氧和接种污泥在厌氧阶段碳源消耗量与释磷量的关系Fig.6 Relationships of carbon consumption with phosphorus release of sludge from RAA,RAO and seed in anaerobic phase
2.3 厌氧/好氧和厌氧/缺氧反应器内污泥好氧吸磷特征
Zeng等人[26]在脱氮除磷理论与实践研究过程中发现,聚磷菌并不是专属好氧菌,存在一类可以以硝酸盐为电子受体进行同步反硝化脱氮除磷的聚磷菌,即聚磷菌存在着两种类型:一种是仅以氧为电子受体;另一种是既可以以氧也可以以硝酸盐为电子受体,即反硝化聚磷菌.在此,通过批次试验比较厌氧/好氧和厌氧/缺氧反应器内污泥以氧为电子受体好氧吸收磷的能力,结果见图5和图7.
厌氧/好氧反应器启动成功后,好氧聚磷菌表现出良好的好氧吸磷能力,其单位污泥磷量为35.2mg P/g MLVSS,与厌氧释磷量(见2.2.1)之比为1.27,也证实了该反应器污泥已驯化完成,存在较多数量的聚磷菌[19].与厌氧/好氧反应器污泥好氧吸磷能力相比,尽管厌氧/缺氧反应器内污泥吸磷能力较低(23.1mg P/g MLVSS),但是在缺氧环境下富集的反硝化聚磷菌当提供氧为电子受体时,立即表现出较好的好氧吸磷能力,这也表明了确实存在既可以以氧为电子受体也可以以硝酸盐为电子受体的反硝化聚磷菌这一类型,类似的结果也被其它研究所证实[27-28].取自A2O工艺的接种污泥同样也可以去除厌氧出水中的磷(但是吸磷量低,10.9mg P/g MLVSS),主要是该工艺长期在厌氧/缺氧/好氧条件下运行,污泥存在一定数量的聚磷菌,具备一定的厌氧释磷和好氧吸磷能力;此外工艺中其它微生物(C60H87O23N12P)的生长繁殖也需要一定数量的磷.
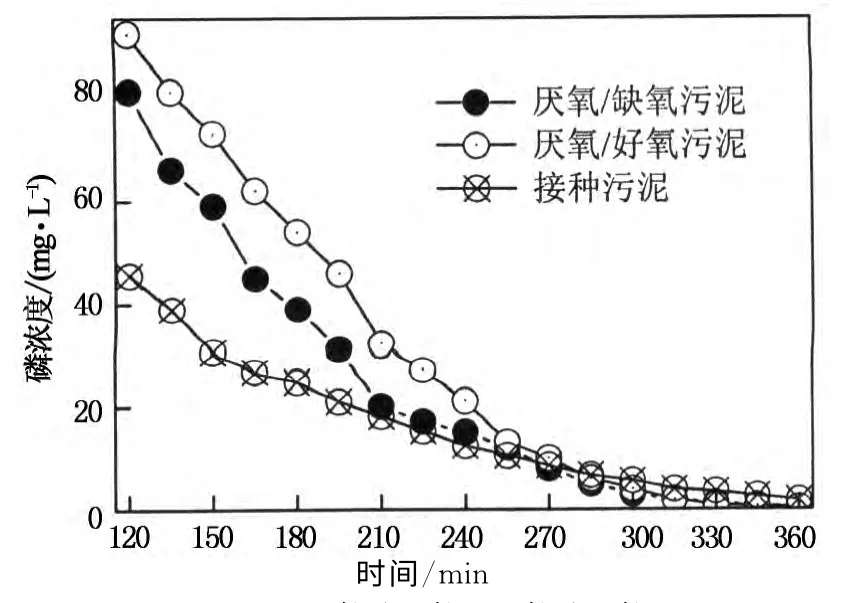
图7 厌氧/好氧,厌氧/缺氧和接种污泥好氧吸磷过程Fig.7 Aerobic phosphorus uptake performance of sludge from RAA,RAO and seed
2.4 厌氧/好氧和厌氧/缺氧反应器内污泥缺氧吸磷特征
类似于2.3节,此节同样通过批次试验比较了厌氧/好氧和厌氧/缺氧反应器内污泥以硝酸盐为电子受体缺氧吸磷的能力,结果见图5和图8;反硝化除磷是基于同步脱氮除磷理论,因此也考察了硝酸盐浓度的变化情况,结果见图9.
厌氧/缺氧污泥在缺氧条件下吸收磷的能力稍微低于好氧条件下吸收磷的能力,分别为22.9 mg P/g MLVSS 和23.1 mg P/g MLVSS,表明在厌氧/缺氧条件下富集的反硝化聚磷菌能较好地以氧或硝酸盐为电子受体进行吸磷,相应地硝酸盐利用率也较高,与文献[29,30]中结果一致.然而厌氧/好氧环境中富集的好氧聚磷菌,用硝酸盐代替氧作为电子受体进行同步反硝化脱氮除磷效果较差,好氧聚磷菌并不能立即进行反硝化脱氮除磷,其吸磷能力为6.9 mg P/g MLVSS 远低于好氧吸磷能力(35.2mg P/g MLVSS).反硝化聚磷菌可以很容易地利用氧为电子受体进行吸磷,而好氧聚磷菌不易利用硝酸盐作为电子受体立即吸磷,这主要因为反硝化聚磷菌在好氧条件下较容易合成与缺氧代谢酶相类似的好氧代谢酶,而好氧聚磷菌在缺氧条件下很难迅速合成缺氧代谢酶[31].接种污泥尽管缺氧吸磷能力较低(3.9 mg P/g MLVSS),但是硝酸盐的利用率较高,主要是因为反硝化细菌利用残余的碳源和加入的硝酸盐进行反硝化脱氮,此外也有少量的反硝化聚磷菌同步脱氮除磷作用.
结合2.3节和2.4节,厌氧/缺氧反应器富集的反硝化聚磷菌在缺氧条件下的吸磷能力(22.9 mg P/g MLVSS)低于厌氧/好氧反应器富集的好氧聚磷菌在好氧条件下的吸磷能力(35.2 mg P/g MLVSS),这主要是因为反硝化聚磷菌以硝酸盐为电子受体产生的能量(ATP)约为好氧聚磷菌以氧为电子受体产生ATP的40%[32].在实践中可以通过提高反硝化聚磷菌污泥浓度来弥补吸磷能力低的差距,因为反硝化聚磷菌呈颗粒状有着很好的沉降性能,而好氧聚磷菌呈絮状沉降性能较差[33].

图9 厌氧/好氧,厌氧/缺氧和接种污泥缺氧条件下硝酸盐去除情况Fig.9 Nitrate removal performance of sludge from RAA,RAO and seed in anoxic conditions
2.5 厌氧/好氧和厌氧/缺氧反应器内聚磷菌原位分析
为了考察厌氧/好氧和厌氧/缺氧反应器内启动前后聚磷菌(Accumulibacter)的动态变化,利用荧光原位杂交技术(FISH)分析了接种污泥、厌氧/好氧反应器和厌氧/缺氧反应器污泥聚磷菌的丰度,结果见图10,粉红色是由Cy3标记的荧光探针PAOmix(红色)和DPAI染色(蓝色)的叠加色,表征污泥中聚磷菌的分布,通过生物图像分析软件Image-Pro Plus计算荧光强度得到聚磷菌占总细菌的比例.
通过FISH 分析发现,聚磷菌已成功大量富集在厌氧/好氧和厌氧/缺氧反应器内,取自A2O 工艺的接种污泥、厌氧/缺氧反应器内污泥和厌氧/好氧反应器内污泥Accumulibacter含量分别为9.3%,61.6%和79.3%,多以团聚结构分布在污泥中.本试验两个反应器内富集的聚磷菌占总细菌的比例要低于Lu等人[34]的研究结果(90%),但高于亢涵[11]和Crocetti等人[35]的研究结果(42%左右),这种差别可能由于不同操作条件(pH,DO,碳源种类等)导致聚磷菌富集能力的差异.

图10 厌氧/好氧,厌氧/缺氧和接种污泥聚磷菌原位分析Fig.10 FISH analysis images(×50)of sludge from RAA,RAO and seed
3 结 论
1)在低温(8 ℃~11 ℃)情况下采用“高注水比、高污泥浓度、先高后低底物负荷”策略可以有效地富集到好氧聚磷菌和反硝化聚磷菌,其中厌氧/好氧反应器在启动40d后达到稳定状态,厌氧/缺氧反应器在启动80d后达到类似的稳定状态.启动完成后,两个反应器内污泥均表现出较好的释磷和吸磷能力;且单位污泥浓度好氧聚磷菌的释磷和吸磷能力均高于反硝化聚磷菌,分别为27.7 mg P/g MLVSS,35.2 mg P/g MLVSS,17.4 mg P/g MLVSS和23.1mg P/g MLVSS.
2)通过批次试验发现,反硝化聚磷菌可以在好氧条件下以氧为电子受体快速吸收磷,而好氧聚磷菌在缺氧环境中以硝酸盐为电子受体进行同步脱氮除磷的能力较弱,仅为6.9mgP/gMLVSS,占好氧吸磷的19.6%,这将大大促进既经济又环境友好的反硝化同步脱氮除磷技术应用于实践中.
3)荧光原位杂交(FISH)分析表明,厌氧/好氧和厌氧/缺氧反应器启动完成后聚磷菌(Accumulibacter)已成为优势种群,分别占细菌总数的61.6%和79.3%,明显高于接种污泥中Accumulibacter的丰度(9.3%).此外,采用含有一定数量聚磷菌的A2O工艺好氧池污泥作为接种污泥,可以促进EBPR 系统中Accumulibacter的有效富集.
[1]ZHANG Hai-ling,FANG Wei,WANG Yong-peng,etal.Phosphorus removal in an enhanced biological phosphorus removal process:roles of extracellular polymeric substances[J].Environmental Science &Technology,2013,47(20):11482-11489.
[2]PENG Zhao-xu,PENG Yong-zhen,GUI Li-juan,etal.Competition for single carbon source between denitrification and phosphorus release in sludge under anoxic condition[J].Chinese Journal of Chemical Engineering,2010,18(3):472-477.
[3]JIANG X X,YANG J X,MA F,etal.Denitrifying phosphorous removal in anaerobic/anoxic SBR system with different startup operation mode[J].Journal of Harbin Institute of Technology,2010,17(6):824-829.
[4]田文德,李伟光,张卉,等.两级生物选择同步除磷脱氮新工艺[J].中国环境科学,2012,32(2):221-225.
TIAN Wen-de,LI Wei-guang,ZHANG Hui,etal.Bi-bio-selective simultaneous phosphorus and nitrogen removal (BBSPN)novel process[J].China Environmental Science,2012,32(2):221-225.(In Chinese)
[5]侯红勋,王淑莹,闫骏,等.不同碳源类型对生物除磷过程释放磷的影响[J].化工学报,2007,58(8):2081-2086.
HOU Hong-xun,WANG Shu-ying,YAN Jun,etal.Effect of different types carbon sources on phosphorus release in enhanced biological phosphorus removal process[J].CIESC Journal,2007,58(8):2081-2086.(In Chinese)
[6]PANSWAD T,DOUNGCHAI A,ANOTAI J.Temperature effect on microbial community of enhanced biological phosphorus removal system[J].Water Research,2003,37(2):409-415.
[7]CARVALHO G,LEMOS P C,OEHMEN A,etal.Denitrifying phosphorus removal:linking the process performance with the microbial community structure[J].Water Research,2007,41(19):4383-4396.
[8]郭春艳,王淑莹,李夕耀,等.聚磷菌和聚糖菌的竞争影响因素研究进展[J].微生物学通报,2009,36(2):267-275.
GUO Chun-yan,WANG Shu-ying,LI Xi-yao,etal.Review on the factors affecting the enrichment culture of PAOs and GAOs[J].Microbiology,2009,36(2):267-275.(In Chinese)
[9]REN N,KANG H,WANG X,etal.Short-term effect of temperature variation on the competition between PAOs and GAOs during acclimation period of an EBPR system[J].Frontiers of Environmental Science &Engineering in China,2011,5(2):277-282.
[10]WINKLER M K H,BASSIN J P,KLEEREBEZEM R,etal.Selective sludge removal in a segregated aerobic granular biomass system as a strategy to control PAO-GAO competition at high temperatures[J].Water Research,2011,45(11):3291-3299.
[11]亢涵,李楠,任南琪.低温强化生物除磷反应器中微生物的竞争关系[J].哈尔滨工业大学学报,2010,42(6):881-885.
KANG Han,LI Nan,REN Nan-qi.Competition between phosphate-accumulating organisms and glycogen-accumulating organisms and the phosphate removal efficiency in EBPR reactor at low temperature[J].Journal of Harbin Institute of Technology,2010,42(6):881-885.(In Chinese)
[12]HE S,GU A Z,MCMAHON K D.Fine-scale differences between Accumulibacter-like bacteria in enhanced biological phosphorus removal activated sludge[J].Water Science Technology,2006,54(1):111-118.
[13]ZOU Hai-ming,LU Xi-wu,SHI Jing.Investigation of denitrifying phosphorus removal organisms in a two-sludge denitrifying phosphorus removal process[J].Asian Journal of Chemistry,2013,25(12):6826-6830.
[14]GUERRERO J,TAYA C,GUISASOLA A,etal.Glycerol as a sole carbon source for enhanced biological phosphorus removal[J].Water Research,2012,46:2983-2991.
[15]国家环保总局.水和废水监测[M].北京:中国环境科学出版社,2002.
Ministry of Environmental Protection of China.Monitoring analysis method of water and wastewater[M].Beijing:China Environmental Science Press,2002.(In Chinese)
[16]SILVA A F,CARVALHO G,OEHMEN A,etal.Microbial population analysis of nutrient removal-related organisms in membrane bioreactors[J].Applied Microbiology and Biotechnology,2012,93(5):2171-2180.
[17]RUIZ-ARBAJOSA P,DE REGT M,BONTEN M,etal.Highdensity fecal enterococcus faecium colonization in hospitalized patients is associated with the presence of the polyclonal subcluster CC17[J].European Journal of Clinical Microbiology &Infectious Diseases,2012,31(4):519-522.
[18]高景峰,陈冉妮,苏凯,等.同步脱氮除磷好氧颗粒污泥形成与反应机制的研究[J].环境科学,2010,31(4):1021-1029.
GAO Jin-feng,CHEN Ran-ni,SU Kai,etal.Formation and reaction mechanism of simultaneous nitrogen and phosphorus removal by aerobic granular sludge[J].Environmental science,2010,31(4):11021-1029.(In Chinese)
[19]卢文健,杨殿海,郭云,等.聚磷菌的快速富集及其除磷特性研究[J].环境污染与防治,2012,34(6):31-36.
LU Wen-jian,YANG Dian-hai,GUO Yun,etal.Rapid enrichment of polyphosphate accumulating organisms and its characteristics of phosphorus removal[J].Environmental Pollution and Control,2012,34(6):31-36.(In Chinese)
[20]ACEVEDO B,OEHMEN A,CARVALHO G,etal.Metabolic shift of polyphosphate-accumulating organisms with different levels of polyphosphate storage[J].Water Research,2012,46:1889-1900.
[21]GUERRERO J,TAYA C,GUISASOLA A,etal.Glycerol as a sole carbon source for enhanced biological phosphorus removal[J].Water Research,2012,46:2983-2991.
[22]BUCCI V,MAJED N,HELLWEGER F L,etal.Heterogeneity of intracellular polymer storage states in enhanced biological phosphorus removal(EBPR)-observation and modeling[J].Environmental Sci-ence &Technology,2012,46(6):3244-3252.
[23]HU J Y,ONG S L,NG W J,etal.A new method for characterizing denitrifying phosphorus removal bacteria by using three different types of electron acceptors[J].Water Research,2003,37(14):3463-3471.
[24]ZHANG L,MA J,LIU Y,etal.Improvement of biological total phosphorus release and uptake by low electrical current application in lab-scale bio-electrochemical reactors[J].Bioelectrochemistry,2012,88:92-96.
[25]KUBA T,MUMLEITNER E,VAN L M,etal.A metabolic model for biological phosphorus removal by denitrifying organisms[J].Biotechnology Bioengineering,2000,52(6):685-695.
[26]ZENG R J,SAUNDERS A M,YUAN Z,etal.Identification and comparison of aerobic and denitrifying polyphosphate‐accumulating organisms[J].Biotechnology Bioengineering,2003,83(2):140-148.
[27]亢涵,王秀蘅,李楠,等.生物除磷系统启动期聚磷菌的FISH 原位分析与聚磷特性[J].环境科学,2009,30(1):80-84.
KANG Han,WANG Xiu-heng,LI Nan,etal.Characterization of phosphate-accumulating organisms in starting-up EBPR by FISH analysis[J].Environmental Science,2009,30(1):80-84.(In Chinese)
[28]PODEDWOMA J,ZUBROWSKA-SUDOL M.Nitrogen and phosphorus removal in a denitrifying phosphorus removal process in a sequencing batch reactor with a forced anoxic phase[J].Environmental Technology,2012,33(2):237-245.
[29]ZENG T,WANG D,LI X,etal.Comparison between acetate and propionate as carbon sources for phosphorus removal in the aerobic/extended-idle regime[J].Biochemical Engineering Journal,2013,70:151-157.
[30]李勇智,王淑滢,吴凡松,等.强化生物除磷体系中反硝化聚磷菌的选择与富集[J].环境科学学报,2004,24(1):45-49.
LI Yong-zhi,WANG Shu-ying,WU Fan-song,etal.Selection and enrichment of denitrifying phosphate accumulating bacteria in biologically enhanced phosphate removal process[J].Acta Scienctiae Circumstantiae,2004,24(1):45-49.(In Chinese)
[31]MARTIN H G,IVANOVA N,KUNIN V,etal.Metagenomic analysis of two enhanced biological phosphorus removal(EBPR)sludge communities[J].Nature Biotechnology,2006,24(10):1263-1269.
[32]MONCLUS H,SIPMA J,FERRERO G,etal.Biological nutrient removal in an MBR treating municipal wastewater with special focus on biological phosphorus removal[J].Bioresource Technology,2010,101(11):3984-3991.
[33]WINKLER M K H,KLEEREBEZEM R,DE BRUIN L M M,et al.Microbial diversity differences within aerobic granular sludge and activated sludge flocs[J].Applied Microbiology and Biotechnology,2012:1-12.
[34]LU H B,OEHMEN A,VIRDIS B,etal.Obtaining highly enriched cultures of candidatus Accumulibacter phosphates through alternating carbon sources[J].Water Research,2006,40(20):3838-3848.
[35]CROCETTI G R,HUGENHOLTZ P,BOND P L,etal.Identification of polyphosphate-accumulating organisms and design of 16S rRNA-directed probes for their detection and quantitation[J].Applied and Environmental Microbiology,2000,66(3):1175-1182.
