金属蛋白酶、表皮生长因子受体、血管内皮生长因子在非小细胞肺癌中的表达及临床意义
2013-09-13尹志永王兴波陈丽娜任士俊杨大勇
尹志永 王兴波 陈丽娜 任士俊 赵 金 杨大勇
1.河北省秦皇岛市第二医院胸外科,河北秦皇岛 066600;2.河北省秦皇岛市第二医院病理科,河北秦皇岛 066600;3.河北省秦皇岛市第二医院麻醉科,河北秦皇岛 066600
近年来,世界各国肺癌的发病率和病死率均呈上升趋势,在多数发达国家,肺癌被列为恶性肿瘤死因的第1位。近70%非小细胞肺癌(non-small cell lung cancer,NSCLC)患者在确诊时已经是晚期,而外科手术切除后3年生存率仍较低[1]。肺癌的侵袭和转移仍是死亡的主要原因,也是目前治疗的难点。本文通过检测NSCLC组织中金属蛋白酶9(MMP9)、表皮生长因子受体(EGFR)、血管内皮生长因子(VEGF)的表达情况,探讨MMP9、EGFR、VEGF与肺癌发生发展的关系,并应用生存分析的方法来分析影响病情及疗效的若干暴露因素的作用大小和方向,对判断其恶性程度和估计预后具有一定的指导意义,也是临床医学研究中较先进的研究手段。
1 资料与方法
1.1 一般资料
选取河北省秦皇岛市第二医院 (以下简称 “我院”)2008年1月~2009年12月手术切除且经常规病理证实的NSCLC标本40例作为NSCLC组,其中男22例,女18例,年龄30~76岁,中位年龄62岁。良性肺组织标本10例(炎性假瘤7例及结核球3例)作为对照组,其中男6例,女4例,年龄45~74岁,中位年龄67岁。在性别、年龄方面NSCLC组与对照组比较,差异无统计学意义(P>0.05)。 NSCLC组中有吸烟史(吸烟总量≥100支/年)24例,无吸烟史16例;腺癌34例,鳞癌5例,未分化癌1例;有淋巴结转移24例,无淋巴结转移16例;生存时间<3年28例,≥3年12例;采用国际抗癌联盟2009年修订的肺癌分期标准[2]进行分期,其中Ⅰ期6例,Ⅱ期20例,Ⅲ期14例。80%的患者术后予以铂类为基础的2~4个疗程的化疗。纳入的病例要求切缘阴性,术后生存期3个月以上。随访截止时间为2013年1月。随访率为100%。
1.2 方法
手术切除的肺癌组织于10%中性甲醛溶液固定12 h后取材,自来水冲洗,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片 4 μm 厚,60℃烤片 2 h,经二甲苯-梯度乙醇脱蜡,自来水冲洗,短暂入蒸馏水待做免疫组化。免疫组化试剂盒采用MAXvision二步法,抗体选用MMP9、EGFR、VEGF单抗、二氨基联苯酸(DAB)显色剂,免疫组化试剂均购自福州迈新生物技术开发有限公司。根据每种抗体要求,进行相应的抗原修复,PBS冲洗3次×3 min,每张切片滴加50 μL正常非免疫动物血清,37℃孵育[3]。除去血清,每切片滴加50 μL一抗,37℃孵育 60 min,PBS液冲洗 3次×3 min后,滴加 50 μL生物素标记的二抗 (MAXvision),37℃孵育15 min,PBS液冲洗3次×3 min,新鲜配制的DAB液显色,苏木精复染,封片后显微镜下观察。
1.3 结果判定
采用单盲法阅片,显色部位应正确,无背景显色。MMP9抗原存在于恶性肿瘤细胞及其周围血管内皮细胞和增生的纤维母细胞的胞浆中;EGFR抗原是一种转膜蛋白,存在于恶性细胞胞浆内;VEGF抗原可诱导血管新生,存在于肿瘤细胞浆内。因此,MMP9胞浆显色、EGFR胞浆/胞膜显色、VEGF胞浆显色,颜色为棕黄色。肿瘤细胞无显色为“-”,显色细胞数<20%为+,20%~50%为++,> 50%及以上为+++。 其中“++”和“+++”为高表达,“-”和“+”为低表达。
1.4 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计数资料用率表示,组间比较采用χ2检验,生存分析的比较用Kaplan-Meier生存曲线,影响远期疗效的相关因素分析采用Cox多因素回归分析法,所有检验和P值均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 DAB染色
对照组:固有层中以淋巴细胞为主,MMP9、EGFR、VEGF蛋白较少,形态较规则,体积较小。见图1。
NSCLC组MMP9、EGFR、VEGF的表达位于细胞浆。见图2。

图1 相关蛋白在对照组中的表达情况(DAB,100×)

图2 相关蛋白在非小细胞癌组中的表达情况(DAB,100×)
2.2 MMP9、EGFR、VEGF在NSCLC组及对照组中的表达
MMP9、EGFR、VEGF在NSCLC组织中表达率分别为 65%(26/40)、50%(20/40)、55%(22/40), 显著高于对照组,差异有统计学意义(P<0.05)。见表1。
2.3 MMP9、EGFR、VEGF蛋白的表达与非小细胞肺癌预后的关系
40例NSCLC患者从手术日期开始随访,至患者死亡结束,未死亡的至2013年1月截止。用Kaplan-Meier生存分析,MMP9、EGFR、VEGF蛋白阳性表达组与阴性表达组在非小细胞肺癌患者3年生存率相比,差异有统计学意义(P<0.05),三种蛋白均阳性表达者,预后最差。见图3。

表1 非小细胞肺癌及肺良性病变组织中MMP9、EGFR、VEGF的表达水平[n(%)]
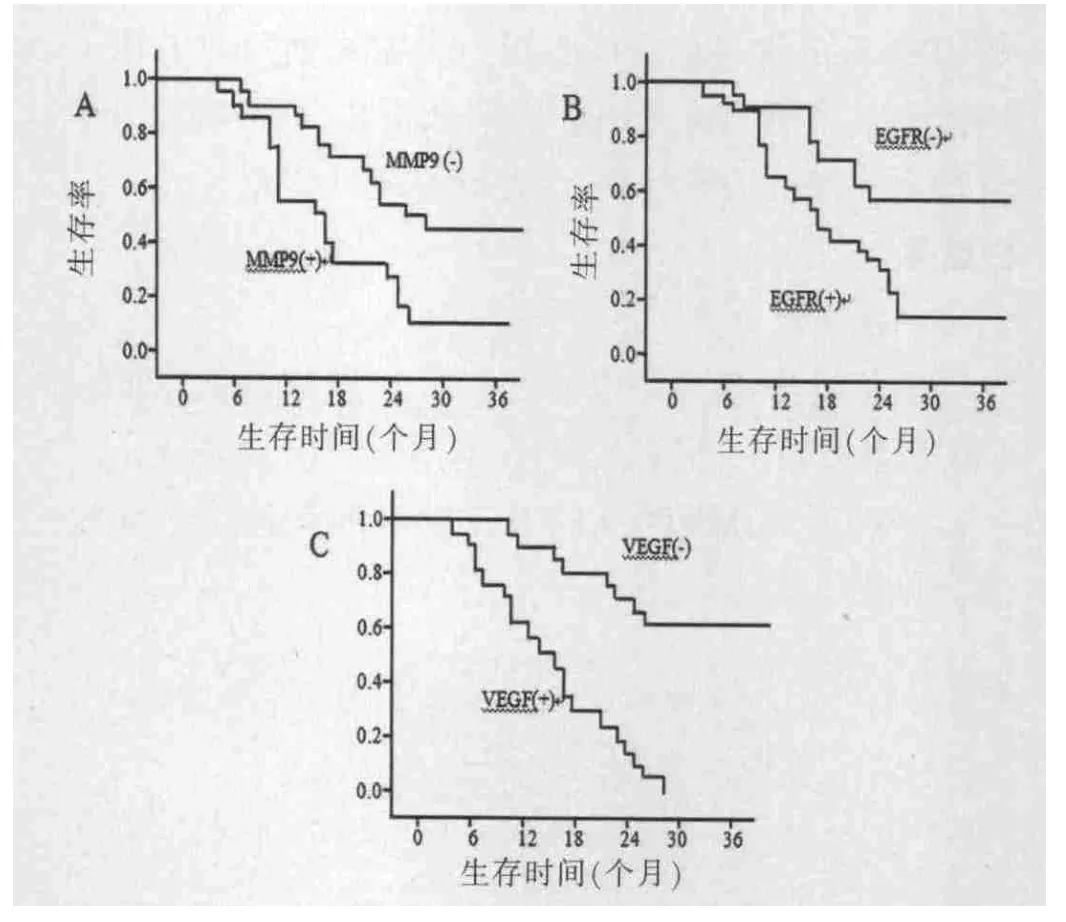
图3 3种蛋白在非小细胞肺癌组织中阳性表达组与阴性表达组患者的Kaplan-Meier生存曲线
2.4 非小细胞肺癌患者术后远期疗效影响因素的分析
以远期疗效为因变量,年龄、病程、病理分期、有无吸烟史、有无淋巴结转移等为自变量进行Cox多因素回归分析。结果表明,远期疗效与年龄、病程、病理分期、吸烟史、淋巴结转移相关(P<0.05)。见表2。
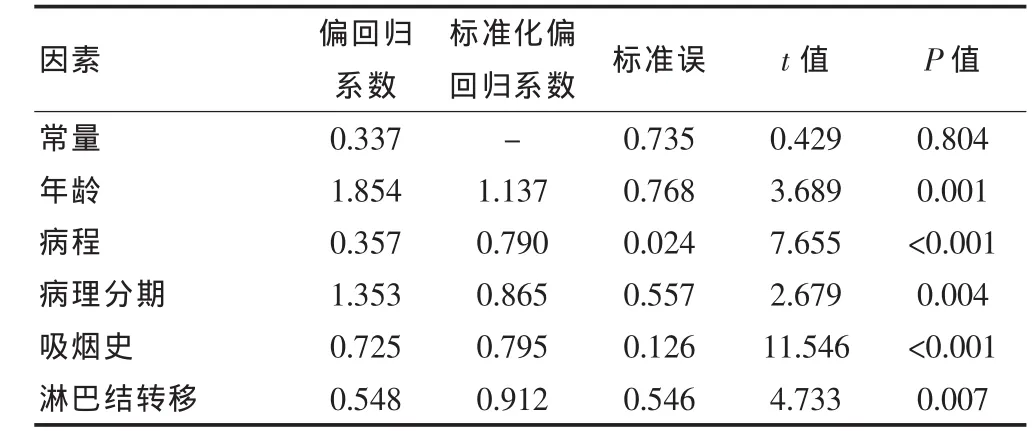
表2 非小细胞肺癌危险因素的Cox多因素回归分析
3 讨论
MMP9是一类锌离子依赖的、催化细胞外基质降解的重要蛋白水解酶,能够破坏局部组织结构,促进肿瘤生长;破坏基质屏障,利于肿瘤转移;通过对ECM的改建,促进肿瘤新生血管的形成。Laak等[4]研究显示,肺癌细胞确实能分泌大量MMP9和VEGF,促进肿瘤血管生成,提供肿瘤生长所需营养条件,促进肿瘤的转移。郑先杰等[5]研究表明MMP9在腺癌组织中表达最高,在癌旁组织表达较弱,在伴有淋巴结转移组中表达增高。本研究结果显示,MMP9在NSCLC组织中的表达水平明显高于对照组(P<0.05)。淋巴结转移组明显高于无淋巴结转移组,Ⅲ期组明显高于Ⅰ+Ⅱ期组。提示MMP9的高表达与肺癌的发生发展密切相关。
EGFR通过其细胞外区域与配体EGF、TNF-α等结合后,引起一系列的生物效应,在正常组织中调控细胞的生长、分裂等重要生理过程,是细胞增殖、黏附、分化等过程的关键调节因子。在癌组织中EGFR的高表达可以促进癌细胞的增殖和新生心血管的形成,促进癌细胞侵袭及远处转移[6-7]。王立波等[8]研究表明EGFR在非小细胞肺癌组织中的阳性表达率明显高于正常组织,且与分化程度、TNM分期及有无淋巴结转移有关。本研究结果与报道基本一致,EGFR在NSCLC组织中的表达水平明显高于对照组(P<0.05)。在伴有淋巴结转移或TNM分期较晚的患者组织中呈高表达,提示EGFR的高表达促进了癌细胞的生长和增殖,加速了癌细胞的侵袭和转移。VEGF是一组生长因子,主要由肿瘤细胞产生,小部分来自细胞间质,能促进新血管的形成和发育。血管形成在肿瘤生长、侵润、转移中起关键作用,受到一系列促进和抑制因子的调节,其中最重要的促进因子之一就是肿瘤细胞在生长过程中分泌的VEGF。胡雅兵[9]报道VEGF在非小细胞肺癌组织中的阳性表达率明显高于癌旁正常对照组织,且与分化程度、TNM分期及有无淋巴结转移有关。本研究结果发现VEGF在NSCLC组织中的表达水平明显高于对照组(P<0.05)。淋巴结转移组显著高于无淋巴结转移组,Ⅲ期组显著高于Ⅰ+Ⅱ期组,说明VEGF也是NSCLC发生发展、侵袭和转移过程中的一个重要因子,Yoshida等[10]的研究结果也支持这一观点。
MMP9、EGFR和VEGF因其自身所具备的一些特异性,使其应用价值得到明显提高,因此,近来受到国外肿瘤学领域学者的广泛关注。其特点及应用范围可归纳为两大类:①由于MMP9、EGFR和VEGF在非小细胞肺癌的特异性表达,使其有望成为非小细胞肺癌的诊断和预后判定新标志;②有望成为抗瘤体新靶标,开拓肿瘤间质治疗新途径。这是因为MMP9、EGFR和VEGF基因组较稳定,抗原丢失和治疗耐受的概率较小;MMP9、EGFR和VEGF是仅在局部表达的膜分子,不能分解为可溶性产物进入血液循环,保证了肿瘤局部存在丰富的MMP9、EGFR和VEGF靶标[11]。目前,国外在上述两个方面的研究均取得较大进展,如已将鼠MMP9、EGFR和VEGF单克隆抗体F19用于临床诊断,应用另一MMP9、EGFR和VEGF抗体BIBH1对非小细胞肺癌进行治疗,效果明显(Ⅱ期临床研究)[12]。 经过研究发现,MMP9、EGFR、VEGF 在NSCLC组中的表达水平显著高于对照组(P<0.05)。MMP9、EGFR、VEGF阳性表达率越高,生存时间越短。提示MMP9、EGFR与VEGF参与NSCLC的发生和发展,并起协同作用。影响NSCLC患者术后远期疗效的相关因素较多,与患者的年龄、病理分期、病程、吸烟史、淋包括巴结转移。
[1]Takano T.Treatment of lung cancer[J].N Engl J Med,2009,361(25):2485.
[2]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[3]Cohen S,Carpenter G,King Jr.Epidermal growth factor–receptor-protein kinase interactions.Co-purification of receptor and epidermal growth factor-enhanced phosphorylation activity[J].J Biol Chem,1980,255(10):4834-4842.
[4]Laak E,Scheffler A,Burkholder I,et al.Pretreatment vascular endothelial growth factor(VEGF)and matrix metalloproteinase-9(MMP-9) serum levels in patients with metastatic non-small cell lung cancer(NSCLC)[J].Lung Cancer,2005,50(1):51.
[5]郑先杰,孙明飞,张双林,等.MMP-9及其抑制剂TIMP-2在非小细胞肺癌中的表达与病理特征的相关性[J].河南大学学报:医学版,2012,11(30):265-267.
[6]Hirsch FR,Varella GM,Bunn PA,et al.Epidemal growth factor receptor in non-small-cell lung carcinomas:correlation between gene copy number and protein expression and impact on prognosis[J].J Clin Oncol,2003,21(20):3798-3807.
[7]Ono M,Kuwano M.Molecular mechanisms of epidermal growth factor receptor(EGFR)activation and response to Gefitinib and otherEGFR-targetingdrugs[J].ClinCancerRes,2006,12(15):7242-7251.
[8]王立波,席妍,王彦荣,等.非小细胞肺癌组织MMP-2 EGFR表达及 MVD 的研究[J].中国肿瘤临床,2009,36(22):1300-1303.
[9]胡雅兵.EGFR、VEGF在非小细胞肺癌中的表达意义及与微血管密度之间的关系[J].四川医学,2011,32(7):1007-1011.
[10]Yoshida S,Amano H,Hayashi I,et al.COX-2/VEGF-dependent facilitation of tumor associated angiogenesis and tumor growth in vivo[J].Lab Invest,2003,83(10):1385-1394.
[11]Vincent A,Miller.EGFR mutations and tyrosine kinase inhibition in non-small cell lung cancer[J].Semin in Oncol Nurs,2008,24(1):27-33.
[12]Kumar A,Petri ET,Halmos B,et al.Structure and clinical relevance of the epidermal growth factor receptor in human cancer[J].J Clin Oncol,2008,26:1742-1751.
