缺血预处理对兔肝细胞冻存的影响
2013-09-13苗伏龙张立军于则利
苗伏龙 刘 鹏 魏 明 张立军 于则利
1.河北医科大学第一医院肝胆外科,河北石家庄 050031;2.河北医科大学第一医院普外科,河北石家庄 050031;3.首都医科大学附属北京同仁医院普外科,北京 100730
近几十年来,肝细胞的实验和临床应用研究已经取得了卓越成就,尤其是在生物人工肝和肝细胞移植等方面,为肝脏疾病的治疗展现了诱人的前景[1-6]。随着对肝细胞需求的不断增加,寻找可以长期有效保存肝细胞的方法就迫在眉睫。此外,目前已有的研究表明合适的肝脏缺血预处理 (ischemic preconditioning,IPC)可以为肝脏缺血再灌注损伤提供有效的保护[7-19]。该实验正是利用缺血预处理对肝脏产生的这种保护机制,通过对不同时间缺血预处理的兔肝细胞存活率及功能情况的检测,探讨对兔肝脏进行适当时间的缺血预处理是否可以提高分离后肝细胞低温保存的效果,从而推动其在临床实践中的应用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与分组 军事医学科学院实验动物中心提供纯种雄性新西兰大白兔40只,3月龄,体重2~2.5 kg,随机分为 4 组:未预处理组(NPC),5 min 缺血预处理组(IPC5),10 min 缺血预处理组(IPC10),15 min缺血预处理组(IPC15)。
1.1.2 主要试剂仪器 电热恒温水浴箱为上海医用恒温设备厂生产,高速低温台式离心机为德国Eppendorf公司生产,4℃冰箱及-20℃冰箱为中国海尔生产,-80℃冰箱为日本 SANYO生产,Beckman SYNCHRON CX4CE型全自动生化分析仪为美国Beckman公司生产,Ⅳ型胶原酶、Hanks液、D-hanks液和台盼蓝购于美国Sigma公司,RPMI-1640培养液和胎牛血清购于美国Hyclone公司,二甲基亚砜(DMSO)购于德国Appliche公司。
1.2 试验方法
1.2.1 缺血预处理 术前禁食 12 h,20%乌拉坦以5 mL/kg耳缘静脉注射麻醉动物,腹部皮肤褪毛,常规消毒铺巾,腹正中切口进入腹腔,暴露并游离肝脏,分离出下腔静脉、门静脉和肝动脉,NPC组不行特殊处理;IPC5组为无损伤血管夹夹闭肝血供5 min,再复流5 min;IPC10组为无损伤血管夹夹闭肝血供10 min,再复流10 min;IPC15组为无损伤血管夹夹闭肝血供15 min,再复流 15 min。
1.2.2 分离肝细胞 采用改良Seglen二步胶原酶灌注法分离肝细胞[20],收集的肝细胞,加入含20%胎牛血清的PRMI-1640液制成悬液,细胞浓度为4×105/mL。
1.2.3 肝细胞的低温保存 将新制备的细胞悬液移入冻存液 (为含 15%DMSO、20%胎牛血清的 PRMI1640培养液)中,终浓度配制成 4×106/mL,然后移入2 mL的冻存管中,各组分别制备30个样本。将样本放置4℃冰箱中30 min→-20℃冰箱中放置1 h→-80℃冰箱中放置4 h→然后快速放于-196℃液氮中保存。
1.2.4 复苏 各组分别于 2、3、4周后取出样本 10个,立即置于37℃水浴箱内解冻复苏。1000 r/min离心5 min,离心3次,弃去上清液,加入RPMI1640培养液,重新混悬,浓度为 4×105/mL。
1.2.5 指标检测 将上述冻存前及复苏后的肝细胞悬液分别取样,用锥虫蓝拒染法测定细胞存活率。将各组肝细胞于复温后各时段分别取样进行培养,并于培养24 h后分别取细胞上清液,检测谷丙转氨酶(ALT)。
1.3 统计学方法
采用统计软件SPSS 13.0对数据进行分析,正态分布计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组冻存前肝细胞存活率比较
各组分离肝细胞经过锥虫蓝拒染法检测,肝细胞存活率差异无统计学意义(P>0.05)。见表1。
表1 各组冻存前肝细胞存活率比较(%,±s)

表1 各组冻存前肝细胞存活率比较(%,±s)
注:NPC组:未预处理组;IPC5组:5 min缺血预处理组;IPC10组:10 min缺血预处理组;IPC15组:15 min缺血预处理组
组别 只数 存活率NPC组IPC5组IPC10组IPC15组10 10 10 10 85.21±2.82 86.16±3.07 84.76±1.98 85.18±2.68
2.2 各组不同时段冷冻复温后肝细胞存活率比较
用锥虫蓝拒染法测定各时段冷冻复温后肝细胞存活率结果为:①2周时各组比较差异有统计学意义(P=0.00 < 0.05)。 两两比较后发现,IPC5组与 IPC10组比较差异无统计学意义 (P=0.51 > 0.05),IPC5组≈IPC10组>NPC组>IPC15组。②3周时各组比较差异有统计学意义(P=0.00 < 0.05)。 两两比较后发现,IPC5组与IPC10组比较差异无统计学意义(P=0.08>0.05),IPC5组≈IPC10组>NPC 组>IPC15组。③4 周时各组比较差异有统计学意义(P=0.00 < 0.05)。 两两比较后发现,IPC5组与IPC10组比较差异无统计学意义(P=0.16 > 0.05),IPC5 组≈IPC10组 >NPC 组>IPC15组。此外,还可发现同组不同时段复苏的肝细胞存活率差异均无统计学意义 (P=0.17、0.20、0.17、0.50)。见表2。
表2 各组不同时段冷冻复温后肝细胞存活率比较(%,±s)

表2 各组不同时段冷冻复温后肝细胞存活率比较(%,±s)
注:NPC组:未预处理组;IPC5组:5 min缺血预处理组;IPC10组:10 min缺血预处理组;IPC15组:15 min缺血预处理组
组别 只数 2周 3周 4周NPC组IPC5组IPC10组IPC15组P值10 10 10 10 59.37±1.09 76.81±1.88 76.34±2.01 47.29±1.12< 0.05 58.94±1.18 76.66±1.63 75.56±1.40 47.12±1.23< 0.05 58.41±1.04 75.64±1.01 74.84±1.62 46.70±1.15< 0.05
2.3 各组ALT检测比较
各组不同时间冷冻复温后分别取样进行培养,并于培养24 h后分别取细胞上清液,检测ALT。结果为:①2周时各组比较差异有统计学意义(P=0.00<0.05)。 两两比较后发现,IPC5组与 IPC10组比较差异无统计学意义 (P=0.21 > 0.05),IPC5组=IPC10组<NPC组<IPC15组。②3周时各组比较差异有统计学意义 (P=0.00 < 0.05)。 两两比较后发现,IPC5组与IPC10组比较差异无统计学意义 (P=0.06 > 0.05),IPC5组≈IPC10组<NPC组<IPC15组。③4周时各组比较差异有统计学意义(P=0.00 < 0.05)。 两两比较后发现,IPC5组与IPC10组比较差异无统计学意义 (P=0.053 > 0.05),IPC5组≈IPC10组<NPC 组<IPC15组。 此外,还可发现同组不同时段复苏的肝细胞ALT检测均无差异统计学意义(P=0.80、0.63、0.27、0.60)。 见表 3。
表3 各组不同时段复温后ALT的检测(U/L,±s)
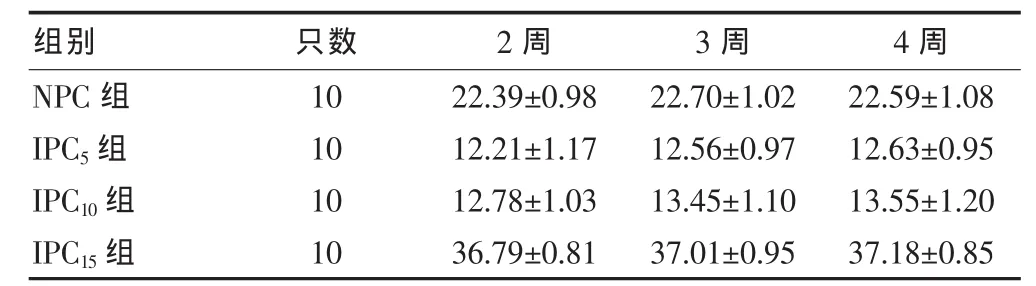
表3 各组不同时段复温后ALT的检测(U/L,±s)
注:NPC组:未预处理组;IPC5组:5 min缺血预处理组;IPC10组:10 min缺血预处理组;IPC15组:15 min缺血预处理组;ALT:谷丙转氨酶
NPC组IPC5组IPC10组IPC15组10 10 10 10 22.39±0.98 12.21±1.17 12.78±1.03 36.79±0.81 22.70±1.02 12.56±0.97 13.45±1.10 37.01±0.95 22.59±1.08 12.63±0.95 13.55±1.20 37.18±0.85组别 只数 2周 3周 4周
3 讨论
自1986年Murry等[21]在对心肌组织的研究中发现缺血预处理效应以来,对于各种组织器官的缺血预处理的相关研究就在不断的进行中,到目前为止已取得了许多重要成果,但仍然存在许多尚未解决的难题,其中之一就是对于不同的器官如何选择合适的预处理时间,从而对器官达到最佳的保护作用以及如何将这一保护作用运用到其它相关的研究中。
缺血预处理的保护作用在多种器官中都普遍存在,其具体机制尚未完全明确。不同的研究器官采用的缺血预处理的时间不同,比如Murry等[21]在研究狗的心肌IRI中使用的是5 min阻断,5 min开放的预处理方式,而Clavien等[22]开展的临床研究中采用的方式是10 min阻断,10 min开放的预处理方式等等。脑的预处理方式一般为1~2 min,心肌试验多采用3~5 min,骨骼肌一般为5 min[9]。不同的试验者研究的结果可能不同,比如对于肝组织,Yadav等[7]曾对照研究了15 min预处理方式,结果显示与5 min的处理方式无明显区别。而其他研究则显示[9,23],5 min预处理与15 min预处理是有差异的。
目前深低温保存是肝细胞长期保存的主要方法[5-6,24-26],影响其冻存效果的因素有很多,比如:冻存保护剂的选择、冻存剂的浓度、细胞的浓度、降温和复温方法等等。正是基于上述已知的冻存肝细胞较为适宜的因素基础上进行的本次实验,结果显示了对于兔肝脏进行不同时间的缺血预处理后分离保存,5 min组和10 min组可以增强肝细胞的冻存效果,两者无统计学差异,而15 min组不但没起到保护作用反而增加了肝细胞的破坏。
本实验初步探讨了不同时间缺血预处理对于兔肝细胞深低温保存的影响,得出了上述结论,但是,实验结果受研究条件、方法和实验对象等多因素的影响,可能会造成结果出现一定的差异。此外,本实验尚存有一些亟待解决的难题和值得探讨的方面:①缺血预处理的机制。②最佳缺血处理的时间。③不同时间缺血预处理保护作用在不同的种属之间可能有差异。④不同方式缺血预处理的比较,等等。因此今后仍需继续进行该课题的相关研究,进一步探讨缺血预处理的临床应用价值。
[1]Jorns C,Ellis EC,Nowak G,et al.Hepatocyte transplantation for inherited metabolic diseases of the liver[J].Intern Med,2011,272(3):201-223 .
[2]Ken H,Takeshi A,Zhenghao J,et al.Hepatocyte Transplantation from Steatotic Liver in a Rat Model [J].Surg Res,2007,142(1):104-112.
[3]Dianat N,Steichen C,Vallier L,et al.Human pluripotent stem cells for modelling human liver diseases and cell therapy[J].Curr Gene Ther,2013,13(2):120-132.
[4]Dhawan A,Strom SC,Sokal E,et al.Human hepatocyte transplantation[J].Methods Mol Biol,2010,640:525-534.
[5]Terry C,Dhawan A,Mitry RR,et al.Cryopreservation of isolated human hepatocytes for transplantation:State of the art[J].Cryobiology,2006,53(2):149-159.
[6]Lee JH,Park JH,Park HJ,et al.Cryopreservation of immobilized rat hepatocytes for the development of a bioartificial liver system[J].Transplant Proc,2012,44(4):1005-1008.
[7]Yadav SS,Sindram D,Perry DK,et al.Ischemic precondition protects the mouse liver by inhibition of apoptosis through a caspaspe-dependent path-way[J].Hepatology,1999,30:1223-1231.
[8]秦嵩,孙备,许军,等.缺血预处理对大鼠肝脏低温保存的保护作用[J].中国普外基础与临床杂志,2003,10(4):323-327.
[9]关养时,吕新生.不同时间的缺血预处理对肝脏缺血再灌注损伤的影响[J].中华外科杂志,1999,37(11):700.
[10]Helewski K,Kowalczyk ZG,Czecior E,et al.Protective effect of intermittent clamping of the portal triad in the rat liver on liver ischemia-reperfusion in jury [J].Hepat Mon,2011,11(6):445-451.
[11]Wang M,Shen J,Feng B,et al.Remote ischemic preconditioning promotes early liver cell proliferation in a rat model of small-for-size liver transplantation [J].Surg Res,2013,179(1):245-253.
[12]Jin LM,Jin SF,Liu YX,et al.Ischemic preconditioning enhances hepatocyte proliferation in the early phase after is-chemia under hemi-hepatectomy in rats [J].Hepatobiliary Pancreat Dis Int,2012,11(5):521-526.
[13]Montalvo EE,Pina E,Montalvo AC,et al.Urrutia R,role of ischemic preconditioning in liver surgery and hepatic transplantation[J].Gastrointest Surg,2009,13(11):2074-2083.
[14]梁珊,石 中,聂盛丹.缺血预处理预防肝细胞分离过程中的缺血再灌注损伤[J].中国组织工程研究与临床康复,2011,15(44):8293-8296.
[15]李新辉,王淑敏.缺血预处理对鼠肝细胞缺血再灌注损伤的影响[J].临床合理用药,2012,5(7A):41-43.
[16]张翌,蔡逊,潘明新,等.供肝缺血预处理保护作用的实验研究[J].华南国防医学杂志,2011,25(3):181-190.
[17]Fu JZ,Wang Y,Zhang LJ,et al.Protective effect of liver ischemic preconditioning on rat hepatocytes [J].Sci China C Life Sci,2009,52(9):836-840.
[18]陈闯,李文美,蒋厚文,等.肝脏及肢体缺血预处理抗大鼠肝缺血再灌注损伤的实验研究[J].中国普通外科杂志,2010,19(1):23-27.
[19]Tapuria N,Junnarkar SP,Dutt N,et al.Effect of remote ischemic preconditioning on hepatic microcirculation and function in a rat model of hepatic ischemia reperfusion injury[J].HPB,2009,11(2):108-117.
[20]Seglen PO.Citation frequency and journal impact:valid indicators of scientific quality? [J].J Intern Med,1991,229(2):109-111.
[21]Murry CE,Jennings RB,Reimer KA.Preconditioning with ischemia:a delay of lethal cell injuty in ischemec myocardium[J].Circulation,1986,74(5):1124-1126.
[22]Clavien PA,Yadav S,SindramD,et al.Protective effects of ischemic preconditioning for liver resection performed under inflow occlusion in humans[J].Ann Surg,2000,232(2):155-162.
[23]Lloris JM,Cejalvo D,Toledo LH,et al.Preconditioning:effect upon lesion modulation in warm liver ischemia[J].Transplant Proc,1993,25(6):3303-3306.
[24]杨波,周燕,刘宝林,等.肝细胞低温保存的实验研究[J].中国生物医学工程学报,2011,30(2):308-311.
[25]冯渊,李德卫,杨晓波.原代肝细胞的分离和移植[J].中国组织工程研究,2012,16(18):3314-3317.
[26]杭化莲,张磊,施晓雷.成人原代肝细胞的分离、培养及冻存[J].世界华人消化杂志,2011,19(19):2016-2021.
