适合伽玛刀照射的猫功能区慢性点燃癫痫模型制作及其致痫机制
2013-09-12董长征李文玲董秀芳岳向勇康进生王蕴欣孔艳丽赵文清河北省人民医院河北石家庄05005
董长征 李文玲 董秀芳 岳向勇 康进生 王蕴欣 孔艳丽 赵文清(河北省人民医院,河北 石家庄 05005)
最近几年临床上应用低剂量伽玛刀照射治疗功能区癫痫取得一定疗效〔1〕,但其治疗效果及作用机制仍在探索研究之中〔2〕。因此,能否制作一种适合予伽玛刀照射研究的实验动物模型,成为伽玛刀研究的重要前提条件。本实验观察青霉素建立确切、稳定功能区癫痫模型的可行性并初步探讨伽玛刀照射治疗癫痫的可能机制。
1 资料与方法
1.1 动物、试剂及仪器 健康雄性成年猫18只,体重2.5~3.5 kg,由河北医科大学实验动物中心提供。注射用青霉素(华北制药股份有限公司,批号13020655);异丙酚(200 mg/支,北京费森尤斯公司);721型分光光度计(山东高密彩虹分析仪器有限公司)。核磁共振仪(Signa 1.5T,美国GE公司);伽玛刀(LEKSELL B型,瑞典ELEKTA公司);生物信号定量记录分析系统(MS4000U-l型,广州市龙飞达科技有限公司)。
1.2 分组 选择雄性成年猫18只,按随机数字表法分为正常对照组、癫痫模型组、伽玛刀照射组。每组6只。正常对照组猫额功能区皮质注射生理盐水;癫痫模型组猫额功能区皮质多次注射青霉素制作点燃癫痫模型,伽玛刀照射组在造模成功后给予伽玛刀照射。观察时间点为伽玛刀照射后12 w。
1.3 模型制作 将实验动物用微量泵持续异丙酚静脉麻醉(3 ~7 μg·kg-1·min-1)。麻醉后剃去头顶毛,固定于动物台上,消毒,铺无菌洞巾。于猫两耳前缘连线中点前2.0 cm左外侧0.5 cm额叶运动性功能区(Sniderrs和Niercerwt的猫立体定位图谱)做直切口,钻孔,扩大骨窗约1.5×1.5 cm,剪开硬膜,暴露右侧十字沟及乙状前回(运动性功能区),于皮层放置MS4000U-1生物信号定量记录分析系统铂金电极,描记正常脑电图20 min。再用MS4000U-1生物信号定量记录分析系统刺激器,刺激强度5~6 V,波宽1 ms,频率20 Hz,刺激波为断续波,以引起对侧后肢肌肉收缩的刺激点处皮质定为运动中枢。用含有15%亚甲基蓝的生理盐水稀释80万IU的青霉素,配制出的青霉素浓度为20万IU/ml,微量加样器抽取0.05 ml,于实验组动物乙状前回皮层无血管区以60°角倾斜刺入皮层1 mm约60 s注完,然后用庆大霉素盐水冲洗,严密缝合硬膜,骨蜡覆盖骨3窗,以保护脑组织,缝合头皮。分别于注射后12 w描记皮层脑电图。正常对照组注射生理盐水。癫痫模型组、伽玛刀照射组动物每隔5 d,重复注射1次,共5次;正常对照组同上注射等量生理盐水作为对照。
1.4 伽玛刀照射 于12 w时将伽玛刀照射组猫用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,将其头部安装于Leksell立体定向头架,用核磁共振仪(MRI)进行无间隔定位扫描,层厚2 mm,扫描图像经计算机网络传至Gamma Plan系统制定治疗计划,确定照射靶区位于右侧额叶的X-Y-Z坐标。然后将固定猫脑的Leksell框架按所定坐标安放在伽玛刀定位架上,用4 mm准直器,对靶区脑组织实施照射,边缘剂量15 Gy,等剂量曲线50%。
1.5 行为学观察和脑电图记录 注射青霉素后观察记录每只动物的癫痫发作情况,采用Smialowki 6级评分法检测行为学变化,标准如下:0级:没有行为上的发作;Ⅰ级:节律性点头或头部颤搐;Ⅱ级:阵挛性咀嚼;Ⅲ级:头部颤搐加前肢阵挛性抽搐;Ⅳ级:袋鼠姿势(上身直立);Ⅴ级:跌倒;Ⅵ级:强直性惊厥。凡显示连续5次Ⅲ级以上发作的动物为达到点燃标准。然后采用MS4000 U-1生物信号定量记录分析系统记录各组动物皮层脑电图30 min。记录点为双侧十字沟及乙状前回(参数设置:单位μV,高频滤波 25 Hz,平滑滤波 2点,陷波 50 Hz,增益5 000倍,扫描速度8 div/s,采样速率110 ms)。
1.6 分光光度计测定额叶皮质功能区的γ-氨基丁酸 (γ-GABA)和谷氨酸 (Glu)含量 各组动物饲养在温暖、水和食物充分的环境中,在观察完动物的发作及脑电图后,于12 w时将正常对照组及癫痫模型组两组动物处死,快速取出大脑额叶组织匀浆后,用721型分光光度法将样本中测定γ-GABA和Glu含量。反应体系:1 ml反应液中加入1 ml茚三酮-乙二醇甲醚和1滴吡啶,以蒸馏水定容10 ml。37℃恒温下反应20 min后,蒸馏水调零,于最大吸收波长为570 nm测定混合溶液的吸光度值,并以下公式计算出猫脑额叶组织中γ-GABA和Glu含量。
2 结果
2.1 行为学及脑电图结果所有动物未出现死亡;3例出现头皮切口处少量分泌物;各组动物体重无明显减轻,饮食正常;正常对照组在12 w内未出现抽搐发作;癫痫模型组、伽玛刀照射组在12 w内均出现了多次连续5次Ⅲ级以上发作,达到了点燃标准;发作表现为面部及胡须的抖动,流涎,随之出现左侧上下肢的剧烈强直阵挛,很快泛化到右侧肢体,有时伴有猫的二便失禁,抽搐发作时间持续约30~50 s,发作频率3~4次/w。正常对照组皮层脑电图以低波幅快波为主(图1)。癫痫模型组表现为簇状棘波放电(图2),伽玛刀照射组显示癫痫档放电减少。

图1 正常对照组猫皮层脑电图
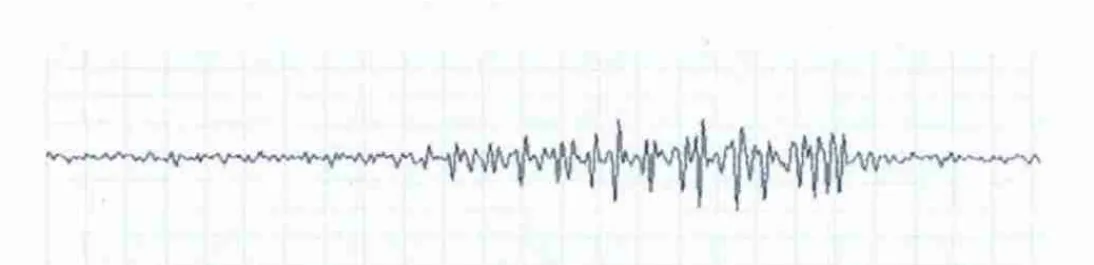
图2 癫痫模型组猫皮层脑电图
2.2 脑组织内γ-GABA和Glu含量测定 正常对照组脑组织内Glu含量为(11.053±5.915)mol/mg,明显低于癫痫模型组〔(62.508 ±8.139)mol/mg〕(t=2.236 1,P=0.047 0)。伽玛刀照射组Glu含量〔(41.272±5.462)mol/mg〕明显低于模型组(P<0.05)。正常对照组脑组织内γ-GABA含量为(47.401±9.423)mol/mg,明显高于癫痫模型组〔(13.201±7.324)mol/mg〕(t=2.798 4,P=0.017 3)。伽玛刀照射组 γ-GABA含量〔(36.736±5.533)mol/mg〕明显高于模型组(P<0.05)。
3 讨论
功能区癫痫是致痫灶位于脑功能区的一类难治性癫痫,临床上处理比较困难,手术致残率较高,并发症多〔3〕,而且,一旦功能区与致痫灶完全重合,手术将无法切除病灶;而立体定向放射伽玛刀治疗具有定位精确,对周围组织损伤小的优点〔4〕。
目前,伽玛刀治疗功能区癫痫的机制尚不十分明确,为了进一步研究伽玛刀治疗功能区癫痫的机制,需要建立一个适合伽玛刀照射的功能区慢性点燃癫痫模型。尽管癫痫动物模型种类繁多,并且在癫痫实验研究中起着非常关键性作用,但造成癫痫的遗传和获得性因素十分复杂,非任何一种动物模型能代表。Sarkisian〔5〕认为,当一个动物被当作特定的人类痫性发作及癫痫模型时,他应当具备4个标准:①它应当具备特征性的脑电图改变。②病因相似。③对那些由于特殊的病理改变(如局灶损伤和皮层发育不良)所引起的癫痫,动物模型也应具有相似的病理改变。④模型动物所表现的行为特征,包括痫性发作样行为、短程及长程行为缺失,应在某种程度上反映出人类行为表现。本实验采用猫功能区慢性点燃癫痫模型,而不是大鼠癫痫模型,是因为猫脑结构与人脑结构非常相似,在进化上更接近人类;相对于大鼠而言,猫脑体积较大,大脑半球已出现了明显的沟回,而且行动灵活、能发声,有利于观察术后行为学改变及功能保护情况〔6〕。
伽玛刀治疗功能区癫痫是一个缓慢起效的过程,起效时间窗在8~12 w左右,因此,急性癫痫模型不适合伽玛刀治疗的实验研究。青霉素作为一种经典致痫剂,其急性癫痫模型已获公认〔7〕。本实验采用多次注射青霉素成功建立了慢性癫痫模型。另外,为了建立功能区模型,本实验根据猫立体定位图谱,解剖定位猫脑额叶乙状前回为负载肢体运动的皮质功能区,并用MS4000U-1生物信号定量记录分析系统刺激器刺激相应脑皮质,以引起对侧后肢肌肉收缩的刺激点处皮质定为运动中枢,在造模过程中,将一定剂量青霉素注射此处,引起猫的抽搐发作,能够很好地模拟临床上人类致痫灶位于中央沟之前中央前回皮质的功能区癫痫。此外,实验动物能够很好地完成伽玛刀照射的全过程,从头架固定到伽玛刀照射,实验动物无明显不适反应;MRI影像上可以清晰显示猫的额叶功能区皮质,用4 mm准直器,等剂量曲线50%可以顺利包裹照射靶点,进行精确照射,保证了实验的准确性和有效性。
γ-GABA和Glu分别是哺乳动物大脑皮质主要的抑制性神经递质和兴奋性神经递质。持续刺激神经元可以导致钠潴留及膜去极化,钠潴留又可以导致细胞外钾浓度升高,并对邻近细胞产生有效去极化。神经元的膜去极化和离子运动可以使Glu等去极化物质的效应更加明显,而γ-GABA等超极化物质的效应表现的很小。这就使在同一神经元内的Glu介导的兴奋性增强,而γ-GABA介导的抑制性减弱,导致癫痫发作性放电的产生及维持〔8〕。若一个足够大的神经元群体在青霉素的直接作用下,打乱了正常的兴奋性和抑制性的平衡,就会建立一个正反馈环,导致病灶群体的同步化发作性放电,这种放电达一定强度就可以驱动邻近神经元,导致癫痫活动的传播。本实验发现癫痫模型组兴奋性神经递质Glu含量增加,而抑制性神经递质γ-GABA含量降低,推断青霉素致痫的作用机制为:青霉素改变了脑功能区皮质神经网络的兴奋-抑制平衡,引起抑制性突触活动减弱或兴奋性突触活动增强,从而导致神经元兴奋性增高。当神经元兴奋性突触后电位综合超过一定阈值即可产生阵发性去极化飘移,从而产生痫样放电及癫痫症状。
综上,猫脑额叶功能区皮质多次注射致痫剂青霉素,成功建立了慢性癫痫模型,并能满足伽玛刀照射的需要,此模型不足之处在于造模时间较长,对动物有一定损伤,有待进一步改进完善。
1 李敏杰.癫痫的伽玛刀治疗〔J〕.中国实用医药,2011;6(20):38-40.
2 霍文滔,梁军潮.伽玛刀放射治疗癫痫的作用机制研究进展〔J〕.立体定向和功能性神经外科杂志,2010;23(4):246-8.
3 Kim YH,Kim CH,Kim JS.Resection frequency map after awake resective surgery for non-lesional neocortical epilepsy involving eloquent areas〔J〕.Acta Neurochir(Wien),2011;153(9):1739-49.
4 Ganz JC,Reda WA.Radionecrosis following gamma knife treatment for mesial temporal lobe epilepsy〔J〕.Br J Neurosurg,2011;25(5):649-51.
5 Sarkisian MR.Overview of the current animal models for human seizure and epileptic disorders〔J〕.Epilepsy Behav,2001;2(3):201-16.
6 董长征,赵文清,岳向勇,等.伽玛刀照射对正常老龄猫额叶皮质组织形态及超微结构的影响〔J〕.中国老年学杂志,2010;30(10):2954-6.
7 董长征,赵文清,李文玲,等.伽玛刀照射诱导猫功能区皮质细胞凋亡研究〔J〕.中国微侵袭神经外科杂志,2010;15(1):33-6.
8 Fassio A,Raimondi A,Lignani G.Synapsins:from synapse to network hyperex citability and epilepsy〔J〕.Semin Cell Dev Biol,2011;22(4):408-15.
